中脑导水管周围灰质外侧区神经元P2X7受体激活对胞内钙离子水平的影响
李鹏涛,李尤艳,肖 智
0 引 言
三磷酸腺苷(adenosine triphosphate,ATP)可以作为一种信号物质,参与神经信息传递。ATP与其特异性受体或受体亚型结合后诱发细胞外钙离子和Na+胞内,细胞膜去极化形成动作电位。研究发现,ATP受体分为P2X和P2Y两类,P2X受体目前分为P2X1~7共7个亚型[1],其中 P2X7受体由于特殊的分子结构和功能特点,在炎症、慢性疼痛、肿瘤、神经系统疾病的病理机制中发挥着重要作用。研究证实机体存在一个由多个脑区组成的调制痛觉的神经网络系统即内源性的疼痛调制系统,其中中脑导水管周围灰质(midbrain periaqueductal gray,PAG)是该疼痛调制系统的关键结构之一。本课题组前期研究中发现,大鼠PAG中有P2X7受体表达且P2X7受体激活介入大鼠炎症性疼痛以及吗啡耐受的形成及维持机制[2-3]。
激光共聚焦(laser scanning confocal microscopy,LSCM)技术是当前生物医学研究中较前沿的技术,可以在亚细胞水平上对钙离子实时动态变化等信息进行采集[4-5]。基于P2X7受体激活后是否引起PAG神经元细胞内钙离子水平的变化未见文献报道,本实验拟通过原代培养中脑导水管周围灰质外侧区(lateral periaqueductal gray,lPAG)神经元细胞,采用激光共聚焦技术观察P2X7受体激动剂苯甲酰苯甲酸ATP(BzATP)对lPAG神经元细胞胞内钙离子变化的影响,从而证实lPAG中神经元P2X7受体激活引起胞内钙离子变化进而参与对lPAG神经元细胞内信号转导通路的调节。
1 材料与方法
1.1 动物采用SPF级SD孕鼠所产<3 d乳大鼠,雌雄不拘,购于重庆陆军军医大学,实验动物合格证号:SCXK(渝)2012-0005。乳大鼠置于湿度45%~50%,温度(22±4)℃左右环境中,自由饮食,自然采光。本实验操作严格遵守遵义医科大学有关实验动物伦理纲要进行,实验中尽量减少乳大鼠使用量以及乳大鼠所承受的痛苦。
1.2 主要仪器与试剂P2X7受体拮抗剂A-740003(美国Sigma公司),B27培养基、Neurobasal培养基和层黏蛋白(laminin)(英国Gebco公司);BzATP、阿糖胞苷购于Sigma-Aldrich公司,小鼠抗大鼠神经元特异性核蛋白(Neuron specific nuclear protein,NeuN)抗体购于abcam公司,山羊抗小鼠IgG-HRP(北京中山金桥生物技术公司);Fluo-4/AM荧光染料、F-127(日本Dojindo公司);激光共聚焦成像系统(德国LEICA公司TCS SP2型)。
1.3 方法
1.3.1 lPAG神经元细胞原代培养将乳大鼠吸入乙醚麻醉。全身浸泡消毒后无菌条件下断头,小心取出完整的脑组织。脑组织置于解剖显微镜下剔除脑膜和附着的结缔组织。寻找并确认中脑后,用9号注射器针头仔细分离lPAG组织。将剥离出的lPAG组织在37℃下用0.125%胰蛋白酶消化30 min;将组织混合液以离心半径80 cm、以1000 r/min离心3~5 min、弃上清,加入DMEM/F12混合液,缓慢吹打使细胞混匀,将混匀的细胞悬液接种于经多聚赖氨酸包被的培养皿内,放入5%CO2培养箱内,37℃恒温培养3 h后将DMEM/F12混合液换成神经细胞完全培养液(Neurobasal+B27+谷氨酰胺);倒置显微镜下观察细胞贴壁情况,待细胞贴壁12 h左右,用阿糖胞苷(10 μmol/L)抑制原代细胞内胶质细胞的生长。
1.3.2 lPAG神经元细胞的鉴定原代培养的神经元细胞4 d后,将细胞爬片取出,4%多聚甲醛溶液固定30 min后加入小牛血清封闭30 min,顺序滴加小鼠抗大鼠anti-NeuN一抗抗体(1∶400)及二抗(山羊抗小鼠IgG-HRP 1∶200),DAB显色1~5 min,明胶贴片、梯度乙醇脱水,生物透明剂透明,中性树胶封片,倒置显微镜镜下观察并采集图像。
1.3.3 激光共聚焦显微镜观察神经元细胞胞内钙离子变化①Fluo-4/AM负载入细胞:取出培养4 d的lPAG神经元细胞,激光共聚焦培养皿皿底及周围用DMEM/12培养液润洗3~4次,滴加Fluo-4/AM(5 μmol/L)与0.02%Pluronic F127的混合溶液。细胞置于37℃恒温培养,避光,孵育30 min;取出后加入少量DMEM/F12培养基覆盖细胞;用激光共聚焦显微镜对钙离子进行实时检测;胞内钙离子变化水平检测:分别加入实验药物,测定细胞内钙离子荧光强度的动态变化。用钙离子相对荧光强度的动态变化直接反映神经元细胞胞内钙离子变化水平。激光共聚焦扫描的激发波长为488 nm,发射波长为515 nm,扫描的频率为2 s/帧,时间5 min。先检测静息状态下的钙离子的荧光强度,待荧光强度稳定后,加入药物,检测钙离子的荧光强度变化情况。钙离子相对荧光强度等于加入药物后钙离子荧光强度比上静息状态下的钙离子荧光强度。②不同药物对Fluo-4/AM负载的培养lPAG神经元胞内钙离子的影响。激光共聚焦钙成像技术显示:低浓度的BzATP(0.1 μmol/L和1 μmol/L)对lPAG培养神经元胞内钙离子无影响,高浓度的BzATP(10 μmol/L及100 μmol/L)可使培养的lPAG神经元胞内钙离子升高,神经元胞内钙离子水平随BzATP的浓度升高而升高,且升高的维持时间更长,故选用100 μmol/L作为后续实验浓度。原代培养的lPAG神经元随机分为4组:空白对照组(不加入药物),仅供对照;BzATP组(100 μmol/L);A-740003+BzATP组:先加入100 nmol/L A-740003孵育10 min,再加入10 μmol/L 的BzATP;BzATP对照组:先加入无钙液孵育20 min,再加入BzATP。其中空白对照组、BzATP组、A-740003+BzATP组孵育液均为DMEM/F12培养基,BzATP对照组孵育液为无钙液。
1.4 统计学分析采用SPSS 17.0软件进行统计分析,定量资料以均数±标准差(xˉ±s)表示。各组间采用单因素方差(one-way,ANOVA)分析进行处理,以P≤0.05为差异有统计学意义。
2 结 果
2.1 原代培养的lPAG神经元形态观察及鉴定原代培养的lPAG神经元体积较小,多数为圆形或椭圆形,单个分布未见突起;接种3 h后,接种细胞陆续贴壁,周围可见微弱的光晕;贴壁后1 d有少量突起长出,细胞间连接较少;神经元细胞贴壁3~4 d后,绝大部分细胞突起变得明显,突起较短,细胞核明显,光晕增强,见图1。本实验选用培养4d的lPAG神经元细胞,采用荧光钙指示剂Fluo-4/AM负载后在荧光显微镜下可以看到负载后的细胞胞体发出绿色荧光,见图2。
2.2 P2X7受体活化对神经元 胞内钙离子的影响激光共聚焦显微镜下观察显示:BzATP组神经元胞内钙离子荧光强度(2.48±1.05)较空白对照组、BzATP对照组、A-740003+BzATP组[(1.12±0.03)、(1.09±0.03)、(1.14±0.08)]明显升高(P<0.01)。

图1 lPAG神经元原代培养(×200)Figure 1 lPAG neurons cultivated(×200)
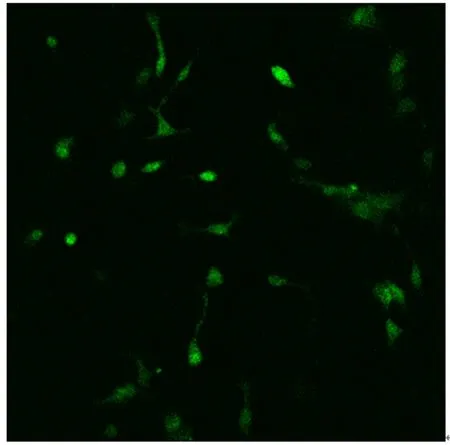
图2 荧光负载后细胞形态结构及荧光强度(×400)Figure 2 The morphological structure and fluorescence intensity of cells under fluorescence loading(×400)
3 讨 论
P2X7受体由于其自身结构特殊性,与其他的嘌呤受体亚型比较,表现在以下几个方面:①P2X7受体对局部微环境中ATP的亲和力相对较低,当局部微环境中对ATP浓度在100~1000 μmol/L时,ATP才能激活P2X7受体,进而引发下游反应;②持续的ATP或高浓度的ATP刺激下,P2X7受体激活形成的通道可以转变为直径较大的孔道,此孔道可以对分子量较大的物质进行通透;③炎症因子的持续作用可以提高P2X7受体对ATP的敏感性,以上特点使得P2X7受体在炎症、慢性疼痛[6]、神经系统疾病、肿瘤[7]和细胞毒性的病理机制中有重要作用。
P2X7受体激活后大量表达在中枢小胶质细胞、星形胶质细胞和神经元,参与感觉信号传导包括疼痛的产生和维持[8-9]。值得一提的是对于P2X7受体的表达部位一直存在争议,有人认为P2X7受体仅表达于中枢神经系统的小胶质细胞和星形胶质细胞,但近年来的一系列研究也证实P2X7受体表达于中枢神经系统的神经元[10]。NeuN是研究中常用的成熟神经元的标记蛋白,在本研究中,通过对培养的lPAG神经细胞进行NeuN免疫细胞化学染色发现,NeuN阳性表达部位与P2X7受体存在共表达,说明本研究中原代培养的细胞主要是神经元细胞。
目前认为重组大鼠P2X7受体激动剂效价最好的是BzATP,BzATP是稳定的ATP类似物,它的效价远远大于ATP。文献报道该受体的激动剂效价依次为 BzATP≫ATP>2MeSATP>ATPγS≫ADP[11-12]。BzATP激活人和大鼠P2X7受体的效能是ATP的50倍[13]。当机体产生炎症反应或细胞损伤时,ATP激活P2X7受体,导致胞内钙离子快速增加[14-15]。而A-740003能有效的拮抗BzATP激活大鼠和人P2X7受体所诱发的胞内钙离子变化;与PPADS、BBG或KN-62等其他的P2X7受体拮抗剂相比较,A-740003更能有效阻断BzATP诱发的胞内钙离子变化,阻断P2X7受体介导的膜孔形成[16],因此在本研究中选用A-740003拮抗P2X7受体激活。
细胞内游离钙离子浓度的微小变化能快速有效的调节细胞生理过程。胞内钙离子升高可以通过细胞质内钙库释放、细胞外钙离子胞内及钙离子周期性变化诱发的钙振荡等所致。BzATP引起的神经元胞内钙离子升高可能是受其中的一种或多种方式调节[17]。本研究中,培养神经元经10 μmol/L BzATP孵育后可导致lPAG神经元胞内钙离子水平迅速升高,而给予P2X7受体特异性拮抗剂A-740003预孵育后再给予10 μmol/L BzATP孵育,lPAG神经元胞内钙离子水平未见明显变化,说明10 μmol/L BzATP升高胞内钙离子水平的效应能被P2X7受体特异性拮抗剂A-740003阻断,BzATP导致的lPAG神经元胞内钙离子升高是通过P2X7受体活化介导的。此外,使用EGTA螯合细胞外钙离子后的无钙液孵育后,10 μmol/L BzATP不能使lPAG神经元胞内钙离子升高,说明10 μmol/L BzATP所致的lPAG神经元胞内钙离子升高主要是由细胞外钙离子胞内所引起,而非细胞内钙库的释放[18]。
本研究中仅观察不同浓度的Bz-ATP预孵育对离体培养的lPAG神经元胞内钙离子水平的影响,在后续的研究中将对在体或病理状态下,PAG神经元P2X7受体激活情况以及胞内钙离子水平变化进行观察研究。
综上所述,P2X7受体激活后可以升高lPAG神经元胞内钙离子水平且与细胞外钙离子胞内有关。

