益气固表丸对低去脂肪指数慢性阻塞性肺疾病患者微小RNA的影响
金晶 李风森 李争 徐丹 荆晶 王晶


摘要:目的 觀察益气固表丸对低去脂肪质量指数(FFMI)慢性阻塞性肺疾病(COPD)稳定期患者微小RNA(miRNA)及肿瘤坏死因子样微弱凋亡诱导因子(TWEAK)水平的影响。方法 选择低FFMI COPD稳定期肺脾气虚证患者60例,按随机双盲对照原则将患者分为益气固表丸组和安慰剂组。2组均行西医基础治疗,益气固表丸组予益气固表丸,安慰剂组予安慰剂,均每次10粒,每日3次,口服,连续治疗12周。选择既往否认COPD及肌病病史的同龄志愿者30例为对照组。采用生物电阻抗法检测患者治疗前后FFMI及双手握力(HGS),ELISA检测治疗前后TWEAK水平,采用GO、KEGG分析进行靶基因预测,qRT-PCR验证治疗前后外周血miRNA变化。结果 共脱落6例。揭盲后益气固表丸组28例、安慰剂组26例。益气固表丸组ITT数据集总有效率为96.67%(28/30),安慰剂组为86.67%(26/30),2组比较差异有统计学意义(P<0.05)。益气固表丸组治疗后中医症状评分下降(P<0.05),FFMI、HGS无变化,安慰剂组FFMI、HGS下降(P<0.05)。与对照组比较,2组治疗前TWEAK升高(P<0.05),益气固表丸组治疗后TWEAK下降(P<0.05),安慰剂组治疗后TWEAK无明显变化(P>0.05)。通过GO、KEGG富集分析,结合文献查询筛选miR-1-3p、miR-422a、miR-206、miR-145-5p和miR-133b共5个备选基因。qRT-PCR验证后显示,益气固表丸组治疗前miR-422a、miR-145-5p、miR-133b明显下降(P<0.05),治疗后miR-145-5p、miR-133b明显升高(P<0.05)。结论 益气固表丸可有效缓解低FFMI COPD稳定期患者临床症状,提高外周血miR-145-5p、miR-133b水平,降低TWEAK水平,减轻患者全身炎症反应。
关键词:慢性阻塞性肺疾病稳定期;益气固表丸;微小RNA;肿瘤坏死因子样微弱凋亡诱导因子;临床研究
中图分类号:R259.63 文献标识码:A 文章编号:1005-5304(2019)05-0016-07
DOI:10.3969/j.issn.1005-5304.2019.05.004 开放科学(资源服务)标识码(OSID):
Abstract: Objective To observe the effects of Yiqi Gubiao Pills on expressions of microRNA (miRNA) and the level of tumor necrofacies-like weak inducer of apoptosis (TWEAK) in chronic obstructive pulmonary disease (COPD) patients with low fat free mass index (FFMI). Methods Totally 60 patients with low FFMI COPD stable lung spleen qi deficiency syndrome were selected, and were divided into Yiqi Gubiao Pills group and placebo group according to randomized double-blind control principle. Both groups received Western medicine basic treatment. Yiqi Gubiao Pills group was given Yiqi Gubiao pills, and placebo group was given placebo, 10 pills each time, three times a day, orally, for 12 weeks. 30 volunteers of the same age who had previously denied the history of COPD and myopathy were selected as control group. The bioelectrical impedance method was used to detect the changes of FFMI and hand grip strength (HGS) before and after treatment. The TWEAK level before and after treatment was detected by ELISA. GO and KEGG analysis was used to predict target genes, and qRT-PCR was used to verify miRNA changes in peripheral blood before and after treatment. Results Six cases were lost during treatment. 28 cases left in Yiqi Gubiao Pills group, and 26 were left in placebo group. The total effective rate of ITT data set of Yiqi Gubiao Pills group was 96.67% (28/30), and that of placebo group was 86.67% (26/30), with statistical significance (P<0.05). TCM symptom scores decreased after treatment in Yiqi Gubiao Pills group (P<0.05), FFMI and HGS did not change, and FFMI and HGS decreased in placebo group (P<0.05). Compared with the control group, the TWEAK increased in the two groups before treatment (P<0.05), and the TWEAK decreased in Yiqi Gubiao Pills group (P<0.05). There was no significant change in TWEAK in placebo group after treatment (P>0.05). A total of 5 candidate genes for miR-1-3p, miR-422a, miR-206, miR-145-5p and miR-133b were screened by GO and KEGG enrichment analysis. After qRT-PCR verification, miR-422a, miR-145-5p and miR-133b significantly decreased before treatment in Yiqi Gubiao Pills group (P<0.05), and miR-145-5p and miR-133b significantly increased after treatment (P<0.05). Conclusion Yiqi Gubiao Pills can relieve the clinical symptoms of low FFMI COPD patients effectively, and increase the expressions of miR-145-5p and miR-133b in peripheral blood, decrease the level of TWEAK, and reduce systemic inflammatory response in COPD patients.
Keywords: chronic obstructive pulmonary disease in stable period; Yiqi Gubiao Pills; miRNA; TWEAK; clinical study
微小RNA(miRNA)是基因表达的关键调节因子,与慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)密切相关,是潜在的诊断标记物和药物治疗靶点[1]。中医药对COPD造成的局限及全身范围内的慢性炎症状态的免疫调节作用有显著影响[2]。随着高通量芯片和测序技术的发展,已建立了多个公共资源,基于GEO数据库的生物信息学分析提供了用于在各种疾病中搜索生物标志物的有效信息[3]。益气固表丸(国家发明专利号201410536529.5)源自新疆医科大学第四附属医院呼吸科治疗COPD缓解期经验方,由党参、麸炒白术、茯苓、陈皮、法半夏、薏苡仁、浮小麦、紫苏子、蜜款冬花、黄芩、伊贝母、蜜枇杷叶、防风组成。长期临床观察及前期研究发现,益气固表丸能改善患者咳嗽、咳痰症状,以及下肢无力、全身乏力等肺脾气虚症状,增强运动耐力,改善相关评分[4]。本研究在西医治疗基础上联用益气固表丸,通过生物信息学识别和验证益气固表丸对COPD患者潜在的miRNA生物标志物及药物作用靶点,探讨其可能的分子机制。
1 资料与方法
1.1 一般资料
选取2017年6-12月新疆医科大学附属中医医院慢病随访门诊的COPD稳定期患者,及同期就诊于该院体检中心的既往否认COPD及肌病病史的同龄志愿者30例。按照随机双盲对照原则,由统计咨询室专人建立随机数字化序列,保证受试者及研究者均对使用药物不知情,保证对疗效的公平记录,在试验完成后由专人揭盲。本研究经新疆医科大学附属中医医院伦理委员会审查批准(201709601)。
1.2 西医诊断标准
参照《慢性阻塞性肺疾病诊治指南(2013年修订版)》[5]确定COPD诊断标准,具有呼吸困难、慢性咳嗽、咳痰及有危险因素暴露史的患者进行肺功能检查,应用支气管舒张剂后第1秒用力呼气容积占用力呼气肺活量百分比<70%,可确定存在持续性气流受限;依据欧洲老年人肌肉减少症工作组(EWGSOP)提出的低去脂肪质量指数(FFMI)诊断标准[6]:体质量指数≤21 kg/m2,且男性FFMI≤16 kg/m2,女性FFMI≤15 kg/m2。
1.3 中医辨证标准
参照《中医虚证辨证参考标准》[7]制定肺脾气虚证辨证标准。主症:咳嗽、咯痰、气短、喘息;次症:食少腹胀、汗出较多,伴乏力便溏;舌脉:舌体胖大,苔白腻,脉沉细。
1.4 纳入标准
①年龄45~80岁;②符合上述西医诊断标准及中医辨证标准;③受试者对本研究知情,并均签署知情同意书。
1.5 排除标准
①合并气胸、胸腔积液、肺癌、活动性肺结核等其他严重肺部疾病者;②合并严重心脑血管、肝肾和造血系统等原发性疾病者;③精神病患者;④妊娠或哺乳期妇女;⑤合并腫瘤,先天或后天性免疫缺陷者。
1.6 质量控制及脱落标准
①出现不良事件或严重不良事件,医生判断应停止试验者;②试验中突然病情急性加重,医生判断应停止试验者;③试验中发生重大偏差,如依从性太差等,难以评价药物效应;④受试者不愿继续进行试验,向主管医生提出退出要求或虽未提出退出,但不再使用药物或接受随访评估而失访者;⑤对脱落的受试者,研究人员应采取登门、预约随访、电话、信件等方式,尽可能与受试者联系,询问理由,记录最后一次服药时间,完成所能完成的评估项目。
1.7 仪器
体成分分析仪(Inbody720,韩国),肺功能仪(Chestgraph HI-101,日本),Multiskan Spectrum全波长酶标仪(德国Thermo Fisher公司),无水乙醇,异丙醇及氯仿(天津市福宇精细化工有限公司,批号XK13-011-00015),DEPC(上海生工生物工程有限公司,批号B417BA0001),琼脂糖(上海生工生物工程有限公司,批号A811BA0014),Trans2K DNA Marker(北京全式金生物技术有限公司,批号BM101),MiRcute Serum/Plasma miRNA Isolation Kit(北京天根生化科技有限公司,批号DP503),miRNA第一链cDNA合成(上海生工生物有限公司,批号B532451),QuantiNava SYBR Green Kit(凯捷生物工程有限公司,批号208054)。物种:秀丽线虫,外参检测引物cel-miR39-30p(北京天根生化科技有限公司,批号Q8129)。mRNA北京天根高速冷冻离心机(Nefuqe 15R,上海力申科学仪器有限公司),旋涡混合器(GL-88B,海门市其林贝尔仪器制造有限公司),核酸蛋白定量仪(K5500,北京凯奥科技发展有限公司),凝胶成像系统(2500,上海天能科技有限公司),PCR仪(MyCycler Thermal Cycler,Bio-Rad,USA),Real Time PCR instrument(ABI QuantStudioTM 6 Flex Real-Time PCR系统,ABI)。
1.8 研究方法
2组均进行西医基础治疗。益气固表丸组予益气固表丸(0.19 g/粒,新疆制药厂生产,新疆医科大学附属中医院中心药房提供,批号20170431),安慰剂组予安慰剂(益气固表丸模拟剂,不含试验药物的有效成分,其外观、口感、气味、溶解度等与试验药物一致,成分为乳糖、淀粉,0.19 g/粒,新疆制药厂生产),均每次10粒,每日3次,口服。4周随访1次,共治疗12周。
1.9 观察指标
1.9.1 一般情况
采集患者的年龄、性别、身高及体质量。
1.9.2 中医症状积分
参照《中医内科常见病诊疗指南·中医病证部分》[8]“肺胀病”肺脾气虚辨证协作组临床方案,对咳嗽、咯痰、消瘦、腹胀、纳少、神疲乏力及便溏进行评分,每项0~6分,总分36分。0~10分为轻度肺脾气虚,11~30分为中度肺脾气虚,>30分为重度肺脾气虚。评分越高表明症状越重。
1.9.3 去脂肪质量指数
患者空腹状况下测定体脂率。FFMI(kg/m2)=体质量(kg)×(1-体脂率)÷身高2(m2)。
1.9.4 双手握力
采用美国手功能治疗师协会推荐的握力体位及方法[9]测试患者优势手握力(HGS),使用握力器在3 min连续机动过程中记录主力手(DoHGS)和非主力手(NDoLHGS)中手指屈肌的最大自主手握力,每次间隔至少1 min。记录其平均值,结果用千克力(kgf)表示。
1.9.5 外周血肿瘤坏死因子样微弱凋亡诱导因子
采集患者外周血2 mL,3000 r/min离心10 min,取血清保存于EP管,置于-80 ℃冰箱备用。检测时根据试剂盒说明书操作,于设置450 nm波长的酶标仪上机,ELISA检测并计算TWEAK水平。
1.9.6 GO和KEGG分析
分别用TargetScan、PITA、microRNA org数据库对miRNA进行靶基因预测,对3个数据库预测到的靶基因取交集,结合文献查询筛选取共同的基因进行后续的GO(gene ontology)和KEGG(kyoto encyclopedia of genes and genomes)分析。
1.9.7 qRT-PCR检测微小RNA
采集患者外周血2 mL,3000 r/min离心10 min,取血清保存于EP管,置于-80 ℃冰箱备用。进行RNA提取,第一链cDNA合成,按照表1配制反应体系,轻轻混匀;37 ℃、60 min,42 ℃、30 min,85 ℃、5 min使酶失活,结束反转录实验。将反转录得到的cDNA置于-80 ℃冰箱保存,取出适量,稀释20倍,用于荧光定量实验,荧光定量引物信息及荧光定量体系见表2、表3。
1.10 疗效标准
参照《证候类中药新药临床研究技术指导原则》[10]制定疗效标准。临床控制:急性加重次数减少,积分减少率≥70%;显效:急性加重次数减少,50%≤积分减少率<70%;有效:急性加重次数减少,30%≤积分减少率<50%;无效:急性加重次数减少,积分减少率<30%。积分减少率(%)=(治疗前积分-治疗后积分)÷治疗前积分×100%。
1.11 统计学方法
采用SPSS18.0统计软件进行分析。计量资料服从正态分布以±s表示,不服从正态分布以中位数及百分位数M(Q1,Q3)进行描述,使用配对秩和检验;计数资料采用相对数百分比表示。P<0.05表示差异有统计学意义。
统计分析数据集分为2种:①意向治疗分析(ITT):对所有经随机化分组、至少服用1次药物、未能观察到全部治疗过程的病例,将最后一次数据转到试验最终结果,对疗效进行意向治疗分析;②符合方案数据分析(PP):所有符合方案、依从性好、试验期间未使用禁止药物、完成标准病历规定填写内容的病例,或服用试验用药数量在80%~120%者,对其疗效进行统计分析。使用GO seq软件,基于Wallenius non-central hyper-geometric distribution数学模型,对差异基因进行GO富集分析,P<0.05表示靶基因在该GO条目中出现了富集。
2 结果
2.1 2组一般资料比较
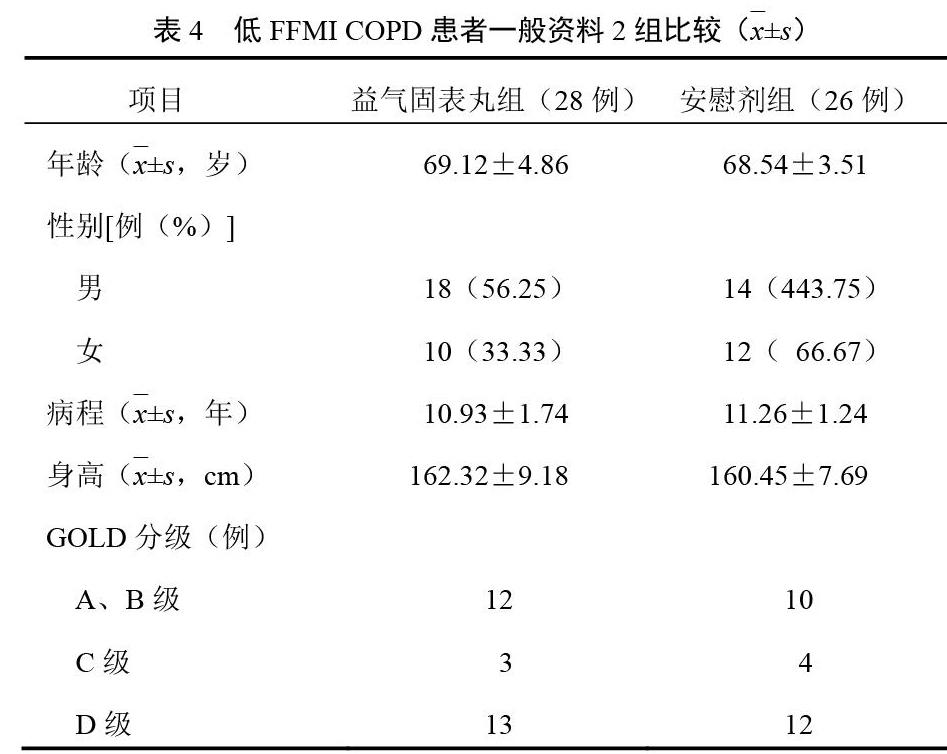
本研究共筛查164名COPD稳定期患者,实际纳入临床试验60例,脱落5例(益气固表丸组2例、安慰剂组3例),因急性感染加重住院拒绝继续试验患者中止试验者1例,脱落率8.33%。揭盲后益气固表丸组28例,安慰剂组26例。2组年龄、性别、病程、身高及GOLD分级比较差异无统计学意义(P>0.05),具有可比性。见表4。
2.2 2组临床疗效比较
益气固表丸组ITT数据集总有效率为96.67%(29/30),安慰剂组为86.67%(26/30),2组比较差异有统计学意义(Z=-7.132,P=0.024)。益气固表丸组PP数据集总有效率为96.43%(27/28),安慰剂组为84.62%(22/26),2组比较差异有统计学意义(Z=-8.091,P=0.039)。见表5。
2.3 2组治疗前后中医症状评分比较
益气固表丸组治疗后咳嗽、咯痰、腹胀、纳少、神疲乏力、便溏评分减少(P<0.05),安慰剂组便溏评分减少(P<0.05)。2组治疗后比较,益气固表丸组咳嗽、咯痰、腹胀、纳少、神疲乏力评分均低于安慰剂组(P<0.05)。见表6。
2.4 2组治疗前后去脂肪质量指数及双手握力比较
与本组治疗前比较,益气固表丸组治疗前后FFMI、HGS无明显变化(P>0.05),安慰剂组治疗后FFMI、HGS降低(P<0.05)。2组治疗后比较,益气固表丸组FFMI、HGS水平优于安慰剂组(P<0.05)。见表7。
2.5 2组治疗前后外周血肿瘤坏死因子样微弱凋亡诱导因子比较
与本组治疗前比较,益气固表丸组治疗后外周血TWEAK明显降低(P<0.05)。2组治疗后比较,益气固表丸组TWEAK水平明顯低于安慰剂组(P<0.05)。见表8。
2.6 GO和KEGG分析
GO富集分析表明,主要注释的MF3452目标基因包括与蛋白结合、ATP结合、DNA结合、序列特异性DNA结合、poly(A)RNA结合、金属离子结合级锌离子结合介导有关的信号通路,见图1。KEGG分析发现,靶基因与PI3K-Akt信号通路、MAPK信号通路、Ras信号通路、FoxO信号通路、mTOR信号通路、Rap1信号通路和凋亡等通路相关,见图2。根据P值,列出KGEE分析中较丰富的前10条通路名称,见表9。
2.7 2组治疗前后miRNA筛查及验证
与对照组比较,益气固表丸组治疗前后miR-422a、miR-145-5p、miR-133b明显下降(P<0.01);与本组治疗前比较,益气固表丸组治疗后miR-145-5p、miR-133b明显升高(P<0.05)。益气固表丸组治疗后miR-1-3p、miR-206表达无明显改变(P>0.05)。见表10。
3 讨论
COPD病情及病程的发展与miRNA的异常表达密切相关,但基于生物信息学对COPD多系统并发症相关的miRNA生物标志物及中药成分作用靶点的相关研究较少。因此,本研究通过益气固表丸干预,利用生物信息学分析识别和验证益气固表丸对COPD患者潜在的miRNA生物标志物及药物作用靶点。
本研究显示,益气固表丸能有效改善患者肺脾气虚相关症状,安慰剂组仅改善便溏,考虑与安慰剂成分有关,亦不排除安慰剂效应可能,提示益气固表丸能有效缓解肺脾气虚证相关症状,改善患者的生活质量。同时,随年龄增长及病情影响,人体骨骼肌质量呈下降趋势,患者肌肉质量及力量显著下降,益气固表丸可保持患者外周血FFMI、HGS水平,避免二者随病情进展而下降。今后研究应继续延长干预及随访时间,监测患者FFMI、HGS水平,并在药物治疗基础上配合抗阻力训练,了解患者肌肉质量及力量变化情况。
TWEAK是TNF超家族成员,在免疫应答失调的炎症反应中发挥重要作用,同时对肌肉代谢影响重大[11]。Hu等[12]研究表明,TWEAK可通过刺激巨噬细胞抑制miR-7的外泌体,从而抑制上皮卵巢癌转移,与EGFR/AKT/ERK1/2信号通路下调有关。本研究发现,益气固表丸能有效改善患者较高的TWEAK水平,其变化与miRNA差异表达及相关通路的研究将是后期研究的关注点。
GO富集分析表明,主要注释的MF3452目标基因包括依赖DNA的转录调节、信号转导及细胞凋亡、分化、增殖相关,参与细胞黏附、脂质代谢和氧化还原过程中,促进炎症反应、激活或抑制细胞因子介导的相关信号通路。Liu等[13]发现,miR-23a、miR-25、miR-145、miR-224在COPD患者外周血中均明显下调,且miR-145、miR-224水平与GOLD分期相关。miR-145是关键的抑癌miRNA,通过抑制转化生长因子-β通路下游的Smad3靶蛋白,负性调控COPD患者呼吸道平滑肌细胞内促炎症细胞因子释放[14]。Pan等[15]研究发现,miR-206、miR-133b对骨骼肌生长和重建至关重要,但在肺癌中显著下调,提示miR-206、miR-133b可能参与肺肿瘤发生。
KEGG 信号通路富集分析,筛选出P<0.05的前20位信号通路共大类,按照P值由小到大排列,发现癌症相关通路5条:pathway in cancer(癌症的通路)、MicroRNAs in cancer(癌症的miRNA代谢)、Transcriptional misregulation in cancers(癌症的转录失调)、Proteoglycans in cancer(癌症的蛋白聚糖)及Prostate cancer(前列腺癌);能量代谢相关信号通路6条:PI3K-Akt signaling pathway(磷脂酰肌醇3-激酶/蛋白激酶B信號通路)、MAPK signaling pathway(丝裂原活化蛋白激酶信号通路)、RAS signaling pathway(Ras信号通路)、FoxO signaling pathway(叉形头转录因子信号通路)、Rap1 signaling pathway(Rap1信号通路)及Hippo signaling pathway(河马信号通路);介导细胞能量传递通路5条:Focal adhesion(黏附斑激酶信号通路)、Endocytosis(胞吞作用)、Regulation of actin cytoskeleton(调节肌动蛋白细胞骨架)、Cell cycle(细胞周期)、Signaling pathways regulating pluripotency of stem cells(调节干细胞多能性的信号通路);病毒感染相关通路4条:HTLV-I infection(人类嗜T细胞病毒感染)、Viral carcinogenesis(病毒致癌作用)、Hepatitis B(乙型肝炎病毒感染)、Epstein-Barr virus infection(爱泼斯坦-巴尔病毒感染),提示miR-145-5p及miR-133b通过影响以上肿瘤、病毒及能量代谢等通路对COPD患者产生作用。在作用于能量代谢相关的6条通路中,PI3K/Akt通路位于影响通路中第二位,笔者将进一步探讨miR145-5p及miR33b与PI3K/Akt/mTOR通路的关系。
综上所述,COPD患者合并骨骼肌质量减少的生物标记物为miR-422a、miR-145-5p、miR-133b,益气固表丸作用靶点为miR-145-5p、miR-133b,能升高其表达,同时降低TWEAK水平,达到改善COPD患者机体慢性炎症状态的作用。
参考文献:
[1] WANG R, XU J, LIU H, et al. Peripheral leukocyte microRNAs as novel biomarkers for COPD[J]. Int J Chron Obstruct Pulmon Dis, 2017,12:1101-1112.
[2] 尹素改,吴耀松,陈玉龙,等.从miRNAs功能特点谈中医药研究思路[J].中国中西医结合杂志,2014,34(10):1260-1263.
[3] BARRETT T, WILHITE S E, LEDOUX P, et al. NCBI GEO:archive for functional genomics data sets-update[J]. Nucleic Acids Res, 2013,41(Database issue):D991-D995.
[4] LI F S, ZHANG Y L, LI Z, et al. Randomized, double-blind, placebo-controlled superiority trial of the Yiqigubiao pill for the treatment of patients with chronic obstructive pulmonary disease at a stable stage[J]. Exp Ther Med,2016,12(4):2477-2488.
[5] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中国医学前沿杂志(电子版),2014,6(2):67-80.
[6] VANITALLIE T B, YANG M U, HEYMSFIELD S B, et al. Height- normalized indices of the body's fat-free mass and fat mass:potentially useful indicators of nutritional status[J]. Am J Clin Nutr,1990,52(6):953-959.
[7] 沈自尹.中医虚证辨证参考标准[J].中西医结合杂志,1983,3(2):117.
[8] 中华中医药学会.中医内科常见病诊疗指南·中医病症部分[M].北京:中國中医药出版社,2008:14-16.
[9] CLFESS E E. Clinical Assessment Recommendations[M]. 2nd ed. Chicago:American Society of Hand Therapists,1992:41-45.
[10] 国家药品监督管理局.证候类中药新药临床研究技术指导原则[EB/OL]. [2018-11-01].http://www.nmpa.gov.cn/WS04/CL2182/331783.html.
[11] LAZAAR A L, MILLER B E, FRANCOMBE G, et al. No TWEAK for COPD[J]. Eur Respir J,2013,42(4):1142-1144.
[12] HU Y, LI D, WU A, et al. TWEAK-stimulated macrophages inhibit metastasis of epithelial ovarian cancer via exosomal shuttling of microRNA[J]. Cancer Lett,2017,393:60-67.
[13] LIU X, QU J, XUE W, et al. Bioinformatics-based identification of potential microRNA biomarkers in frequent and non-frequent exacerbators of COPD[J]. Int J Chron Obstruct Pulmon Dis,2018, 13:1217-1228.
[14] MISONO S, SEKI N, MIZUNO K, et al. Dual strands of the miR-145 duplex (miR-145-5p and miR-145-3p) regulate oncogenes in lung adenocarcinoma pathogenesis[J]. J Hum Genet,2018,63(10):1015- 1028.
[15] PAN J Y, SUN C C, BI Z Y, et al. miR-206/133b cluster:a weapon against lung cancer?[J]. Mol Ther Nucleic Acids,2017,8:442-449.
(收稿日期:2018-10-05)
(修回日期:2018-12-25;编辑:季巍巍)

