鱼产品掺假鉴别技术研究进展
王之莹,李婷婷,张桂兰,刘 瑞,陈爱亮*
(中国农业科学院农业质量标准与检测技术研究所,北京 100081)
随着社会的发展、居民生活水平的提高,全球对水产品的需求不断增加,水产品的人均消费量从2010—2012年的18.9 kg预计将增加到2022年的20.7 kg[1]。2017年世界水产品大会指出,到2050年,需要生产多于目前50%产量的水产品才能维持人类对水产品的基本消费需求[1]。中国作为渔业大国,占有世界水产品生产总量的1/3,仅2016年的水产品总消费量就达6 813万 t[2]。但与此同时,水产品掺假的现象层出不穷。
水产品造假可以以多种形式出现,也可以在渔业供应链的任何阶段出现。这种行为的发生可能是无意的,由于不同鱼类在不同地区的叫法不同,或者鱼类之间存在近缘关系,引起混淆的机率较大。然而,一些不法商贩利用许多鱼类在外观、味道和质地方面的相似性,用较低商业价值的物种来代替较高价值的物种,以赚取高额的利润。消费者在不知情或者不能辨别的情况下,以较高的价格购买相对廉价的假冒食品。这种以假充好、名不副实的现象不仅扰乱了市场秩序,更极大地损害了消费者的利益甚至健康。因此,建立准确、灵敏、快速的鱼类掺假鉴别方法,对保障鱼肉及鱼产品安全、维护消费者权益都具有重要的现实意义。
本文综述了部分鱼产品的掺假现状,讨论常用的几类鱼产品掺假检测技术,包括无损检测技术、蛋白质分析技术和核酸分析技术三大类,并举例这些技术在鱼产品中的应用,以及指出其有效性和局限性,期望为水产品掺假鉴别提供技术参考。
1 鱼产品掺假现状
鱼产品掺假在世界各国普遍存在。Wong等[3]发现,在北美洲市场,3/4的“红鲷鱼”被其他鱼类代替,白金枪鱼被罗非鱼掺假,大西洋比目鱼被标为阿拉斯加大比目鱼。Naaum等[4]指出,在加拿大市场鲨鱼造假情况最严重,几乎接近100%;7/9的鲷鱼实际为罗非鱼。Selda等[5]的研究表明,阿拉斯加鳕鱼、黄鳍金枪鱼、鲑鱼等海产品在德国存在严重的标签与实物不符现象。Cawthorn等[6]研究发现南非市场的灰鲭鲨、鲱鱼、红鲷鱼等造假情况不容忽视。在中国,李新光[7]调查市场发现,大西洋鲑鱼经常被太平洋鲑鱼或者虹鳟鱼代替,鳕鱼经常被油鱼代替。可见,鱼产品造假现象在世界范围内都不容忽视。
我国虽为水产品出口大国,但是由于地理原因,很多品种鱼的产量受到限制,虽然不断引进新品种的鱼类,养殖技术也得到迅速发展,但远远不能满足消费需求,更加滋生了鱼产品掺假现象的发生。常见的有鲣鱼代替金枪鱼、油鱼代替鳕鱼、虹鳟鱼代替挪威三文鱼等。本文找出市场上常见的几类易掺假的鱼种,对鱼产品的掺假现状进行简单统计(表1)。

表1 常见的易掺假鱼种类Table 1 Common adulterated fish species
2 鱼及鱼产品掺假鉴别方法
传统的真伪鉴别主要依据形态学(如外形、颜色等)、气味和口感等感官指标来进行,但对于加工过的鱼产品或者近缘鱼种,其真伪鉴定与评价就显得非常困难。随着科技的发展,仿生感官评价学、光谱和色谱学以及基于蛋白质和DNA的鉴别技术逐渐进步,可以从品种、营养组分的差异,系统地对鱼产品进行掺假鉴别。目前的检测方法主要以蛋白质、DNA为检测对象,具体分为无损检测分析方法、基于蛋白质的分析方法和基于核酸的分析方法。
2.1 无损检测分析方法
无损检测分析方法是在不损害或不影响被检测对象的情况下,利用样品内部对光、电、磁等的变化,以物理或者化学方法,借助现代化设备,对样品进行性质、结构等检测。主要包括生物传感器技术、光谱法、电磁波法、质谱法。
2.1.1 生物传感器技术
生物传感器是一种将生物敏感材料作为识别元件,利用适当的理化换能器将浓度转化为电信号的分析工具。其基本原理为:待测物质与分子识别元件特异性结合,如抗原抗体的结合,通过生物化学反应,产生的生物学信息被理化换能器转换为定量处理的光信号或电信号,再被信号放大装置放大、输出,从而分析待测物质的浓度。生物传感器常用于鱼产品新鲜度的分析。Rudnitskaya等[29]基于一系列生物传感器对不同化合物中的选择性和敏感性不同的原理,使用电子舌对新鲜鱼、贮藏于冰箱中的和贮藏于室温下的变质鱼进行区分。在研究中,将每个传感器置于塑料探针上,将鱼样品在蒸馏水中搅碎,再对样品进行检测。在主成分分析(principal component analysis,PCA)中,使化学信息转化为数字信号,根据主元得分PC2的不同,区分出鱼的新鲜度。生物传感器具有选择性高、特异性好、分析速度快、灵敏度高等优点,但其难以进行物种间的鉴别。
2.1.2 光谱法
光谱法中较常用的为红外光谱,如近红外光谱和拉曼光谱,是一种无损检测技术,在肉类鉴别中被广泛应用。利用光谱法不仅可以实现快速简便的掺假检测,还可以确定鱼产品中掺假的种类和数量。红外光谱是波长780~2 526 nm的电磁波,在此范围内,不同的化合物存在特定的基团信息特征,根据近红外吸收峰的位置、吸收强度等特征,实现化合物的定性定量分析。Gayo等[30]利用近红外光谱对蓝蟹(10%~90%掺假远洋梭子蟹)的掺假情况进行分析。梭子蟹较为普遍,常用来掺假蓝蟹。由于梭子蟹的含水量高于蓝蟹,对近红外光谱的吸光度进行分析,发现无掺假的蟹肉具有更高的吸光度,随着掺假比例的增加,每个波长上的吸光度都会下降。经一阶导数等方法处理数据后,利用偏最小二乘法和主成分回归法建立回归模型,从而实现掺假定量分析。拉曼光谱由分子的振动或转动获得其结构、对称性等分子信息,利用化学键的几种独特的振动模式辨别基团种类,从而实现对样品的定性定量分析。Rašković等[31]在Marquardt等[32]的研究基础上,通过拉曼光谱(波长532 nm的激光、10 s的采集时间)对12 种不同的冷冻鱼片(鳕鱼、鲱鱼、鲑鱼类、鲈鱼、鲶鱼、金枪鱼)进行分类。通过测定鱼片中的蛋白质,分析2 800~3 050 cm-1区域(CH拉伸区域)和500~1 800 cm-1区域(指纹区域),再对光谱进行化学计量法分析,找出鱼类之间的相似性,将12 种鱼类分成3 类:CA组、淡水鱼组、海水鱼组。其中CA组包括鲑鱼类,淡水鱼组包括鲈鱼和鲶鱼,海水鱼包括鲱鱼、金枪鱼和鳕鱼。
2.1.3 电磁波法
基于电磁学特性的检测方法主要为核磁共振波谱(nuclear magnetic resonance,NMR)技术。NMR技术即在强磁场中,具有磁性的原子核存在不同能级,用特定频率的电磁波照射样品,当电磁波能量等于能级差时,诱导能级之间发生跃迁,产生共振谱,可用于测定分子中某些原子的数目、类型和相对位置。在食品分析检测中,由于氢原子具有固定的磁矩,而且广泛存在于食品原料及成品中,因此主要根据氢核的弛豫时间会随着食品的组成成分、温度、水分含量等因素的变化而改变的性质来判断食品内部的信息变化。NMR广泛用于定量分析鱼产品的纯度,是一种简单、快速和高分辨率的定量技术。Standal等[33]研究了东北极鳕鱼和挪威沿海鳕鱼、以及黑线鳕、绿青鳕和绿鳕中的脂类,用13C NMR法观察了5 种鱼的甘油区域和羰基区域中磷脂酰胆碱和磷脂酰乙醇胺的立体特异性分布的差异。对13C NMR的数据经过多元分析(PCA、线性判别分析、贝叶斯信念网络分类分析)发现PCA的3 个PC值分别占数据集方差的36%、9%和9%;而在贝叶斯信念网络分类分析中,以16 个最重要的化学位移作为变量(172.81、26.56、33.96、29.31、25.61、29.29、128.02、29.14、128.60、70.77、29.32、28.04、128.27、29.11、25.32、127.54 mg/kg)从而实现了对5 种近缘鱼种的正确分类。
2.1.4 质谱法
质谱法是使试样中各组分电离生成不同质荷比的离子,不同质荷比的离子聚焦在不同的点上,分别聚焦而得到质谱图,检测化合物和元素组成,不仅可以得到相对分子质量,还能分析被测物质的结构信息,具有较高的灵敏度和分辨率。质谱法可以进行有效的定性分析,但在有机物定量分析时要经过复杂的分离纯化操作,而色谱对有机化合物是一种有效的分离和分析方法,反之定性分析则比较困难,因此两者的有效结合能更好地实现定性定量分析。在这一理论的基础上,Maasz等[34]验证了激光解吸电离-飞行时间质谱法鉴定近缘物种之间的适用性。其将质谱信息与化学计量数据分析相结合,样品经过光解吸电离-飞行时间质谱后对质谱图进行回归分析,根据不同鱼的质荷比不同,再通过多元聚类分析以及自组织映射数学分析工具的验证,对鳗形目、鲈形目和鲤科目的8 种鱼进行了种类鉴别和性别鉴定。
上述方法均属于无损检测技术,已经被大量实验证明其可利用性,可以用于鱼产品的质量评估、分级、掺假等鉴定,具有避免破坏样品、重复性好、检测速度快等优点[35]。但无损检测也存在一定的局限性:如生物传感器由于生物结构的易变性,稳定性不好,需要提高选择性和精确度,更需要进一步发展实现物种的鉴别。光谱技术的限制性在于对检测人员的技术要求较高,需要在数据处理方面具有良好的基础。近红外光谱主要依赖于所采用参考方法的可靠性,拉曼光谱的固有因素如干扰生物荧光以及激光产生的一些热量可能会影响测量的有效性,因此光谱技术需要提高灵敏度及选择性。NMR虽然已经作为一种成熟的技术在各个领域实现广泛的应用,但相较于色谱、光谱等检测效率高且检出限低的方法,NMR的检测结果多为定性或者半定量;同时,如何将高场NMR应用到食品掺假检测领域也是新的技术挑战。质谱法虽然具有高灵敏度、高通量、专一的结构信息等优点,但通常需要与色谱联用才能发挥更大的作用,且仪器造价较高、需要专业技术人员分析。总地来说,随着科技的发展,无损检测技术必将向着简单、便携、高特异性、高灵敏度的方向发展。
表2对常用鱼产品掺假鉴别的无损检测技术进行了总结。

表2 鱼产品掺假鉴别的无损检测技术Table 2 Non-destructive testing technologies for identification of adulterated fish products
2.2 蛋白质分析方法
蛋白质是生命的物质基础,不同物种的肌肉组成拥有特定的氨基酸序列、组成成分以及蛋白质三维结构,特别适用于物种鉴别。大多数来自鱼类和海鲜的过敏原是热稳定的蛋白质,在一定程度上可以抵抗消化,主要的鱼类过敏原小白蛋白在许多鱼类肌肉的肌浆中含量很高。常用的蛋白质分析方法包括以蛋白质条带为基础的电泳法、以抗原抗体特异性反应为基础的免疫学技术、以蛋白质的特征组分为基础的色谱分析法。
2.2.1 电泳法
电泳法是可溶性蛋白质在电场的作用下向着与其电性相反的电极移动,根据移动速度不同达到分离效果的技术。随着基因组学、蛋白质组学的发展,许多新的电泳技术也随之孕育而生,使得DNA及蛋白质在分离和测量方法上有了更精确的提高,同时也为物种鉴别提供了更有利的工具。常用于检测的方法有聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)、等电聚焦电泳(isoelectric focusing,IEF)、毛细管电泳(capillary electrophoresis,CE)。
2.2.1.1 聚丙烯酰胺凝胶电泳法
PAGE以聚丙烯酰胺凝胶作介质来分离蛋白质和寡核苷酸,包括非变性PAGE和十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-PAGE两种。非变性PAGE在电泳的过程中依据蛋白质的分子质量大小、形状及其电荷量而逐渐呈梯度分开。SDS-PAGE仅根据蛋白质分子质量的不同将蛋白质分开。Goienetxe等[40]从煮熟的和鲜活的黄鳍金枪鱼、大眼金枪鱼和鲣鱼中提取L-组织蛋白酶、水溶性蛋白和总蛋白组分,在聚丙烯酰胺凝胶中以200 V的电压电泳1 h,电泳后用考马斯亮蓝或者银染法将凝胶染色。利用银染法对低分子质量蛋白质条带区域进行分析,发现3 种鱼在该区域显示出不同的条带。利用考马斯亮蓝染色的凝胶在10~15 kDa处发现总蛋白提取物显示出有差异的条带,在25 kDa处发现3 种鱼的组织蛋白酶条带明显不同,在43 kDa处条带可以看出不同物种的水溶性蛋白存在区别。SDS-PAGE通常与其他技术联用,以达到更高的分辨能力和灵敏度。Sotelo等[41]通过SDS-PAGE和IEF分析可溶性肌肉蛋白,对7 种鲜鱼和熏鱼产品(鲑鱼、鲳鱼、鳟鱼、大西洋鲱鱼、欧洲鳗鱼、剑鱼和凤尾鱼)进行测定。发现在SDS-PAGE图谱上,鲱鱼和鳗鱼仅显示低分子质量区域(14 kDa)的蛋白质条带,而鳟鱼和鲑鱼的蛋白质图谱相似。IEF可以获得更多的特异性蛋白条带和更清晰的模式图像,且不同种类和处理方式鱼蛋白质的条带不同。
2.2.1.2 等电聚焦法
IEF是利用两性电解质在凝胶内制造一个pH值梯度,根据蛋白质的等电点不同,每种蛋白质分别聚焦在等于其等电点相应的pH值位置上,形成分离的蛋白质区带。Kappel等[28]调查了德国4 座城市24 家餐馆的47 种鳎目鱼样品,以肌浆蛋白的IEF法测定零售样品。在IEF凝胶的阳极发现具有稳定性和特异性的白蛋白,同时对于烹饪后的鳎目鱼,在等电点(5.2~5.3之间)发现特异性条带。将真实样品与代替样品相比较,清楚地显示鳎目鱼具有特异性的白蛋白条带。实际样品检测的结果表明50%的餐馆销售掺假的鳎目鱼,鳎目鱼的总掺假率为2.9%,同时找出常见的掺假种类为鲶鱼和西非比目鱼。在此基础上,IEF同样常与其他技术联用以确定其可行性,提高检测的灵敏度和准确性。Abdullah等[42]对金枪鱼、鲶鱼、罗非鱼和笛鲷属以基于聚合酶链式反应(polymerase chain reaction,PCR)的方法进行鉴别,但由于金枪鱼中白蛋白序列高度相似,不能实现种类分化。因此采用IEF对肌浆蛋白的分析能够快速鉴定鲶鱼、罗非鱼和鲷鱼。由肌浆蛋白质IEF获得的蛋白质模式在凝胶的阳极部分显示出强的清蛋白条带,从而得以鉴别种类。
2.2.1.3 毛细管电泳法
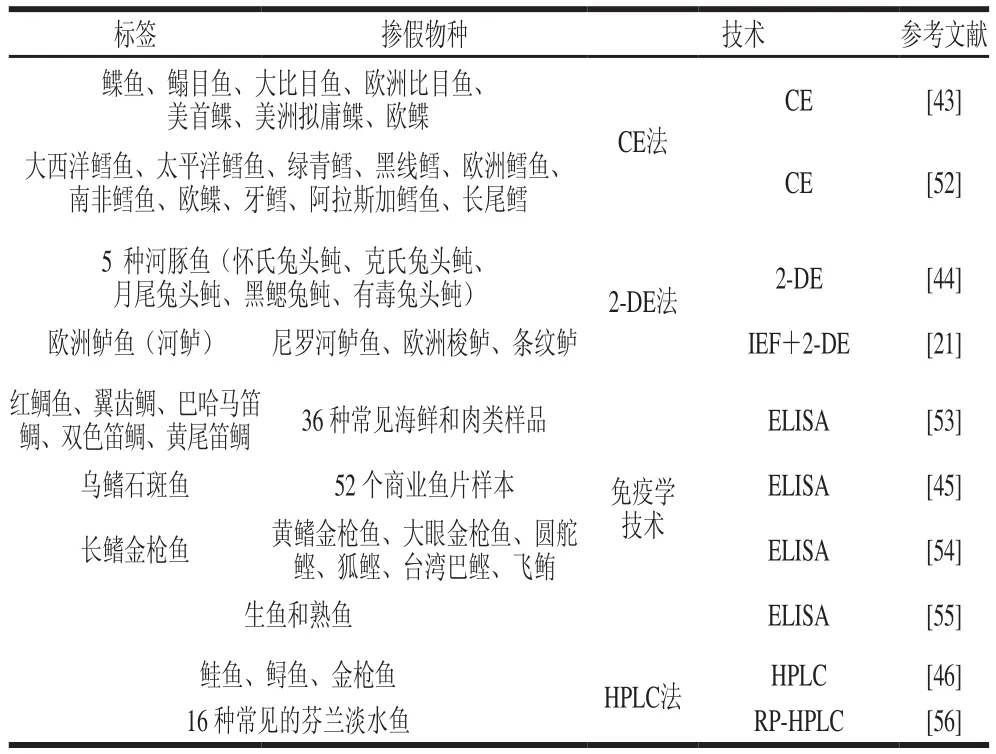
CE是一种稳定发展的技术,具有操作简单、分离速度快、灵敏度高、可进行定量分析等优点。其原理是在高电场强度下,将毛细管中的待测物依据各组分的电荷、质量、体积以及形状等因素引起迁移速度不同而实现分离。Gallardo等[43]在低pH值(pH 2.44)下对8 种比目鱼的肌浆蛋白进行CE分析。提取出鱼的水溶性蛋白(包含肌浆蛋白)在CE装置中受到电场的作用而向阴极移动,40 min内通过电泳分离蛋白质,并通过逐渐增加电压提高蛋白质的分离度,发现在提取物中使用低质量浓度蛋白(0.1 mg/mL)可以得到理想的分辨率和重现性;再分别对8 种鱼的肌浆蛋白进行分析,所产生的CE图谱对每个物种具有特异性,可用于鉴别8 种比目鱼的种类。
2.2.1.4 二维凝胶电泳
二维凝胶电泳(two-dimensional gel electrophoresis,2-DE)是目前蛋白质研究中最有效的分离技术。它由两向电泳组成,第一向是以电荷差异为基础的IEF,第二向是以分子质量差异为基础的SDS-PAGE,即采用等电点和分子质量的特异性,将蛋白质混合物在电荷和分子质量两个方向上进行分离。Chen等[44]利用河豚尿素中可溶性蛋白成分的差异特性,对5 种近缘河豚鱼种,利用固定化pH值梯度-2-DE技术进行种类区分。结果表明,等电点范围为3~10,分子质量范围为7.4~205.0 kDa的情况下,河豚鱼的肌肉蛋白在2-DE凝胶中分解为171~260 个点;其中等电点为3.5~7.0,分子质量为7.4~45.0 kDa的肌肉蛋白的分辨率更好,有利于物种识别。特别是低分子质量的酸性蛋白越多,物种特异性就越明显,从而能更有效地鉴定河豚鱼。
2.2.2 免疫学技术
免疫学技术以抗原抗体特异性反应为基础,分为非标记免疫技术和标记免疫技术。非标记免疫技术包括免疫扩散和免疫电泳,标记免疫技术包括酶免疫分析、放射免疫分析等,用于食品检测的主要为酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)。其原理是使抗原或抗体与酶连接成酶标抗原或抗体,在测定时,把受检样品和酶标抗原或抗体与固相载体表面的抗原或抗体反应,加入酶反应的底物后,底物被酶催化变为有色产物,根据颜色反应的深浅来进行定性或定量分析。ELISA作为蛋白质分析的主要技术,由于其简单快速的操作方法、能够实现大量样品的现场检测,在鱼类鉴别中得到广泛应用。Asensio等[45]对石斑鱼、罗非鱼、鲶鱼、鲻鱼、鼬鱼等,通过使用免疫棒比色ELISA法分析了石斑鱼肌肉蛋白质特异性的单克隆抗体3D12对这些鱼类的特异性。发现只有石斑鱼的比色棒为蓝色,其他物种均为无色。基于此实验,对从市场和超市收集的52 条被贴上石斑鱼标签的商业鱼片样本进行分析,发现只有14 个样本被确认为石斑鱼。该程序操作简单,分析所需时间短(少于1.5 h),适合于对大量样品进行筛选实验,有利于进行现场检测。
2.2.3 色谱分析法
色谱分析法是利用待分离的各种物质在两相中的分配系数、吸附能力等亲和能力的不同来进行分离的。在物种鉴别中,根据不同物种的蛋白质、氨基酸的差异进行分离,主要采用液相色谱,其具有分析速度快、分离效能高、自动化等特点。Horstkotte等[46]采用高效液相色谱法(high performance liquid chromatography,HPLC)分离4 种鳕鱼(绿鳕、狗鳕、大西洋鳕鱼、牙鳕)的水溶性蛋白,并在230 nm波长处找到每个物种的特征峰,从而鉴别4 种近缘鳕鱼。同时还对不同贮藏条件下的鳕鱼进行分析,发现冷藏和冷冻的温度变化对蛋白质几乎没有影响。
基于蛋白质的分析方法具有低成本、快速的特点,而且由于不需要扩增,所以较少的样品交叉污染不会导致错误的物种分配,因此有利于处理大量相同的样本。但也存在一些局限性:由于蛋白质会受到肉制品新鲜程度以及加工程度,特别是加热的影响而发生变性,导致重现性差或者测定不准确,出现假阳性;IEF法产生的蛋白质图谱复杂,通常适用单一物种的测定;CE技术同样不适用混合样品,且仪器成本较高;免疫分析法存在着抗原抗体交叉反应的问题。因此蛋白质方法常用作快速筛查的定性分析,或与其他技术联用以提高准确度和分辨率。
鱼产品掺假鉴别的蛋白质分析法汇总如表3所示。

表3 鱼产品掺假鉴别的蛋白质分析法Table 3 Protein analysis for identification of adulterated fish products
续表3
2.3 DNA分析方法
DNA作为遗传物质是生命最基本物质之一,存在于生物大多数细胞中,具有一定的热稳定性和物种特异性,因此相比其他方法具有更高的分辨率、特异性和敏感度。由于每种动物的DNA序列都具有唯一性和稳定性,且不同组织器官的DNA序列相同,因此可以从不同部位提取DNA。目前DNA分析主要采用基因组DNA和线粒体DNA。PCR是目前食品检测应用最广泛的技术,具有高效、快速、极高灵敏度和分辨率,不仅适用于动物的种类鉴别,甚至可用于近缘物种的识别,还可用于各种加工肉和产品的检测。
2.3.1 常规PCR技术
在动物鉴别中通常采用线粒体基因作为靶基因,包括D-loop区、线粒体细胞色素b基因(cyt b)、12S rRNA、16S rRNA以及3 个细胞色素氧化酶亚基基因(CoI、CoII、CoIII)。用物种间高度特异性引物对样品中的DNA进行PCR扩增后琼脂糖电泳分离,通过观察是否有特异性条带判定样品中是否含有相应的物种成分。Pedrosa-Gerasmio等[57]将mtDNA CR D-loop用作区分幼年黄鳍金枪鱼和大眼金枪鱼的标记基因,并将分子鉴定结果与基于传统特征的鉴定结果进行比较。结果表明,mtDNA CR D-loop在鉴别幼年的黄鳍金枪鱼和大眼金枪鱼时具有高度的准确性。Santaclara等[58]利用cyt b基因对金枪鱼和鲣鱼进行鉴定,采用不同的PCR检测技术(测序、限制性内切酶进行酶切、实时荧光定量PCR(quantitative real time PCR,qPCR)和熔解曲线),阳性结果表示可能是金枪鱼,阴性结果则表示可能为鲣鱼。Infante等[59]开发了一种用于商业罐头食品中大西洋鲭鱼认证的多重PCR检测方法。实验中采用鲭鱼线粒体NADH脱氢酶亚基5上的特定的片段(123 bp)以及12S rRNA亚基(188 bp)进行扩增,对6 种不同的鲭鱼罐装进行了检测。Trottat等[60]用石斑鱼的16S rRNA序列,通过多重PCR和qPCR两种方法,能够从鱼市常见替代品种(多锯鲷、尼罗河鲈鱼)中快速准确地识别和区分6 种石斑鱼品种。针对于细胞色素氧化酶基因,Cutarelli等[61]利用线粒体cyt b和细胞色素氧化酶亚基I基因(COI)进行了双向序列分析,对意大利商业海鲜产品进行了鱼种鉴定,证实了cyt b和COI可用来进行鱼类特别是近缘关系的鱼种鉴定。
2.3.2 实时荧光定量PCR技术
普通的PCR技术虽然操作简单,但耗时长,对技术要求较高,且只能进行定性分析,不能满足定量分析的需求。在普通PCR的基础上,于PCR反应体系中加入荧光基团,利用荧光信号来监测PCR的进程,再通过制作标准曲线,从而对未知模板进行定量分析。相比于第一代PCR,qPCR具有操作简便、快速高效、灵敏度高、可以定量分析等特点。根据荧光作用方式分为:DNA结合染料法、荧光杂交探针技术。
2.3.2.1 DNA结合染料法
DNA结合染料法的原理是DNA双链与染料结合后,在某种波长下被激发产生荧光信号,当染料处于游离状态时,产生的荧光信号低。产物扩增后,荧光信号随着产物的增加而增加,即信号强度代表双链DNA分子的数量。该方法操作简单、成本较低,但特异性较差,且易受引物二聚体的影响。目前最常用的DNA染料为SYBR Green I,它是一种只与DNA双链结合的荧光染料。李新光等[62]以COI为靶基因,对大西洋鲑鱼和虹鳟鱼建立起基于SYBR Green I qPCR的方法,根据TM的差异(大西洋鲑鱼的TM为(86.29±0.17)℃,虹鳟鱼则为(83.50±0.20)℃)从而对两者进行区分。利用此方法,对市场上掺假严重的鳕鱼品种也有鉴定的实例。以大西洋鳕鱼COX I为靶基因,孙晓飞等[63]利用SYBR Green的qPCR,通过对大西洋鳕鱼和其他49 份样品进行检测,发现只有大西洋鳕鱼出现了扩增,Ct值为23.216±0.113,特异性可达0.01%,灵敏度达到0.06 ng/μL。
2.3.2.2 荧光探针技术
荧光探针技术的原理是探针完整时不发出荧光信号,当PCR扩增,Taq酶的外切酶活性将探针酶切降解,从而使探针所带的荧光信号显示,且每扩增一条DNA链,就多一个荧光分子,对PCR产物实现定量分析。该方法特异性好,但成本较高。常用的为TaqMan探针,其5’端标记荧光基团,3’端带有猝灭基团。Hird等[64]通过qPCR鉴定大西洋鳕鱼、大西洋鲑鱼和欧洲比目鱼。利用大西洋鳕鱼的大肠杆菌素、大西洋鲑鱼的生长激素和欧洲比目鱼的小白蛋白设计每个物种的引物和探针,然后判定各个引物的特异性,用于检测和识别大西洋鳕鱼。于此同时,Chuang等[65]也基于qPCR技术,设计了4 种特定的TaqMan探针来鉴定大眼金枪鱼、太平洋蓝鳍金枪鱼、南方蓝鳍金枪鱼和黄鳍金枪鱼,还利用SYBR Green来验证对大眼金枪鱼的鉴定结果。上述研究证明该方法可以应用于新鲜、腌制和罐装样品的快速检测。
2.3.3 其他核酸分析方法
2.3.3.1 限制性片段长度多态性分析法
限制性片段长度多态性(restriction fragment length polymorphism,RFLP)分析法的原理是利用限制性内切酶识别DNA特定序列并切开,形成不同长度大小、不同数量的限制性片段,然后将这些片段进行凝胶电泳,分析其多态性结果。Lin Wenfeng等[66]采用PCR-RFLP技术结合磁珠的方法,确定了蓝鳍金枪鱼、长鳍金枪鱼、大眼金枪鱼、黄鳍金枪鱼以及几种鲣鱼,并对其产品进行了研究。设计两组引物分别用于扩增cyt b基因的126 bp和146 bp片段,并用Bsp1286I、HincII、RsaI、ScaI和MboII5 种限制性酶分析短片段,从而成功鉴定了18 种商业罐装金枪鱼及罐头中的8 种金枪种类。随着科技的发展,PCR-RFLP能够与更先进的技术结合。如利用PCR-RFLP和芯片技术,Chen Shuangya等[67]对台湾海峡62 种商业鱼类进行了鉴定,鱼种包括10 个石斑鱼、12 个鲷鱼、9 个小须鲸科、5 个河豚和26 个其他鱼类。将cyt b基因的464 bp片段扩增,扩增产物用限制性酶DdeI、HaeIII和NlaIII酶解,酶解后的碎片在DNA芯片上得到进一步分析,最终将几种不同种类的鱼加以区分。
利用限制性内切酶能识别并切开DNA特定序列,产生限制性片段,所得产物的差异性也反映出基因组DNA限制性内切酶酶切位点的差异,体现不同物种DNA分子的差异。该方法操作复杂,不易获得可利用的酶切图谱,依赖于种内多态性,还可能存在由于不完全的酶切生成的假阴性反应。Dooley等[52]利用RFLP技术对英国10 种鳕鱼品种的线粒体cyt b基因进行分析,再经过DdeI、NlaIII和HaeIII 3 种限制酶对10 种物种的DNA进行酶切,通过CE分析,能够准确测定10 种鱼种的DNA片段,且检出限达到5%。
2.3.3.2 单链构象多态性分析法
单链构象多态性(single-strand conformation polymorphism,SSCP)分析是一种DNA单链凝胶电泳技术,利用DNA或RNA单链构象具有多态性的特点,先进行PCR扩增特定序列,然后将扩增产物变性为单链,进行非变性PAGE,由于DNA单链可自身折叠形成具有一定空间结构的构象,使电泳迁移率不同,从而检测基因的变异。Asensio等[68]建立了一种DNA分析方法,以验证鞍带石斑鱼、叉角鱼、尼罗河鲈鱼鱼片的真实性。通过聚合酶链反应,对线粒体12S rRNA基因的短片段(208 bp)进行扩增。采用SSCP技术,用天然PAGE分离DNA链,再用银染色法进行观察。总电泳和染色时间为2 h,证明了该方法适用于食品控制实验室的常规分析。
2.3.3.3 随机扩增多态性DNA技术
随机扩增多态性DNA(randomly amplified polymorphic DNA,RAPD)技术的原理是以单个人工合成的随机短引物(通常为10 个碱基对),在TaqDNA酶作用下,进行PCR扩增,扩增产物再经凝胶电泳分离、染色后,得到高度变异的DNA谱图,进而分析DNA的多态性,该法具有简便、快捷、成本低且无需知道目标序列信息的优点,但由于退火温度较低(36 ℃)且引物序列较短,该技术的分辨率和可重复性较低,易受外源信息的干扰。Partis等[69]采用RAPD法对来自8 种鱼类的160 种标本进行了分析,包括澳洲肺鱼、尼罗河鲈鱼、海鲂、镜子鱼、云纹雨印鲷、spikey oreo、十异海魴和新西兰红海鲂鱼,主要分析澳洲肺鱼。结果显示,在凝胶电泳图谱中,不同鱼种呈现出不同的DNA谱带。因此可以用于检测市场中的鱼种标签真实性。
2.3.3.4 扩增片段长度多态性技术
扩增片段长度多态性(amplified fragment length polymorphism,AFLP)技术是RFLP与PCR相结合的产物,原理是先利用限制性内切酶酶解DNA产生不同大小的片段,将片段两端接上人工合成的接头,然后选择性地对多肽片段进行扩增,最终运用PAGE检测分析样品的多态性。它克服了RFLP技术中需要大量的DNA样品和灵敏度差的缺点,具有重复性好、多态性强、分辨率高等优点,但要求DNA纯度高,且成本较高。王亮晖[70]以建鲤和金鱼为研究对象,研究了建鲤雌雄个体的不同性,发现了两条雄性特有的条带(分别为171 bp和175 bp),并通过4 个金鱼品种的分析,发现其中30.4%的片段为所有品种个体共有条带,其余69.6%为多态性片段,为金鱼品种鉴别和遗传信息提供参考。
2.3.4 DNA条码技术
DNA条形码是指生物体内具有代表性的、标准的、可以变异的、易扩增且相对较短的DNA片段,用于鉴定物种及物种间亲缘关系。该技术的特点是准确性高、重复性高、操作简单,通过建立DNA条形码数据库,可以一次性快速鉴定大量样本,因此在鱼类检测中被广泛应用,在2005年,鱼类被选为全球DNA条形码覆盖的主要目标,目前已经有超过5 000 种鱼类被分类。Berrini等[12]在意大利南部市场随机购买了40 个标有European plaice和Solea Solea的新鲜和冷冻的鱼片样本,将鱼片COI条码序列的660 bp与COI条码参考库的序列相比,发现35%的European plaice以及41%的Solea Solea被错贴标签。Naaum等[4]对加拿大市场294 个不同的鱼类进行分析,使用标准引物对鱼的COI基因进行扩增,然后进行DNA条码比对,发现加拿大市场有23%的样本被贴上了错误的标签。从加拿大和北美东北部的商业市场和餐馆获得了96 个鱼组织样本,对BOLD和GenBank数据库进行比较,发现91 个测序样品中的23 个被错误标记,其中最常见的为红鲷鱼和金枪鱼。
2.3.5 等温扩增技术
该技术是近年来新发展的技术,相比于普通PCR,其摆脱了对精良设备的依赖,特点是针对靶基因的6 个区域设计4 种特异引物,利用链置换DNA聚合酶在等温条件(63 ℃左右)保温30~60 min来达到快速扩增核酸的目的。根据技术又分为链替代等温扩增、依赖解旋酶等温扩增、滚环等温扩增、依赖核酸序列等温扩增、交叉引物等温扩增等。其中最常用的为环介导等温扩增技术(loop-mediated isothermal amplification,LAMP),该技术有3 对特异性引物(1 对外引物、1 对环状引物和1 对内引物),依靠链置换Bst DNA聚合酶,使得链置换DNA合成自我循环,达到快速扩增。最近一项研究利用LAMP技术对大西洋鲑的线粒体CR区段设计特异性引物,并通过单因素试验和正交试验分析反应体系中dNTPMix、Mg2+、甜菜碱终浓度对扩增产物的影响,得到LAMP在扩增大西洋鲑的最优条件,对大西洋鲑DNA的检出限达0.01 ng/μL[71]。等温扩增技术是近几年来发展的热门方向,由于其只需恒温装置(如水浴锅)便可完成快速且高效的扩增反应,同时具有高灵敏度、高特异性、自动化程度高等优点,在未来食品检测中有广阔的发展前景。

表4 鱼产品掺假鉴别的DNA分析法Table 4 DNA analysis for identification of adulterated fish products
2.3.6 数字PCR技术
数字PCR技术是一种新的核酸检测和定量方法,属于核酸分子绝对定量技术,可直接数出DNA分子的个数。其反应原理是将一个样本分成几十到几万份,分配到不同的反应单元,每个单元包含一个或多个DNA模板,在每个反应单元中分别对目标分子进行PCR扩增,扩增结束后对各个反应单元的荧光信号进行统计学分析。数字PCR技术是一项具有极高的准确度、灵敏度和特异性,重复性高的定量微量DNA分子技术。Noh等[72]基于新技术的液滴数字PCR技术的高精度定量方法,确定了海产品中阿拉斯加鳕鱼(Gadus chalcogrammus)的含量。数字PCR技术问世以来,以其绝对定量和高灵敏性等突出的优点,赢得了广泛的关注,目前实际应用中数字PCR技术也存在一定的缺点,如其灵敏度和准确性有待进一步的优化,仍需要传统方法作为对照,仪器设备价格较高,使用费用较为昂贵。随着数字PCR技术的改进,该技术必将广泛应用于生命科学的各个领域。
表4总结了常见的鱼产品掺假鉴别的DNA分析法。

续表4
3 结 语
水产品掺假是一个全球性的问题。当一个低成本的产品被标记为具有更高价值的产品时,这种行为可以理解为欺诈,对消费者具有直接的经济影响;而且不同的物种含有不同含量的重金属和营养物质,有些物质具有一定毒性,会对人体健康产生影响;此外,这种持续不断的恶劣行为也会对渔业造成一定经济损失和环境破坏,对物种的可持续性发展造成不良影响。为了解决这一问题,必须不断发展和完善快速、准确的检测方法,对水产品进行真实性鉴定。
以红外光谱为代表的非破坏性、非接触性的无损检测技术可以作为鱼类和鱼产品掺假的在线监测方法,其检测时间短,不需要化学试剂和样品的制备,避免了环境污染,是实现对大量鱼产品进行自动化掺假鉴别的发展方向。但目前可用于实际检测的红外光谱技术还存在一定的局限性,还需要结合化学计量学,研究构建不同鱼类的鉴别模型,从而实现对不同种类鱼的快速鉴别。
其他无损检测技术(生物传感器、质谱法、蛋白分析法等)均存在一定的缺点。如生物传感器更多适用于检测样品的新鲜度;波谱、质谱等对仪器的要求较高,且需要专业技术人员来分析,而我国较好的仪器大部分为进口,价格昂贵,不适用于大量的、现场的检测;基于蛋白质的分析方法虽然准确度、通量都很高,但蛋白质在加热或者化学试剂中容易变性,存在重复性差、准确度差、容易出现假阳性等问题,一般需要与其他技术联用以提高分辨率和准确性。
目前常用DNA检测技术对鱼类进行检测。基于核酸的检测方法更优于蛋白质技术,由于遗传信息直接决定生物的本质,且DNA具有稳定性,因此通过DNA来鉴别生物物种是目前最具权威和科学性的方法。最常用于检测鱼肉及鱼肉产品的质量与掺假情况的技术是DNA条码技术和qPCR。
近年来,随着PCR技术的发展与成熟,以及人们对于现场快速及掺假量化测定的需求,缩短PCR反应时间及发展定量分析方法成为PCR鉴别方法的研究趋势,这也为数字PCR技术和PCR芯片技术的发展提供了前提。另外,PCR发展的热门还包括LAMP技术、RPA技术,能够将反应时间由2 h缩短至1 h甚至15 min以内,PCR扩增产物可以通过颜色变化或试纸条体现,从而实现现场快速检测。
虽然目前围绕鱼类掺假的研究很多,且PCR检测技术已经开发出了多种方法。但由于鱼类掺假品种众多,因此对于大量样品以及现场检测技术还需要进一步的发展。目前已经有公司开发出了鱼品种检测的试剂盒,可以定性测定鱼的种类,如英国Tepnel Biosystems公司设计出将鳕、鳟、鲑等8 种鱼类的DNA样品经过磁珠纯化、PCR扩增及凝胶电泳定性检测的DNA试剂盒[74]。因此,未来的发展方向是将DNA提取、扩增与检测集成化,结合芯片技术,开发简单、快速、定量、能够实现现场检测的鱼类品种鉴别方法。鱼产品掺假的定性检测已经发展至一定的阶段,但定量检测技术还不够完善,这也将是未来鱼产品掺假检测的主流趋势,定量检测的需求将进一步促进数字PCR技术在鱼类鉴别中的应用和发展。

