发酵和加工对桑椹抗氧化和降血糖作用的影响
龙晓珊,胡腾根,邹宇晓,廖森泰*,王思远,林光月,黎尔纳,刘 凡,李 倩
(广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610)
糖尿病是一类以高血糖为特征的代谢性疾病,伴随着胰岛素分泌不足或者胰岛素抵抗引起的患者糖脂代谢紊乱,长期的高血糖状态会使机体的自由基过剩,产生氧化应激反应,对机体胰岛细胞造成损伤,降低其胰岛素敏感性,从而诱发各种并发症[1-5]。目前主要通过药物降低糖尿病患者的血糖水平,提高机体抗氧化能力,达到改善及治疗糖尿病的效果[6-9]。但是长期服用药物会对机体产生毒副作用,而且无法从根本上阻止胰岛β细胞的进一步坏死;且部分口服降糖药效果较差,所以开发新型的降糖药物很有必要。已有研究将桑叶、桑椹、葡萄籽、蒲公英、柿叶、银杏叶、苦瓜以及其他植物提取物用于糖尿病治疗,并取得了一定的降血糖效果[10-12],且其具有天然、绿色、对人体无毒副作用等优点。
桑椹作为我国的传统中药,位列国家卫生部公布的“既是食品又是药品”名录,被誉为“21世纪的最佳保健果品”[13-14]。桑椹营养成分丰富,含有游离脂肪酸、粗纤维、氨基酸、微量元素、维生素以及钙、磷、铁、铜、锌等矿物质成分,富含生物碱、花青素、多酚、黄酮类、多糖等多种活性成分,具有抗氧化、降血糖、降血脂等功效[15-16]。范智义等发现桑椹提取物各组分均表现出一定的抗氧化能力和抗糖基化能力[17];Chen Chun等发现桑椹多糖具有清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的能力,对α-葡萄糖苷酶和α-淀粉酶都有抑制作用,证实了桑椹多糖具有抗氧化和降血糖作用[18]。
但是桑椹富含碳水化合物,不利于糖尿病人直接食用。发酵可以通过微生物代谢达到脱除桑椹中碳水化合物的目的。同时,针对加工过程中桑椹发酵液(fermented mulberry,FM)中益生菌损失较大的问题,加入黄豆辅料作为保护剂可以减少冷冻干燥过程中益生菌的失活。同时,黄豆富含异黄酮、卵磷脂、低聚糖、豆甾醇等功能性物质,具有抗氧化和降血糖作用[19-21]。
综上所述,本实验对桑椹进行发酵、冷冻干燥以及添加黄豆辅料处理,研究发酵和加工对桑椹抗氧化活性以及降血糖作用的影响,为糖尿病食品的开发提供依据。
1 材料与方法
1.1 材料与试剂
8~9 成熟的新鲜桑椹品种为‘粤椹大10’,采摘时选取无污染、无病虫害、成熟度均一的新鲜桑椹。黄豆购自黑龙江北纯农产品开发有限公司。
肠膜明串珠菌(Leuconstoc mesenteroides)、葡萄酒高活性干酵母(Saccharomyces cerevisiae)均由广东省农业科学院蚕业与农产品加工研究所菌种保藏中心提供。
硫酸亚铁、过氧化氢、水杨酸(分析纯) 天津市福晨化学试剂厂;VC(分析纯) 天津市大茂化学试剂厂;无水乙醇(分析纯) 南昌市蓝翔化工有限公司;甲醇、乙腈(色谱纯) 赛默飞世尔科技(中国)有限公司;琼脂、细菌学蛋白胨、MRS肉汤 广东环凯微生物科技有限公司;葡萄糖、果糖(标准品)、DPPH 齐云生物技术有限公司;2,2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)二铵盐、铁离子还原力(ferric ion reducing antioxidant powe,FRAP)试剂盒 碧云天生物技术公司。
1.2 仪器与设备
立式压力蒸汽灭菌锅、PX-250B-Z生化培养箱上海博迅实业有限公司医疗设备厂;1200 series高效液相色谱仪 美国Agilent公司;Sorvall Stratos高速冷冻离心机 美国Thermo Scientific公司;UV-1800紫外分光光度计 日本岛津公司;万能粉碎机 天津市泰斯特仪器有限公司;Infinite M200PRO酶标仪 瑞士Tecan公司。
1.3 方法
1.3.1 样品的制备
肠膜明串珠菌的活化复壮:配制肠膜明串珠菌培养液(5.4 g MRS肉汤、100 mL蒸馏水),于高压灭菌锅中121 ℃灭菌20 min。待培养液冷却后,在无菌条件下将肠膜明串珠菌接入其中,在30 ℃摇床中振荡培养。
酵母菌的活化复壮:配制酵母菌培养液(2.5 g酵母浸膏、5 g葡萄糖、5 g细菌学蛋白胨、250 mL蒸馏水),于高压灭菌锅中121 ℃灭菌20 min。待培养液冷却后,在无菌的条件下接入酵母菌,在28 ℃摇床中静置培养。
桑椹原粉(mulberry powder,MP)的制备:将采摘得到的新鲜桑椹放置在60 ℃烘箱中,48 h后取出,经粉碎机打成粉,过40 目筛,得到颗粒大小一致的MP。
FM的制备:取20 g MP和80 mL蒸馏水于250 mL三角瓶中,用封口膜封住瓶口后放置在高压灭菌锅中进行灭菌(121 ℃、20 min)。灭菌结束后,在无菌条件下操作,先接入活化过的肠膜明串珠菌,接种量为3.95×108CFU/mL,放置在30 ℃、150 r/min的摇床中有氧发酵96 h;然后接入活化过的酵母菌,接种量为1.76×105CFU/mL,28 ℃有氧发酵6 h[22],即得FM。
FM冷冻干燥样品(freeze-dried fermented mulberry,D(FM)):FM经冷冻干燥后得到D(FM)。
FM添加黄豆辅料后的冻干样品(freeze-dried fermented mulberry mixed with soybean,D(FM+S)):发酵液和黄豆按质量比5∶1混合,经冷冻干燥后得到D(FM+S)。
1.3.2 单糖含量的测定
参考Zheng Xin等的方法[23]并加以适当的改进,将待测样品用适量的水溶解,超声辅助提取30 min,4 ℃、10 000 r/min离心10 min,取上清液,用0.22 μm滤膜过滤后用于高效液相色谱分析单糖含量。色谱条件为:蒸发光检测器漂移管温度为45 ℃;色谱柱型号为Shodex Asahipak NH2P-504E(250 mm×4.6 mm,5 μm),柱温30 ℃;流动相为体积分数75%乙腈,流速为1 mL/min,进样量为20 μL。以葡萄糖、果糖标准品溶液质量浓度为横坐标,峰面积为纵坐标绘制标准曲线,计算样品的单糖含量。
1.3.3 菌落总数的测定
肠膜明串珠菌和酵母菌菌落总数的测定采用稀释平板涂布法,参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》中菌落总数测定方法[24]。按式(1)计算存活率。

1.3.4 发酵和加工对桑椹抗氧化能力的影响
1.3.4.1 ABTS阳离子自由基清除能力的测定
ABTS阳离子自由基清除能力采用ABTS试剂盒测定。向96 孔板的每个检测孔加入200 μL ABTS工作液,空白对照孔中加入10 μL蒸馏水,标准曲线检测孔加入10 μL各种浓度(分别为0.25、0.5、1、2、4、8 mmol/L)的水溶性VE(Trolox)标准溶液,样品检测孔加入10 μL样品(质量浓度分别为1、2、3、4、5 mg/mL),轻轻混匀;室温孵育2~6 min后测定其在734 nm波长处的OD值。ABTS阳离子自由基清除率计算如公式(2)所示,并计算半抑制浓度(half maximal inhibitory concentration,IC50)。
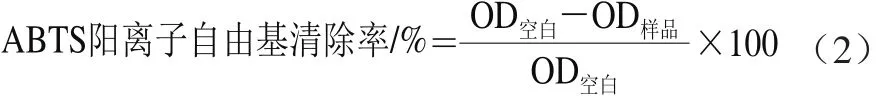
式中:OD样品为样品孔OD值;OD空白为空白对照孔OD值。
1.3.4.2 亚铁离子螯合能力的测定
亚铁离子螯合能力采用FRAP试剂盒测定。向96 孔板的每个检测孔加入180 μL FRAP工作液,空白对照孔中加入5 μL蒸馏水,标准曲线检测孔内加入5 μL各种质量浓度(分别为1、2、3、4、5 mg/mL)的FeSO4标准溶液,样品检测孔内加入5 μL样品,以5 μL 0.15~1.50 mmol/L Trolox作为阳性对照,轻轻混匀;37 ℃孵育3~5 min后在539 nm波长处测定OD值。亚铁离子螯合率计算如式(3)所示,并计算IC50。

式中:OD样品为样品孔OD值;OD空白为空白对照孔OD值。
1.3.4.3 DPPH自由基清除能力的测定
DPPH自由基清除能力参考孔凡刚等[25]的方法并加以适当改进,称取0.004 g DPPH,用无水乙醇溶解并定容至100 mL,保存于棕色瓶中。称取0.025 g Trolox,用20 mL无水乙醇溶解,配制成5 mmol/L Trolox母液,用无水乙醇将Trolox母液稀释成1 000、500、250、125、62.5、31.25 μmol/L。测定孔加入20 μL样品和180 μL DPPH;对照孔加入20 μL无水乙醇和180 μL DPPH;空白孔加入200 μL无水乙醇。将反应液加入酶标板中,避光反应30 min,在酶标仪中测定517 nm波长处的OD值,按式(4)计算DPPH自由基清除率,并计算IC50。
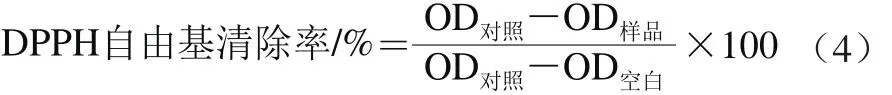
式中:OD样品为测定样品孔的OD值;OD对照为对照孔的OD值;OD空白为空白孔的OD值。
1.3.4.4 羟自由基清除能力的测定
羟自由基清除能力采用Fenton体系测定。分别取6 mmol/L硫酸亚铁和6 mmol/L过氧化氢各2.5 mL,混匀后加入6 mmol/L水杨酸7.5 mL;充分混匀,将体系放置在37 ℃水浴中反应15 min,于510 nm波长处测定吸光度A0,向体系中加入1 mL样品,37 ℃水浴反应15 min,于510 nm波长处测定吸光度Ax;用蒸馏水作空白对照,VC作阳性对照[26]。羟自由基清除率按式(5)计算,并计算IC50。

1.3.5 发酵和加工对桑椹α-葡萄糖苷酶抑制能力的影响
参照Kumar等的方法[27]并加以改进,向96 孔板中加入50 μL样品和25 μL 1 U/mL α-葡萄糖苷酶溶液(用0.1 mol/L pH 6.9磷酸盐缓冲液配制),充分混匀后于37 ℃反应10 min,加入25 μL 1.5 mol/L对硝基苯酚α-D-吡喃葡萄糖苷(用0.1 mol/L pH 6.9磷酸盐缓冲液配制),充分混匀后于37 ℃反应30 min,加入0.2 mol/L碳酸钠溶液100 μL终止反应,于酶标仪405 nm波长处测定OD值,同时设定相同体系下的样品背景对照组(不加酶)、空白对照组(不加样品)。α-葡萄糖苷酶抑制率按式(6)计算,并计算IC50。

式中:OD空白为空白对照组OD值;OD样品为样品组OD值;OD背景为样品背景对照组OD值。
1.4 数据统计与分析
实验数据表示为 ±s,采用Excel 2010软件计算。采用Origin 8.0软件作图。单因素方差分析采用SPSS 19.0软件,组间差异比较采用Duncan检验,P<0.05表示差异显著。
2 结果与分析
2.1 冷冻干燥和添加辅料对桑椹发酵产物菌落总数和存活率的影响
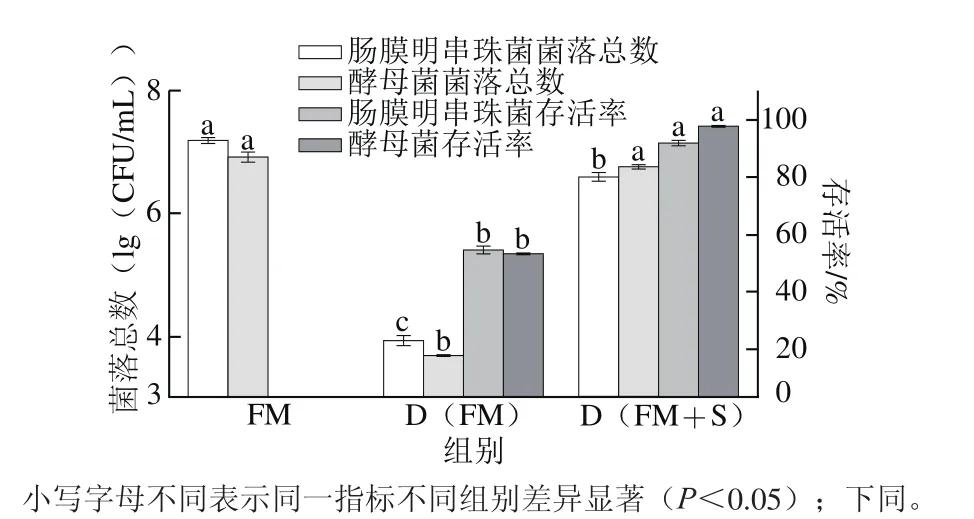
图1 冷冻干燥和添加辅料对桑椹发酵产物菌落总数和存活率的影响Fig. 1 Effect of lyophilization in the presence of soybean on microbial populations and survival rate in fermented mulberry
由图1可知,FM的肠膜明串珠菌和酵母菌菌落总数最大,酵母菌菌落总数为6.90(lg(CFU/mL)),肠膜明串珠菌比酵母菌略高,为7.18(lg(CFU/mL));FM经冷冻干燥后得到的D(FM),肠膜明串珠菌和酵母菌存活率分别为54.77%、53.40%,说明冷冻干燥对菌体存活率影响很大。D(FM+S)的菌落总数略低于FM,其中肠膜明串珠菌菌落总数为6.59(lg(CFU/mL)),存活率为91.85%;而酵母菌菌落总数为6.76(lg(CFU/mL)),与FM没有显著性差异(P>0.05),存活率高达97.76%。结果表明通过在发酵液中添加黄豆可以减少冷冻干燥过程中益生菌的损失,起到对益生菌的保护作用。可能的原因是黄豆富含异黄酮、卵磷脂、低聚糖、豆甾醇等功能性物质,其附着在益生菌表面,降低了冷冻干燥过程中低温对益生菌的影响,提高了益生菌的存活率[19-21]。同时,黄豆营养价值高,富含蛋白质、卵磷脂等多种营养成分,蛋白质量分数高达38%~40%[28],其中大豆卵磷脂和大豆蛋白可以作为保护剂,减少冷冻干燥过程中益生菌的损失,提高冷冻干燥产品中益生菌的存活率[19,29-30]。
2.2 发酵和加工对桑椹单糖含量的影响

表1 发酵和加工对桑椹单糖含量的影响Table 1 Effect of fermentation and processing on monosaccharide content of mulberry
为明确发酵、冷冻干燥等工艺对桑椹单糖含量的影响,本实验对桑椹及其加工产物的单糖含量进行分析。如表1所示,MP的果糖和葡萄糖含量分别是10.09、526.41 mg/g;FM和D(FM)中均检测不到果糖和葡萄糖,这可能是因为果糖和葡萄糖作为肠膜明串珠菌和酵母菌的能源物质被降解利用,转化为其他物质,降低了桑椹中碳水化合物的含量。周蓝波等报道低碳水化合物饮食有利于糖尿病的治疗[31],因此,通过微生物发酵脱糖成为开发降血糖食品的一种新工艺。D(FM+S)的果糖和葡萄糖的含量分别为0.01、0.47 mg/g,其单糖含量显著低于未发酵的MP(P<0.05),但葡萄糖含量比D(FM)略高,其可能的原因是D(FM+S)中的黄豆含有少量游离葡萄糖。
2.3 发酵和加工对桑椹抗氧化能力的影响
自由基是生物体在新陈代谢过程中产生的、对生物体危害较大、毒性较强的一种自由基,它可使生物体内不同组织中的氨基酸、糖类、蛋白质、核酸等物质发生氧化,导致组织损伤和破坏。Fe2+会通过Fenton反应引起脂质的过氧化反应,也会通过分解脂类氢过氧化物释放氧自由基和过氧化氢,加速过氧化反应。样品对ABTS阳离子自由基、DPPH自由基、羟自由基的清除能力以及亚铁离子螯合能力可以反映其抗氧化能力,自由基清除能力越强则抗氧化能力越强。
2.3.1 ABTS阳离子自由基的清除能力
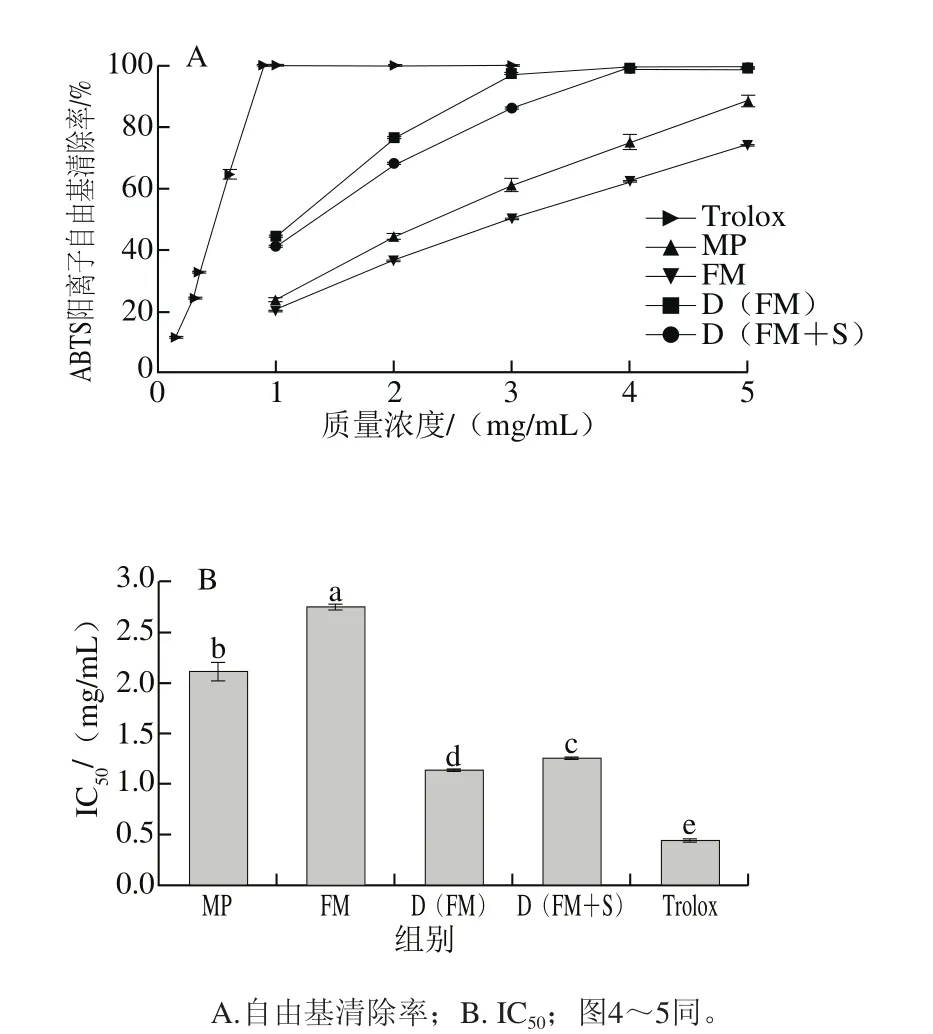
图2 发酵和加工对桑椹ABTS阳离子自由基清除能力的影响Fig. 2 Effect of fermentation and processing on ABTS free radical scavenging capacity of mulberry
图2 A、B表明,随着MP、FM、D(FM)、D(FM+S)质量浓度的增大,样品对ABTS阳离子自由基的清除能力也增强。研究表明,桑椹具有较强的ABTS阳离子自由基清除能力,且随质量浓度的增加而增强[32]。4 种样品对ABTS阳离子自由基的清除能力依次为D(FM)>D(FM+S)>MP>FM,对ABTS阳离子自由基的IC50依次为1.14、1.26、2.12、2.77 mg/mL,且具有显著性差异(P<0.05);对照Trolox的IC50为0.44 mg/mL,其ABTS阳离子自由基清除能力显著高于4 种样品(P<0.05)。发酵桑椹冻干粉ABTS阳离子自由基清除能力强于未发酵的MP和FM。
2.3.2 亚铁离子螯合能力
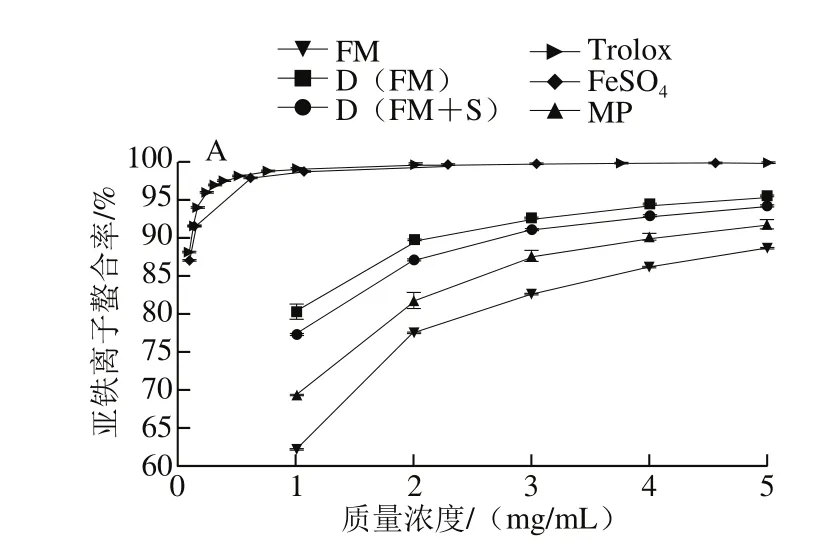

图3 发酵和加工对桑椹亚铁离子螯合能力的影响Fig. 3 Effect of fermentation and processing on ferrous ion chelating ability of mulberry
由图3A、B可知,MP、FM、D(FM)、D(FM+S)4 种样品都有一定的亚铁离子螯合能力,其IC50分别为0.44、0.59、0.25、0.28 mg/mL,除D(FM)和D(FM+S)间没有显著性差异(P>0.05),其他样品之间均差异显著(P<0.05)。结果表明,D(FM)和D(FM+S)的亚铁离子螯合能力最强,其次是MP,FM最弱,但都显著弱于对照Trolox(0.04 mg/mL)和FeSO4(0.09 mg/mL)。因此,发酵桑椹冻干粉亚铁离子螯合能力强于未发酵的MP和FM。同时,样品对亚铁离子的螯合能力也存在剂量依赖性,样品质量浓度越大,其亚铁离子螯合能力越强,与范智义等[17]的研究结果一致,他们发现随着桑椹提取物浓度的增加,其对亚铁离子的螯合能力增强。
2.3.3 DPPH自由基清除能力

图4 发酵和加工对桑椹DPPH自由基清除能力的影响Fig. 4 Effect of fermentation and processing on DPPH free radical scavenging capacity of mulberry
由图4A可知,MP、FM、D(FM)、D(FM+S)以及Trolox都有清除DPPH自由基的能力,且清除率随着样品质量浓度的增大而增强,与刘丹等[33]的报道一致。D(FM)和D(FM+S)的质量浓度-DPPH清除率曲线几乎重合,说明两者的清除能力相当,但明显高于同质量浓度的FM和MP。图4B表明,D(FM)和D(FM+S)的IC50分别为2.23 mg/mL和2.32 mg/mL,两者没有显著性差异(P>0.05);MP和FM的IC50分别为3.40 mg/mL和6.07 mg/mL。由此可知,4 种样品对DPPH自由基的清除能力强弱依次为:D(FM)>D(FM+S)>MP>FM。因此,发酵桑椹冻干粉清除DPPH自由基的能力强于未发酵的MP和FM。
2.3.4 羟自由基的清除能力
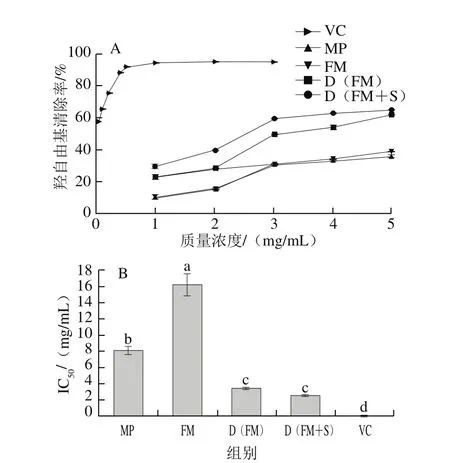
羟自由基具有极强的得电子能力即氧化能力,而桑椹活性成分中具有巯基、酚羟基等给电子基团,可与羟自由基发生氧化还原反应,从而将其清除。由图5可知,随着样品质量浓度的增大,其对羟自由基的清除率呈上升趋势,且存在剂量依赖性。江岩等[34]进行了药桑花青素的体外抗氧化实验,结果表明药桑对羟自由基的清除能力与其剂量呈正相关,与本研究结果一致。当D(FM+S)质量浓度为3 mg/mL时清除率已经大于50%;D(FM)质量浓度为4 mg/mL时清除率大于50%,效果都优于MP和FM。同时,MP、FM、D(FM)、D(FM+S)的IC50分别为8.13、16.24、3.46、2.54 mg/mL,具有明显差异。由此可知,D(FM+S)对羟自由基的清除能力最强,其次是D(FM),FM最弱,且都低于对照VC。所以,发酵桑椹冻干粉清除羟自由基的能力强于未发酵的MP和FM。
由以上实验结果可知,与未发酵的MP比较,发酵后其抗氧化能力下降,冷冻干燥处理后其抗氧化能力提高,原因可能与其总酚、总黄酮、花青素等活性物质含量有关[35]。桑椹发酵时会产生代谢物,与花青素产生反应,将花青素转化为其他大分子物质;同时,发酵也会改变其总酚、总黄酮等活性物质的含量,导致其抗氧化能力发生变化[36-37]。曹伟等研究证实,桑椹发酵后花青素含量、DPPH自由基清除率和亚铁离子螯合率都略微降低[36]。MP是通过烘干的方式得到的,而D(FM)的干燥方式是冷冻干燥,相比于普通的烘干方式,冷冻干燥更能保护桑椹粉总酚、总黄酮等活性物质,降低干燥过程中的活性成分的降解,从而使其抗氧化能力提高[38-40]。因此,发酵桑椹经冷冻干燥的抗氧化能力强于未发酵的MP和FM。
2.4 发酵和加工对桑椹α-葡萄糖苷酶抑制能力的影响
α-葡萄糖苷酶可以将机体摄入的碳水化合物分解成葡萄糖,而其抑制剂可以通过抑制α-葡萄糖苷酶的活性,减少葡萄糖的生成,稳定机体的血糖水平,减少糖尿病的发生[41]。

图6 发酵和加工对桑椹α-葡萄糖苷酶抑制能力的影响Fig. 6 Effect of fermentation and processing on α-glucosidase inhibitory activity of mulberry
图6 结果显示,MP、FM、D(FM)、D(FM+S)对α-葡萄糖苷酶都有一定的抑制作用,且随着样品质量浓度的增加而增大。已有研究表明桑椹具有抑制α-葡萄糖苷酶的作用,其抑制效果与质量浓度存在剂量依赖关系[42],与本研究结果一致。从图6A中可以看到,样品在同一质量浓度下对α-葡萄糖苷酶的抑制作用从强到弱顺序依次为:D(FM)>D(FM+S)>FM>MP。当质量浓度为5 mg/mL时,这4 种样品对α-葡萄糖苷酶的抑制率分别为91.24%、86.94%、84.44%、83.35%,都超过80%,效果较好。从图6B中可以看出,MP和FM对α-葡萄糖苷酶的IC50分别为0.58 mg/mL和0.53 mg/mL,两者没有显著性差异(P>0.05)。而D(FM)和D(FM+S)的IC50分别为0.19 mg/mL和0.31 mg/mL,差异不显著(P>0.05),但均显著高于MP和FM(P<0.05)。结果表明,发酵桑椹冻干粉对α-葡萄糖苷酶有较好的抑制效果,明显优于未发酵的MP和FM。据报道,样品的α-葡萄糖苷酶的抑制效果越强,其降血糖效果越好[43-47],因此,发酵桑椹冻干粉对α-葡萄糖苷酶的抑制效果比未发酵的MP和FM好,说明发酵桑椹冻干粉具有更好地降血糖效果。
3 结 论
桑椹经发酵、冷冻干燥处理后,碳水化合物基本被脱除,但是冷冻干燥处理会使发酵桑椹中的部分益生菌失活;而黄豆的添加可以减少冷冻干燥过程中益生菌的损失,起到保护益生菌的作用。发酵桑椹冻干粉对ABTS阳离子自由基、DPPH自由基、羟自由基的清除能力和亚铁离子螯合能力、α-葡萄糖苷酶的抑制能力都比未发酵的MP和FM强,说明发酵桑椹冻干粉的抗氧化和降血糖能力较强。

