SiO2@TiO2复合材料分离富集酪蛋白磷酸肽
刘真真,李 荣,*,汤书华,黄贤勇,张万晶,李勇杰,姜子涛,2,*
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津天狮学院食品工程学院,天津 301700)
TiO2作为一种新型的分离分析材料,具有机械强度高、酸碱稳定性好等优点[1],对碱性化合物没有不可逆吸附[2-3],且对磷酸肽等具有较好的选择吸附作用[4],在分离分析中具有良好的应用前景,但是比表面积小、孔径分布不均和孔径小等方面的缺点大大限制了作为介孔材料的TiO2在色谱填料以及固相萃取(solid phase extraction,SPE)方面的应用[5]。将TiO2与具有大比表面积的材料复合是改善其比表面积的有效途径,层层自组装法(layer-by-layer,LBL)便是其中的方法之一[6-7]。LBL是利用静电作用力将电负性不同的带电粒子进行结合。研究结果表明,通过LBL合成的核壳型复合材料在生物工程学[8]、电磁信息转化[9]以及表面工程[10]等方面应用广泛,在SPE方面的应用还有待拓展。
酪蛋白磷酸肽(casein phosphopeptides,CPPs)是一种经单一或复合蛋白酶水解牛乳酪蛋白得到的含有磷酸丝氨酸基团的生物活性多肽[11-12]。在碱性条件下,CPPs可防止钙、铁等离子的沉淀,从而促进其吸收,因此CPPs被称为“矿物质载体”[13-16]。现今已有报道的关于CPPs富集的方法主要包括:免疫沉淀法、固定金属离子亲和色谱法、金属氧化物亲和色谱法[17]及强阴阳离子交换色谱法[18]。免疫沉淀法由于成本高,对于分子质量低的磷酸化丝氨酸和苏氨酸并不适用,目前多应用于从小规模的细胞提取物中进行酪氨酸磷酸蛋白的富集[19]。固定金属离子亲和色谱法是通过带正电的金属离子与带负电的磷酸基团产生静电交互作用而结合来富集磷酸肽,但这种结合能力在高pH值或磷酸盐存在的缓冲液中会被破坏,磷酸化肽会被释放出来[20]。强阴阳离子交换色谱法因其对样品需求量大、工作量大而应用受限[21]。金属氧化物亲和色谱法不仅可以快速、高效地富集磷酸肽,而且其金属氧化物(如TiO2)大多具有很好的化学稳定性,故而广泛应用于磷酸肽富集研究,发展迅速[22]。
本研究利用LBL技术,合成了具有高比表面积、多孔结构的SiO2@TiO2核壳型复合材料,并用于样品中CPPs的分离富集。通过高效液相色谱(high performance liquid chromatography,HPLC)和液相色谱-四极杆-飞行时间质谱(liquid chromatography-quadrupole-time of flight mass spectrometry,LC-Q-TOF-MS)等手段对CPPs进行结构鉴定,采用内标法对CPPs进行定量分析。本研究旨在为食品、药品中CPPs(特别是低丰度)成分的分离分析提供一个行之有效的途径。
1 材料与方法
1.1 材料与试剂
氨糖软骨素钙片和婴儿配方奶粉样品,购自于天津市内大型购物超市。
CPPs样品 天津百奥泰科技发展有限公司;甲醇、乙腈(色谱纯) 美国Sigma-Aldrich公司;SiO2填料(Davisil硅胶,粒径16~24 μm,孔径15 nm,比表面积289 m2/g) 美国格雷斯公司;异丙氧基钛(Ti(OPri)4)安徽省泰昌化工试剂有限公司;十二烷基硫酸钠(sodium lauryl sulfate,SDS)、氨水、氢氧化钠、盐酸天津市科密欧化学试剂有限公司;氟化铵 天津市光复精细化工研究所。
1.2 仪器与设备
6520 Q-TOF-MS、1200系列HPLC仪 美国Agilent公司;JEOL场发射扫描电子显微镜(scanning electron microscope,SEM)(配有电子能谱(energy dispersive spectrometry,EDS)附件) 日本电子株式会社;HGC数控SPE仪 上海禾工科学仪器有限公司;F-Sorb 3400全自动比表面积及孔径测试仪 北京金埃谱科技有限公司;TSX1200紫外分光光度计 西尼特(北京)有限公司;H2050R-1医用离心机 长沙湘仪离心机仪器有限公司。
1.3 方法
1.3.1 SiO2@TiO2复合材料的制备及表征
SiO2@TiO2复合材料参照文献[23-26]的方法制备并适当改进,具体制备流程如下:
1)SiO2的活化:称取2 g的SiO2填料放于100 mL三角瓶中,按照10 mL/g的比例向其中加入1 mol/L HCl溶液,45 ℃超声30 min后转移至恒温振荡器中,45 ℃恒温振荡12 h,然后进行抽滤,沉淀用去离子水洗至中性,80 ℃真空干燥4 h,冷至室温,即得到活化后的SiO2;2)有机分子膜组装:将活化后的SiO2浸入到100 mL浓度为0.05 mol/L的SDS溶液中,超声30 min,抽滤、蒸馏水洗涤,除去未吸附的SDS,80 ℃真空干燥5 h后冷至室温,得到SiO2@SDS;3)TiO2的组装:将SiO2@SDS浸入TiO2溶胶中(该溶胶按照文献[2]的方法制得),在温度为15 ℃条件下,恒温磁力搅拌3 h,静置陈化12 h,离心去除上清液,用无水乙醇洗涤3 次,80 ℃真空干燥5 h后冷至室温,得到SiO2@SDS@TiO2复合材料;4)多层复合材料组装:将步骤3)中得到的SiO2@SDS@TiO2复合材料浸入到100 mL 0.05 mol/L SDS溶液中,之后重复步骤2)、3)的操作,即可制备包覆多层的SiO2/SDS/TiO2复合材料;5)SiO2@SDS@TiO2复合材料煅烧:将所制备SiO2@SDS@TiO2复合材料置于马弗炉中煅烧,以0.5 ℃/min升温速率升温至350 ℃并维持3 h,除去复合材料中的有机物,即可制备出SiO2@TiO2复合材料。
通过改变TiO2溶胶与SiO2的比例、陈化时间、包覆层数和煅烧温度等的单因素试验,确定采用LBL法制备SiO2@TiO2核壳型复合材料的最佳条件。对所制备的SiO2@TiO2复合材料,采用SEM、EDS进行表征,并利用氮吸附-脱附法(Brunauer-Emmett-Teller,BET)测定所制备的SiO2@TiO2复合材料的比表面积及孔径。
1.3.2 SiO2@TiO2复合材料SPE柱的制备与对CPPs的富集
1.3.2.1 配制1.0 mg/mL的CPPs样品液
称取0.100 0 g CPPs样品粉末置于烧杯中,加1.5 mL 0.1 mol/L NaOH溶液,在超声条件下使之溶解,然后将溶液转入100 mL容量瓶中,超纯水定容至刻度。
1.3.2.2 SPE柱填装及预处理
首先在SPE柱底端装入聚丙烯筛板,再称取2.0 g的SiO2@TiO2复合材料填装于3 mL SPE柱内,之后在SPE柱顶部装入聚丙烯筛板。接着将SPE柱安装在数控SPE仪上,对SiO2@TiO2复合材料进行预处理,预处理的具体方法为:先用0.1 mol/L的NaOH溶液对SPE柱进行淋洗,并用超纯水洗涤至中性;然后用0.1 mol/L HCl溶液对SPE柱进行淋洗,再用超纯水洗涤至中性;最后用甲醇淋洗。以上活化过程均在0.5 mL/min流速下进行。
1.3.2.3 CPPs的富集
将SPE仪的流速设定为0.2 mL/min。向SPE柱中加入1.0 mg/mL的CPPs溶液,收集24 min(约2 倍柱床体积)流出液并标记;然后用超纯水淋洗SPE柱,收集淋洗液并标记,再用0.3 mol/L的氨水进行洗脱,收集24 min洗脱液并标记,并将流出液、淋洗液及洗脱液于冰箱中4 ℃保存,在进行HPLC和LC-Q-TOF-MS分析之前,需经0.22 μm滤膜过滤。
1.3.3 CPPs吸附率及解吸率的测定
将1.3.2.3节得到CPPs样品液原液、流出液及洗脱液进行HPLC分析,HPLC条件参照文献[27]并加以改进,流动相为甲醇、20 mmol/L氟化铵体积比7∶93;柱温为45 ℃;等度洗脱,流速为0.8 mL/min;检测波长为280 nm;色谱柱为Vydac 218TP C18色谱柱(250 mm×4.6 mm,5 μm)。
利用原液中CPPs的峰面积与质量浓度之比等于洗脱液中CPPs的峰面积与质量浓度之比,求出洗脱液中CPPs的质量浓度,以此类推可分别计算出流出液、洗脱液中CPPs的质量浓度,再按公式(1)、(2)求算出SPE柱对CPPs的吸附率与解吸率。
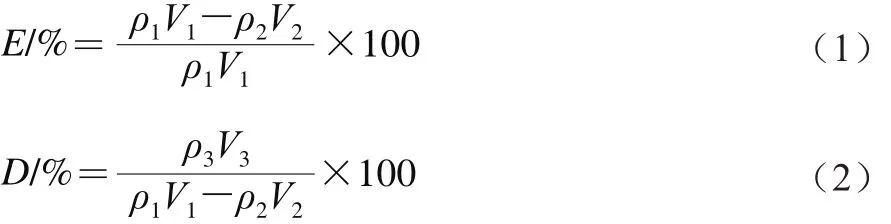
式中:E表示吸附率;ρ1、ρ2、ρ3分别表示样品液、流出液、洗脱液中的CPPs质量浓度/(mg/mL);V1、V2、V3分别表示样品液、流出液、洗脱液的上样体积/mL;D表示解吸率。
1.3.4 LC-Q-TOF-MS对富集后的CPPs结构的分析鉴定
LC条件:Vydac 218TP C18色谱柱(250 mm×4.6 mm,5 μm);流动相为体积分数15%乙腈水溶液,采用等度洗脱的方式进行;柱温45 ℃;流速0.3 mL/min;进样量5 μL。MS条件:电喷雾离子源;正离子模式;离子源温度:350 ℃;雾化气流速:10 L/min;喷雾器压力:30 psig;电压:175 V;透镜:65 V;离子喷雾电压:4 000 V;一级MS质荷比范围:m/z 60~3 200;二级MS碰撞能量数据设置见表1;检测范围:m/z 50~3 000;母离子优选价态:2、3、大于3。所得信息利用Mascot软件进行检索,鉴定匹配肽链中的氨基酸链接顺序。
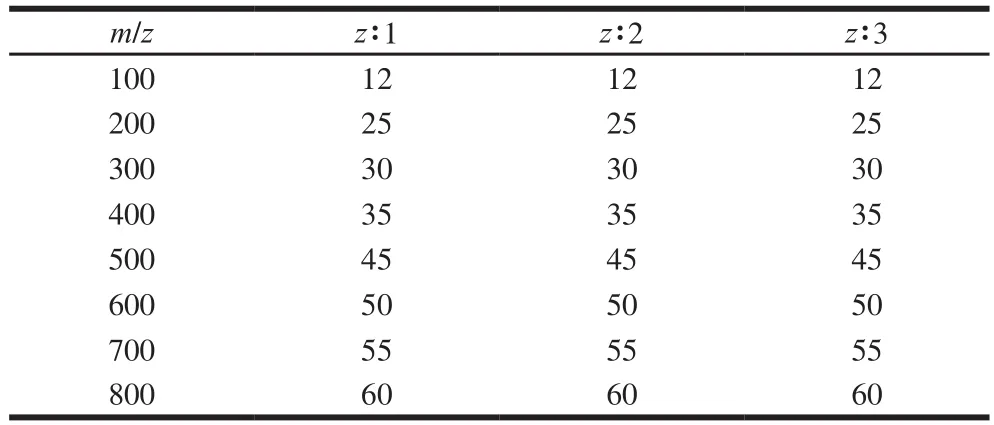
表1 二级MS碰撞能量设置Table 1 Collision energy setting of tandem mass spectrometry
1.3.5 内标法测定样品中CPPs的含量
1.3.5.1 内标工作曲线的制作
采用内标法测定CPPs的含量,选择茶碱作为内标物。配制1.0 mg/mL茶碱标准液,经天津市食品生物技术重点实验室自制SiO2@TiO2复合材料填装的SPE柱富集后得到茶碱的洗脱液,将洗脱液分别稀释50、100、200、300、400、500 倍体积,得到一系列质量浓度的茶碱标准液。再取1.0 mg/mL CPPs样品洗脱液分别加入到1.0 mL一系列质量浓度的茶碱标准液中,混合,过0.45 μm的滤膜,然后进行HPLC分析。据公式(3)计算出不同稀释倍数的茶碱洗脱液中茶碱的质量,以茶碱质量为横坐标,以茶碱与CPPs的峰面积之比为纵坐标,得到内标工作曲线。

式中:m表示茶碱的质量/µg;ρ表示茶碱的质量浓度/(mg/mL);V表示加入的茶碱的体积/mL;E表示SPE柱的吸附率/%;D表示SPE柱的解吸率/%;n表示稀释倍数。
1.3.5.2 样品前处理
对于CPPs样品,依照1.3.2.1节的方法制成1.0 mg/mL的样品溶液。对于钙片和奶粉样品,前者需用研钵研磨成约40 目的粉末,后者可直接使用。分别称取0.500 0 g粉碎后的钙片或奶粉样品,加适量0.1 mol/L NaOH超声溶解,然后加入超纯水后继续超声10 min,抽滤后取滤液进行离心,将上清液转入100 mL容量瓶,超纯水定容并摇匀,得到5.0 mg/mL钙片及奶粉的样品溶液。依照1.3.2.3节的方法将配制好的样品液上样,富集其中的CPPs,再按1.3.3节的HPLC条件将样品富集前的原液及富集后的洗脱液分别进样。
1.3.5.3 CPPs成分含量的测定
采用文献[28]的方法,并据公式(4)计算CPPs的质量,据公式(5)计算出样品中CPPs的含量。

式中:ms表示洗脱液中CPPs成分的质量/µg;mi表示茶碱的质量/µg;fs表示洗脱液中CPPs的绝对校正因子;As表示洗脱液中CPPs的峰面积;fi表示茶碱的绝对校正因子;Ai表示茶碱的峰面积;ω表示样品中CPPs的含量/(µg/mg);ρ样表示上样液的质量浓度/(mg/mL);V样表示上样液的体积/mL;E表示SPE柱的吸附率/%;D表示SPE柱的解吸率/%。
1.4 数据处理与分析
采用SPSS 16.0软件对实验数据进行单因素方差分析,用Origin 8.5软件对实验数据作图。
2 结果与分析
2.1 SiO2@TiO2复合材料的表征
2.1.1 SiO2@TiO2复合材料的SEM和EDS表征
从图1可以看出,内核材料SiO2在包覆前表面是光滑的,当TiO2纳米粒子沉积在其表面即被包覆后,SiO2表面变得粗糙,且随着包覆层数的增加,SiO2表面沉积的TiO2粒子逐渐增多,表面的粗糙程度也越大;当包覆层数达到8 层时,SiO2表面基本全部覆盖了TiO2粒子,之后再增加包覆层,表面变化不明显。
由图2可知,包覆层数由0 层增加到8 层时,硅元素的原子百分比从34.55%降至11.99%,钛元素的原子百分比从0%升至19.25%;当包覆层数由8 层增加到9 层时,硅元素的原子百分比从11.99%降至10.12%,钛元素的原子百分比从19.25%升至20.88%,变化趋于平稳。结合图1、2的结果可以证明包覆层数为8 层时包覆达到饱和。

图1 不同包覆层数的SiO2@TiO2复合材料的SEM图Fig. 1 Scanning electron microscope images of SiO2@TiO2 composite with different layers of TiO2 coating

图2 不同包覆层数的SiO2@TiO2复合材料的EDS分析结果Fig. 2 EDS images of SiO2@TiO2 composite with different layers of TiO2 coating
2.1.2 SiO2@TiO2复合材料的比表面积及孔径分析
用BET法对包覆8 层合成的SiO2@TiO2复合材料的比表面积及孔径进行测定,结果见图3。运用BET法测得的SiO2@TiO2复合材料比表面积为116.26 m2/g。根据SiO2@TiO2复合材料的BET等温线(图3A),结合BDDT吸附等温线理论可知,该材料的吸附特征及出现的毛细管凝结的现象均符合中孔结构的特点,从而说明了SiO2@TiO2复合材料具有多孔结构。从孔径分布(图3B)可以看出,SiO2@TiO2复合材料的孔径主要分布在2~13 nm范围内,平均孔直径为8.42 nm,分布较窄并且均匀。

图3 SiO2@TiO2复合材料的BET等温线(A)和孔径分布(B)Fig. 3 Nitrogen adsorption/desorption isotherms (A) and pore size distribution (B) of SiO2@TiO2 composite
2.2 SiO2@TiO2复合材料对CPPs的富集
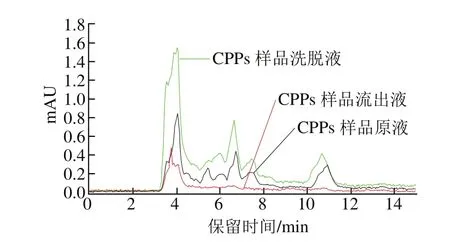
图4 CPPs样品富集前后的分析Fig. 4 Comparative elution profiles of original and enriched CPPs
由图4可知,流出液保留时间大于5 min时,没有明显的色谱峰出现,表明富集之后,样品中的CPPs基本被SiO2@TiO2复合材料吸附;而洗脱液保留时间在5 min之后的色谱峰响应值较原液增大了1~2 倍,SPE柱对CPPs的吸附率为93.0%,解吸率为81.5%,说明SiO2@TiO2复合材料对CPPs有较好的富集效果。
2.3 利用LC-Q-TOF-MS法鉴定CPPs的结构
从图5可以看出,所测定的CPPs样品液有5 个信号较高的色谱峰,此说明CPPs样品主要是由这5 种化合物构成的。
利用LC-Q-TOF-MS法对CPPs的结构进行了鉴定。在MS分析过程中,磷酸肽的稳定性比较差,由于碰撞诱导裂解,磷酸肽中性磷酸(如H3PO4、HPO3)易丢失[29-30]。其中,磷酸化的Ser和Thr易发生β消除,即丢失H3PO4分子,分子质量减小98 Da[31]。结合得到的离子碎片图和Mascot检索的结果,分析确定了洗脱液中的5 种CPPs,据总离子流图提取出每种CPPs对应的质核比以及每个质核比对应的二级MS碎片等具体参数(表2),各CPPs对应的断裂结构解析如图6所示,说明洗脱液中的5 个峰均为磷酸肽,可见SiO2@TiO2复合材料对CPPs具有非常好的富集作用。

图5 洗脱液总离子流图Fig. 5 Total ion current chromatogram of the eluent
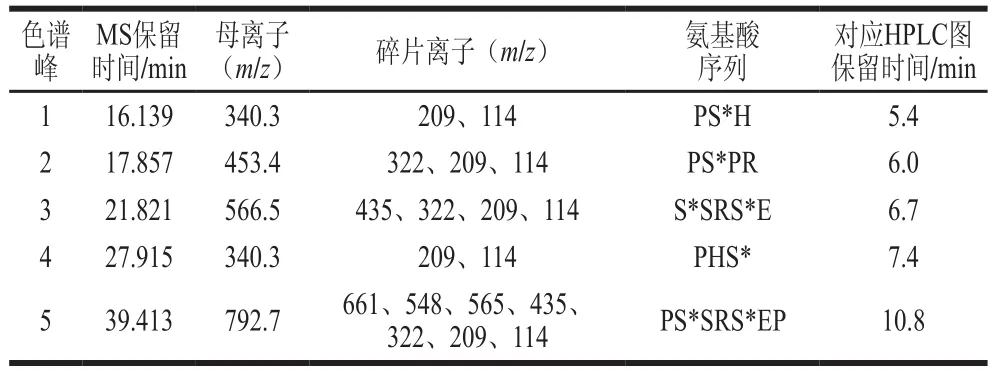
表2 主要的CPPsTable 2 Major components of CPPs

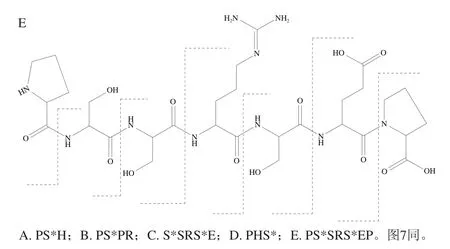
图6 CPPs的断裂结构解析Fig. 6 Fragmentation of CPPs
2.4 SiO2@TiO2复合材料富集CPPs的应用
2.4.1 工作曲线的制作
茶碱与5 种CPPs的工作曲线如图7所示,据工作曲线可以得出茶碱与每种CPPs对应的线性方程、决定系数R2以及相对校正因子(即组分与标准物质的绝对校正因子之比),如表3所示。

图7 内标工作曲线Fig. 7 Internal standard working curves
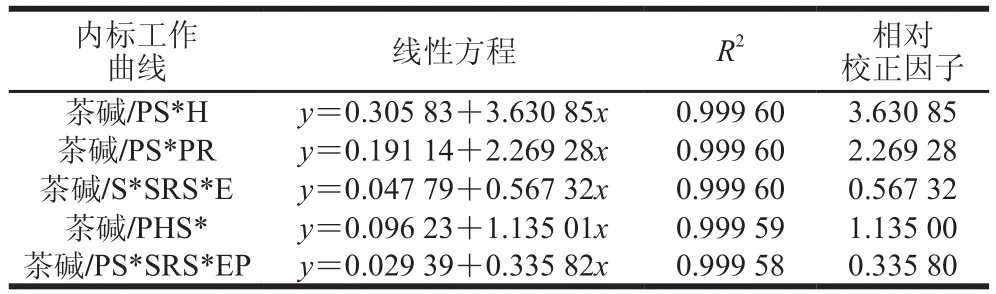
表3 内标工作曲线线性方程及相关参数Table 3 Linear equations with correlation coefficients and relative correction factors from internal standard working curves
2.4.2 样品的测定及加标回收率
由图8A可以看出,CPPs样品洗脱液在5 min后出现5 个响应值明显大于CPPs原液的峰,结合LC-Q-TOF-MS的结果可知,图8A中这5 个峰均为CPPs。由图8B可知,钙片样品洗脱液在保留时间分别为7.4 min和10.8 min时色谱峰响应值均明显大于钙片样品原液的色谱峰,这两个时间分别对应PHS*、PS*SRS*EP的保留时间,可以得出保留时间在7.4 min和10.8 min的成分均是钙片中的CPPs。由图8C可知,奶粉样品洗脱液在保留时间为7.4 min时色谱峰响应值大于奶粉样品原液,且与PHS*的保留时间一致,可以得出保留时间在7.4 min的成分是奶粉中的CPPs成分。图8中14.3 min处均为茶碱富集前后的色谱峰。
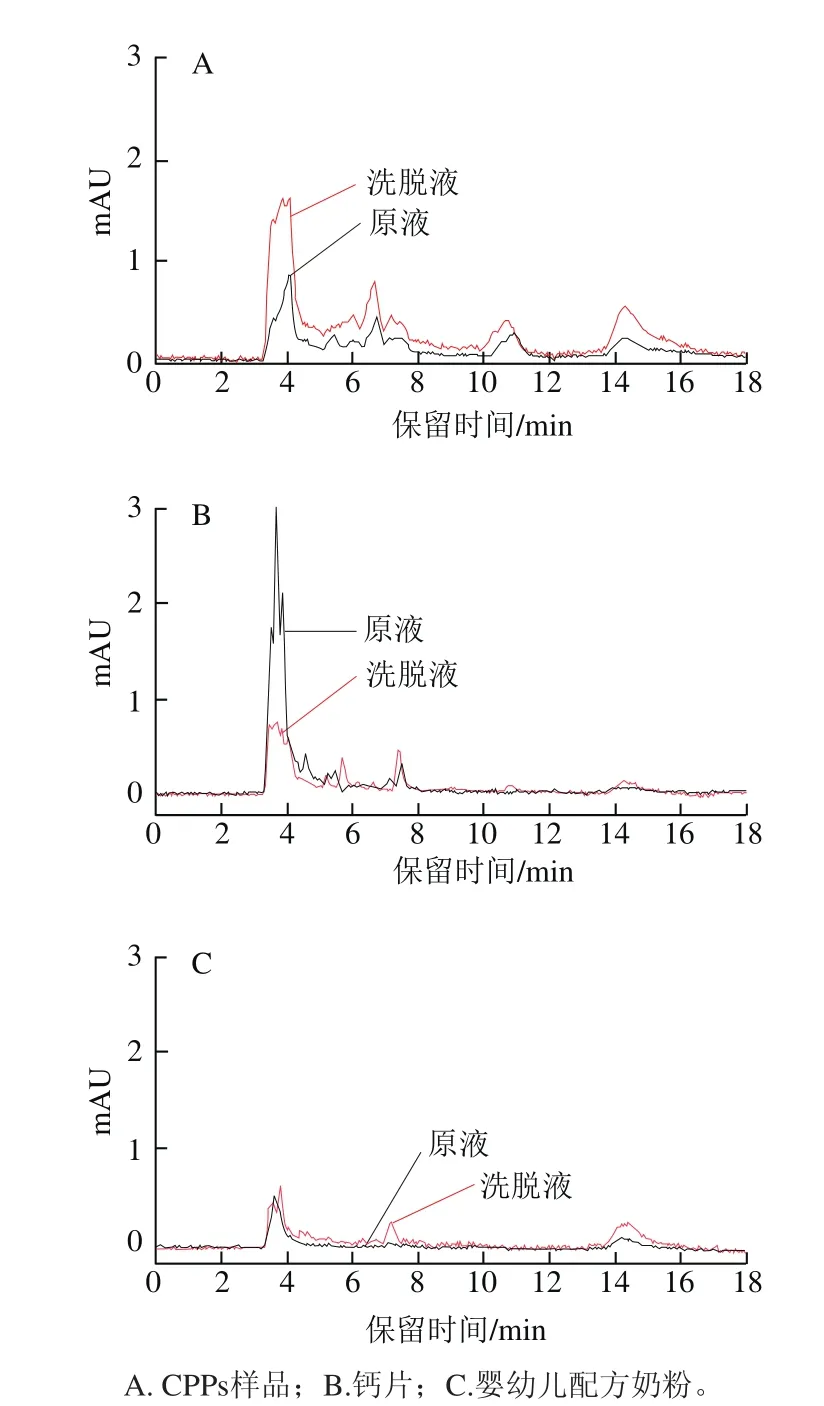
图8 样品富集前后的分析Fig. 8 Chromatograms of original and enriched CPPs from real samples
加标回收实验的结果如表4所示。CPPs样品、氨糖软骨素钙片和婴儿配方奶粉中CPPs的含量分别为2 676.3、174.6、38.7 mg/100 g,平均加标回收率分别为95.1%、94.4%和92.5%。加标回收实验结果说明,用茶碱作内标测定样品中CPPs含量的方法有良好的精密度和准确度。
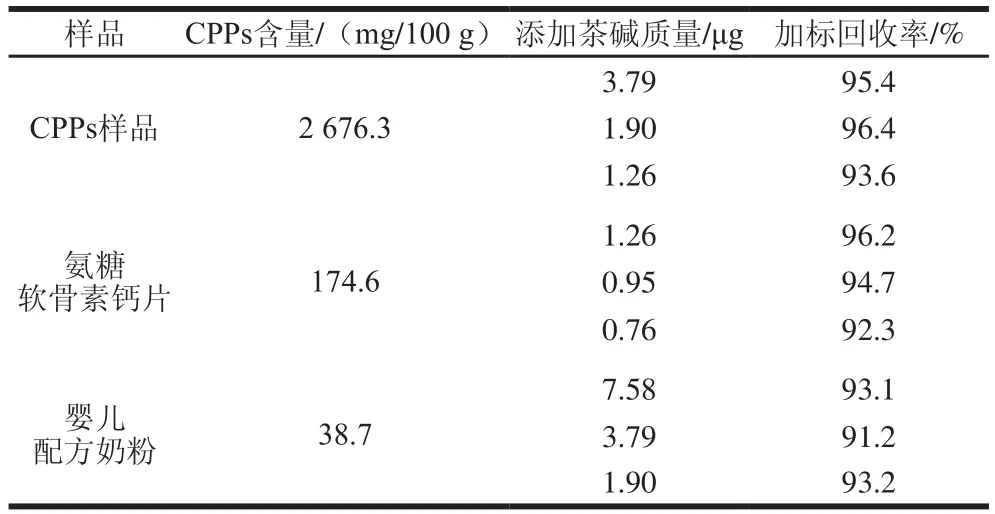
表4 样品中茶碱加标回收实验结果Table 4 Recoveries of CPPs from real samples spiked at different levels with the internal standard theophylline
3 结 论
本研究采用LBL法制备出了性能优良的SiO2@TiO2核壳型复合材料,在利用SiO2@TiO2复合材料填充的SPE柱富集磷酸肽的基础上,通过HPLC分析得到其对CPPs的吸附率为93.0%,解吸率为81.5%;又通过二级MS确定了CPPs样品洗脱液中的5 种磷酸肽成分,分别为PS*H、PS*PR、S*SRS*E、PHS*、PS*SRS*EP;同时建立了以茶碱为内标测定样品中CPPs含量的方法,结果表明制备的SiO2@TiO2复合材料对CPPs具有较理想的富集效果,内标法测定样品中CPPs的含量方法可靠。

