甲状腺自身抗体对放射性碘治疗甲状腺功能亢进症疗效的影响
陈燕云,吴乃君,邹英楠,金思彤,于鹏
(华北理工大学附属医院 内分泌科,河北 唐山 063000)
甲状腺功能亢进症(以下简称甲亢)是常见的一种自身免疫性疾病,其产生的多种自身抗体,可影响疾病的发生、发展、预后及转归。近年来,放射性碘(131I)治疗甲亢受到内分泌和核医学学界专家的关注,但关于甲亢患者体内不同抗体对131I 治疗后临床转归的研究甚少,且对此转归差异的原因及处理意见不尽相同。因此,本研究通过观察和比较甲亢患者治疗前不同甲状腺自身抗体与131I 治疗后临床转归的关系,为指导临床治疗甲亢提供理论依据。
1 资料与方法
1.1 一般资料
选取2016年7月—2017年4月华北理工大学附属医院收治的194 例经131I 治疗的甲亢患者作为研究对象。根据治疗前甲状腺自身抗体结果分为A 组[促甲状腺素受体抗体(TRAb)、甲状腺过氧化物酶抗体(TPOAb)均阴性)]19 例、B 组(TRAb 阳性、TPOAb 阴性)40 例、C 组(TRAb 阴性、TPOAb 阳性)26 例及D 组(TRAb、TPOAb 均阳性)109 例。A、B、C 及D 组平均年龄分别为(42.05±14.64)、(40.48±13.67)、(43.38±13.32) 及(38.93±10.70)岁。纳入标准:①符合甲亢诊断标准(葛均波等主编的8 版内科学中甲亢诊断标准);②131I 治疗甲亢1年; ③各种资料完整,签订知情同意书。排除标准:①不能如期随访;②妊娠哺乳。本研究通过本院伦理委员会批准,患者及其家属知情同意。
1.2 方法
1.2.1 样本标本采集 应用化学发光法及放射免疫测定研究对象晨起空腹静脉血清中促甲状腺激素(thyroid stimulating hormone,TSH)、血清游离三碘甲状腺原氨酸、血清游离甲状腺素、血清总三碘甲状腺原氨酸、血清总甲状腺素、TRAb 及TPOAb,治疗前及治疗后第1、3、6 及9 个月和1年各监测1 次。
1.2.2 临床转归判断 甲亢患者经131I 治疗后临床转归分为有效(甲状腺功能正常者、甲状腺功能减退者)和无效(甲状腺功能亢进者)。甲亢患者经131I 治疗后临床转归评价标准见《临床医疗指南》核医学分册[1]。
1.2.3 放射性碘的剂量131I 剂量(mci)=甲状腺重量(g)×每克甲状腺组织期望131I 的剂量(mci/g)/最高摄锝率(%),并根据医生触诊、甲状腺彩超结果及患者年龄等因素加减。
1.3 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析;计数资料以率(%)表示,比较用χ2检验,进一步两两比较用Post hoc testing 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 性别构成情况
A 组:男性4 例(9.52%),女性15 例(9.87%);B 组:男性9 例(21.43%),女性31 例(20.39%); C 组:男性5 例(11.91%),女性21 例(13.82%);D 组:男性24 例(57.14%),女性85 例(55.92%)。4 组性别构成比比较,差异无统计学意义(P>0.05)。
2.2 一般资料比较
4 组一般资料比较,差异无统计学意义(P>0.05)。见表1。
2.3 甲亢患者不同甲状腺自身抗体与131I 治疗后临床转归的关系
不同甲状腺自身抗体经131I 治疗后的临床转归不同(χ2=30.474,P=0.000)。经131I 治疗1年的甲亢患者总有效率可达80.4%,其中52.0%患者甲状腺功能降至正常,28.4%患者发展为甲减,19.6%患者仍为甲亢;A 组患者有效率达78.9%,其中68.4%患者甲状腺功能降至正常,10.5%患者发展为甲减,21.1%患者仍为甲亢;B 组患者有效率达55.0%,其中42.5%患者甲状腺功能降至正常,12.5%患者发展为甲减,45.0%患者仍为甲亢;C 组患者有效率达92.3%,其中42.3%患者甲状腺功能降至正常,50.0%患者发展为甲减,7.7%患者仍为甲亢;D 组患者有效率达87.1%,其中55.0%患者甲状腺功能降至正常,32.1%患者发展为甲减,12.8%患者仍为甲亢。不同甲状腺自身抗体甲亢患者经131I 治疗后临床转归中甲状腺功能正常发生率:A 组所占比例为12.9%,B 组所占比例为16.8%,C 组所占比例为10.9%,D 组所占比例为59.4%;甲减发生率:A 组所占比例为3.6%,B 组所占比例为9.1%,C 组所占比例为23.6%,D 组所占比例为63.6%;甲亢发生率:A 组所占比例为10.5%,B组所占比例为47.4%,C 组所占比例为5.3%,D 组所占比例为36.8%。见表2。
表1 4 组患者一般资料比较 (±s)
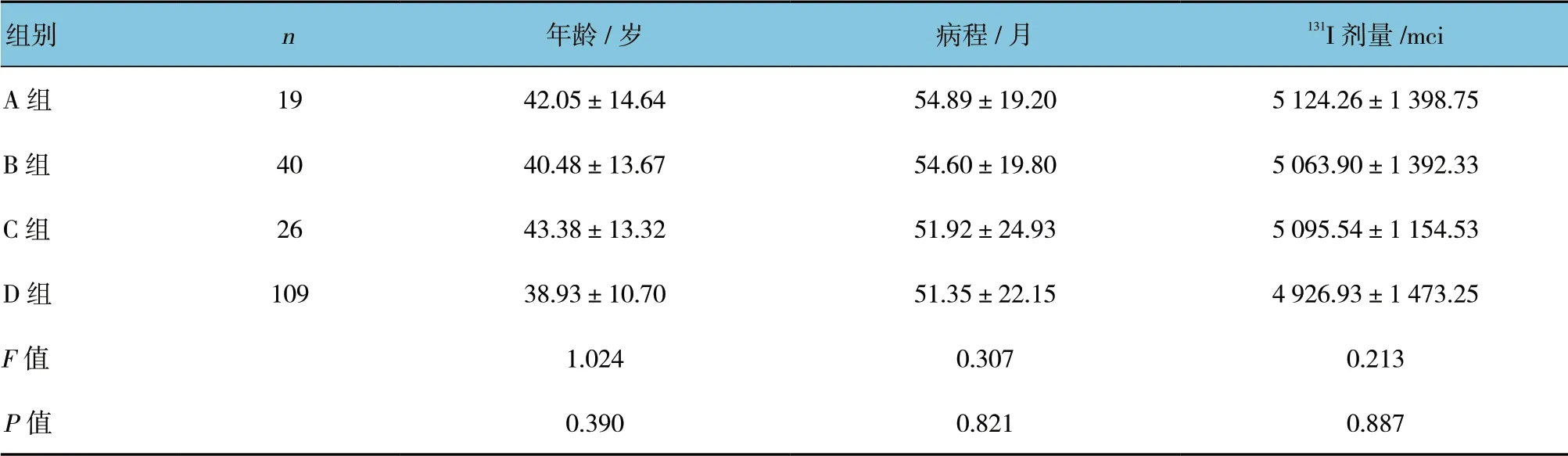
表1 4 组患者一般资料比较 (±s)
组别 n年龄/岁 病程/月 131I 剂量/mci A 组 19 42.05±14.64 54.89±19.20 5 124.26±1 398.75 B 组 40 40.48±13.67 54.60±19.80 5 063.90±1 392.33 C 组 26 43.38±13.32 51.92±24.93 5 095.54±1 154.53 D 组 109 38.93±10.70 51.35±22.15 4 926.93±1 473.25 F 值 1.024 0.307 0.213 P 值 0.390 0.821 0.887
本研究中,有4 个调整后标准化残差值>2,分别为B 组中甲减期望数比观测数大2 倍多,调整后标准化残差为-2.5,说明B 组治疗后不易发生甲减;B 组中观测数比期望数大2 倍多,调整后标准化残差为4.5,说明B 组治疗后易发生甲亢;C 组中甲减观测数比期望数大1 倍多,调整后标准化残差为2.6,说明C 组治疗后易发生甲减;D 组中甲亢期望数比观测数大1 倍多,调整后标准化残差为-2.7,说明D 组治疗后不易发生甲亢。4 组比较,差异有统计学意义(P<0.05)。见表3。
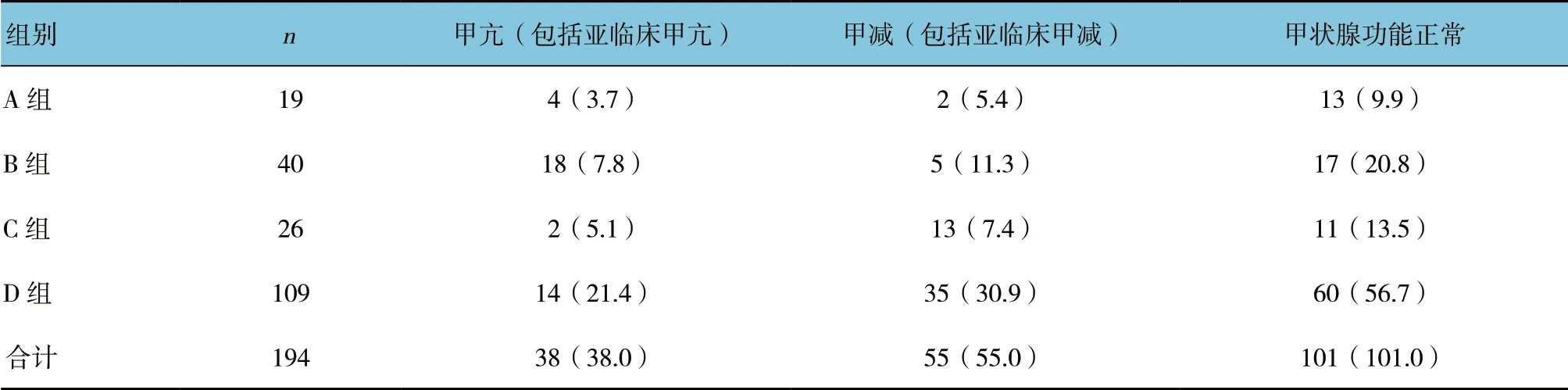
表2 4 组患者临床转归比较 例(%)
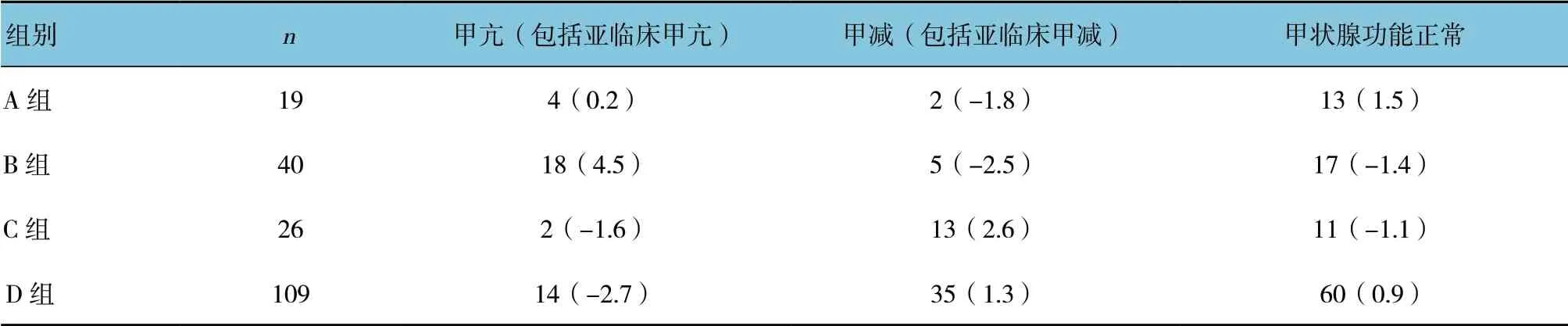
表3 4 组χ2 检验结果两两比较
3 讨论
越来越多的人因131I 安全、简单、高效、经济及副作用少等优点而选择其治疗甲亢。然而影响131I 治疗甲亢临床转归的因素很多,甲状腺自身抗体是其中之一。研究表明,抗体不同,疾病的发生、转归及131I治疗后预后亦不同[2]。
资料显示,甲亢患者经131I 治疗后有效率≥ 85%[3],本研究显示其有效率达80.4%,与此基本相符。
甲减是131I 治疗后无法避免的结果。阮舒[4]、高鹏霞[5]、林枫[6]、桂文来[7]等认为,TPOAb 阳性与131I治疗后甲减发生率有关。本研究通过分析得出,C 组TPOAb 阳性、TRAb 阴性的患者经131I 治疗后易发生甲减。另外,STRIGARI 等[8]认为TPOAb 阳性是131I治疗后甲减的危险因素,与本研究切合。TPOAb 可破坏甲状腺细胞,为甲状腺抑制性抗体,促进浆细胞和淋巴细胞浸润,是甲状腺损伤的危险因素[9-10],其致病机制为:①促进T 淋巴细胞活化;②细胞毒性;③补体依赖的细胞毒性作用;④抑制TPO 的活性,减少甲状腺激素的合成[11]。其产生甲减的原因可能是:TPOAb 阳性的患者治疗前已发生免疫损害,当131I 治疗时,已发生免疫损害的甲状腺滤泡组织更易受到β射线照射[12],诱发甲减;131I 可直接破坏部分甲状腺细胞,导致其裂解、凋亡,使其细胞内物质释放入血,刺激机体发生自身免疫,使机体产生过多TPOAb,再次杀伤未被131I 破坏的甲状腺滤泡组织(细胞毒性作用),引起过多的甲状腺滤泡细胞减少,导致甲减;131I也可损害甲状腺细胞内的线粒体[13],增加甲状腺滤泡细胞的凋亡、降低其增殖能力,致使甲状腺滤泡细胞减少,导致甲减;131I 破坏甲状腺使TSBAb 产生增多,而TSBAb 与TSH 受体结合造成TSH 与TSH 受体结合减少,致甲状腺萎缩、激素减少[14]。TPOAb 阳性、TRAb 阴性的甲亢患者为桥本甲亢的可能性大,其最终转归为甲减;部分患者对放射性碘较敏感。
TRAb 是Graves 病发病的主要致病因子[15-17]。研究表明,TRAb 阳性、TPOAb 阴性的甲亢患者治疗后无效率高。本研究得出B 组TRAb 阳性、TPOAb阴性的甲亢患者治疗后无效率高。其原因可能有:①TRAb 与甲状腺滤泡细胞膜上的TSHR 结合,通过信号通路cAMP 刺激甲状腺细胞增生,产生过量甲状腺激素,且不受T4、T3 的负反馈调节,导致甲亢[18]。131I 为对症治疗,主要在于控制甲状腺毒症而对TRAb无改善(病因),最终导致甲亢未愈或复发[19];另外,TSAb 与TSHR 结合,促进残余甲状腺细胞肥大、增生,分泌大量甲状腺激素导致甲亢复发[14]。②部分患者对放射性碘不敏感。
因此,甲亢患者治疗前TPOAb 阴性、TRAb 阳性者需酌情增加131I 的剂量,治疗后TRAb 由阳性转为阴性时,应预防甲减发生;治疗前TPOAb 阳性、TRAb阴性者需酌情减少131I 的剂量或选择其他治疗方法,当治疗后TRAb 有阴性转为阳性时,应预防甲亢复发。而抗体均阳或均阴的患者应用131I 治疗后应定期随 访[19],以便于及早发现疾病变化,并采取相应措施。
综上所述,治疗前监测甲状腺自身抗体不仅有助于指导是否应用131I 治疗,而且可以用于判断预后。

