甲氨蝶呤联合异环磷酰胺对骨肉瘤细胞系增殖和凋亡的影响
肖艳 丁婷
骨肉瘤是未成熟骨组织或恶性增生间质细胞产生的骨样组织构成的恶性肿瘤,多发生在20岁以下的儿童或青少年,占儿童肿瘤的5%,恶性程度高,危害严重,死亡率较高[1~3]。临床上,骨肉瘤的治疗主要以手术联合放化疗为主,但其对化疗和放疗敏感性较低,尚未有特效治疗方法,临床治疗效果欠佳。甲氨蝶呤(MTX)是国家批准的治疗骨肉瘤的一线化疗药,具有较好效果,但随着耐药现象的产生,其疗效也逐渐降低[4,5]。异环磷酰胺是1988年12月获美国FDA 批准主要适用于软组织肿瘤、睾丸肿瘤、恶性淋巴瘤、肺癌、乳腺癌、卵巢癌、子宫颈癌及儿童肿瘤的化疗药物[6,7]。本研究在体外实验中探讨甲氨蝶呤联合异环磷酰胺对骨肉瘤U2-OS 细胞增殖和凋亡的影响,现报道如下。
1 材料与方法
1.1 实验材料采用人骨肉瘤细胞系U2-OS,购买于中科院上海细胞库;甲氨蝶呤(MTX)、异环磷酰胺(IFO)均购自美国Sigma 公司,并按照说明书融于对应的液相中。DMEM 高糖培养基购买于Hyclone公司,胎牛血清购买于美国Gibco 公司,并使用DMEM 培养基和胎牛血清按照9∶1的比例配置成含10%血清的培养基以培养细胞。磺酰罗丹明(SRB)购买于Sigma 公司,Annexin V 凋亡试剂盒购买于赛默飞公司。
1.2 实验方法
1.2.1 细胞培养 U2-OS 细胞系使用含10%胎牛血清的DMEM 高糖培养基培养,培养条件为5%的CO2,温度37℃。细胞密度达到90%后按照1∶3 进行传代,一般情况下一周可传2~3 代。
1.2.2 SRB 法检测细胞增殖 分别使用MTX和IFO作用于U2-OS 细胞系,计算出U2-OS 细胞对MTX和IFO的半抑制浓度(IC50)值。然后按不同用药方法分为异环磷酰胺(IFO)组、甲氨蝶呤(MTX)组、甲氨蝶呤联合异环磷酰胺(MTX+IFO)组,IFO和MTX使用半抑制浓度值浓度,比较各组细胞的细胞活性并绘制生长曲线。具体实验方法:①收集对数生长期的骨肉瘤U2-OS 细胞,调整细胞悬液浓度并按照上述分组接种于96 孔板,每组设立3个复孔;②细胞培养24h 后,各组分别加入含有对应药物及浓度的培养基,组别周边使用PBS 进行封板,防止边缘效应产生;③细胞培养至预定时间后终止,每孔去上清液,并加入200µl 浓度为10%的三氯乙酸溶液(TCA),4℃固定50min;④使用蒸馏水连续洗板5次,室温晾干;⑤每孔加入100µl 磺酰罗丹明(SRB)染液,室温下染色30min;⑥弃染液,使用浓度为1%的冰乙酸洗板5次,确保洗去浮色后室温下避光晾干;⑦每孔加入150µl 浓度为10mM的Trisbase 溶液,室温条件下于摇床高速震荡15min,使孔内SRB染液结晶完全溶解;⑧使用酶标仪在波长为515nm处测定96 孔板各孔的OD 值。
1.2.3 凋亡实验 对数期U2-OS 细胞,用无血清培养基调整细胞悬液密度,分为对照组、IFO组、MTX组、MTX+IFO组,每组3个复孔。具体实验方法:①取1ml 上述细胞悬液,接种于6 孔板中,分别加入各组对应药物;②收集6 孔板各组细胞全部上清液和6 孔板贴壁细胞于5ml 离心管中,1 000g 离心5min,弃上清;③PBS 洗涤细胞1次,1 000g 离心5min,弃上清,用含1%胎牛血清DMEM 培养基调整细胞密度为5×105个/ml;④取100µl 细胞悬液于1.5ml EP 管中,加入凋亡试剂100µl,轻柔充分混匀,室温避光孵育30min;⑤300 目尼龙网滤过后,上机检测。
1.3 统计学分析所有数据均采用SPSS 17.0 统计学软件处理,计量资料以均数±标准差(±s)表示,采用独立样本t检验,以P<0.05 表示差异有统计学意义。实验数据使用GraphPad Prism 软件进行制图。
2 结果
2.1 MTX和IFO 作用于U2-OS 细胞的IC50MTX和IFO 均按照1mg/ml、5mg/ml、10mg/ml、20mg/ml、40mg/ml、80mg/ml 设置浓度梯度。实验发现,MTX 对U2-OS 细胞的IC50为(19.99±0.12)mg/ml,而IFO 对U2-OS 细胞的IC50为(32.07±0.69)mg/ml,见图1。
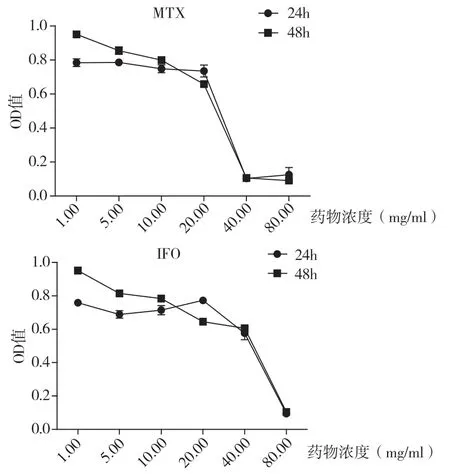
图1 MTX和IFO 抑制U2-OS 细胞增殖的IC50
2.2 MTX、IFO 及MTX 联合IFO 对U2-OS 细胞增殖的影响研究显示,MTX和IFO 均能抑制U2-OS细胞的增殖,且在16h、32h 及48h MTX的抑制效果优于IFO,差异有统计学意义(P<0.05),而当MTX和IFO 联合使用时,对细胞的抑制效果更为明显,与MTX组或IFO组比较,差异有统计学意义(P<0.05),见图2 及表1。
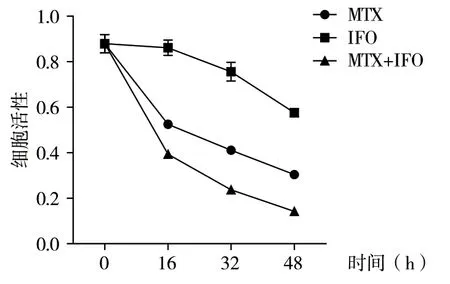
图2 MTX、IFO 及MTX+IFO 对细胞增殖的影响

表1 MTX、IFO 及MTX+IFO 对细胞增殖的影响
2.3 MTX、IFO 及MTX 联合IFO 对U2-OS 细胞凋亡的影响实验发现,骨肉瘤U2-OS 细胞的凋亡率为4.25%,使用MTX 处理后细胞凋亡率上升为9.1%,而使用IFO 后细胞凋亡率为6.5%,MTX组和IFO组细胞凋亡率较对照组均显著上升,且MTX组的凋亡率高于IFO组,差异有统计学意义(P<0.05);而MTX和IFO 联合作用后,细胞凋亡率上升为19.90%,较对照组、MTX组和IFO组均显著升高,差异有统计学意义(P<0.05),见图3。
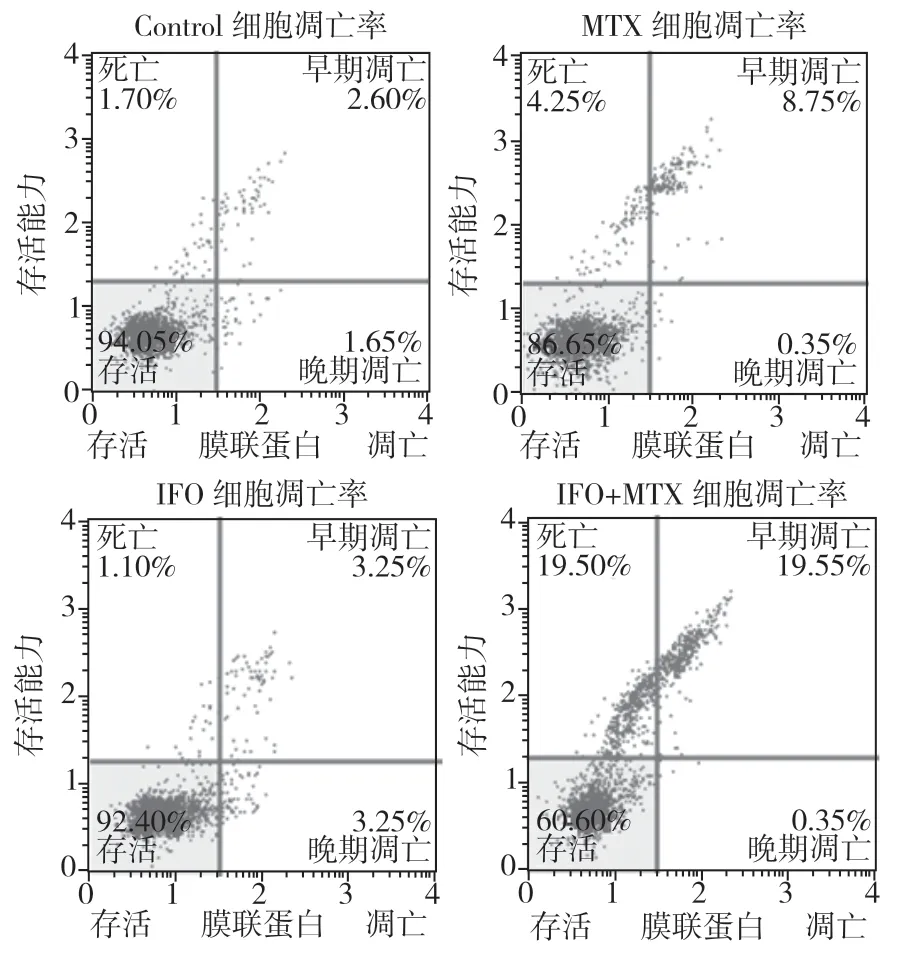
图3 MTX、IFO 及MTX+IFO 对U2-OS 细胞凋亡的影响
3 讨论
骨肉瘤是临床常见的骨科肿瘤,具有恶性程度高、致残率和死亡率高等特点,严重威胁患者的生命安全,骨肉瘤对放化疗敏感性较差,因此手术成为重要的治疗手段,但5年生存率低,转移复发率高[8~10]。随着医学水平的不断提高,化疗药物得到不断的发展,新辅助化疗也成为骨肉瘤手术治疗的有效补充,可明显提高患者5年生存率和生活 质量。
MTX与叶酸结构类似,是一种通过抑制二氢叶酸还原酶而发挥作用的抗叶酸类抗肿瘤药物,其作用机理为通过抑制二氢叶酸还原酶进而阻滞脱氧胸腺苷和嘌呤腺苷合成,干扰RNA和蛋白质合成,从而阻止细胞增殖,对白血病以及多种实体肿瘤都有较好的临床效果[11,12]。但临床MTX 单药使用需要较大剂量,在起到疗效的同时给患者带来肝功能损害、肾功能衰竭、骨髓抑制、胃肠道反应、感染等严重并发症,不仅影响疗效,严重者还会导致患者死亡[13]。因此,MTX 多与其他化疗药物联合使用,在制剂间的修饰作用、用药剂量、投药顺序等方面进行调整而组成的化疗方案在临床取得较好效果,MTX也成为我国一线抗肿瘤化疗药物[14,15]。IFO 是磷酰胺类的衍生物,是第4个用于骨肉瘤化疗的药物,自1988年被FAD 批准用于临床后,其抗肿瘤作用就得到广大医护人员的关注。IFO 对骨肉瘤有较好的临床疗效,且不良反应较轻,是一种治疗骨肉瘤的关键化疗药物,临床多用于对常规化疗失败的患者[16]。
目前,细胞增殖和凋亡在肿瘤形成过程中的重要作用已经得到普遍认可,细胞的恶性增殖和凋亡减少是肿瘤形成的重要原因。因此,化疗药物调控细胞的增殖和凋亡是近年来肿瘤研究的热点。王亚鹏等[17]研究证实,褪黑素联合顺铂、甲氨蝶呤在体外作用于骨肉瘤细胞,可有效增加细胞凋亡,抑制其增殖,从而起到抗肿瘤作用。王建军等[18]研究显示,IFO 对人骨肉瘤Saos-2 细胞株有抑制作用。本研究旨在探讨MTX和IFO 在体外对骨肉瘤细胞U2-OS增殖及凋亡的影响,以及二者联合使用的效果。研究证实,体外实验中MTX和IFO 对U2-OS 细胞都具有抗增殖和促凋亡作用,且MTX 作用更为明显,而当MTX 联合IFO 使用时,其抗增殖和促凋亡作用有较大幅度的提升,因而我们认为MTX和IFO 对U2-OS的增殖抑制和促进凋亡作用具有一定的协同作用,猜测这可能与二者对细胞凋亡或增殖相关信号通路有交叉影响有关,但具体的分子机制尚未阐明,还需要进一步研究。
综上所述,MTX和IFO 均可抑制骨肉瘤细胞U2-OS 细胞增殖并促进凋亡,而MTX的作用较IFO 更为明显;MTX和IFO 具有一定的协同作用,两者联合使用对U2-OS 细胞的增殖抑制和促凋亡作用更为显著。

