大叶白麻总黄酮中白麻苷的药代动力学研究
张娟 冯春艳 卿德刚
【摘 要】 目的:建立大鼠血浆中白麻苷的HPLC含量测定方法,借助该法考察白麻苷在大鼠体内的药代动力学特征。方法:XTARRA RP18色谱柱,乙腈-0.2%磷酸水溶液梯度洗脱,35℃,1mL/min,360nm检测。6只雄性SD大鼠灌胃给予1.05g/Kg的大叶白麻总黄酮,测定不同给药时间点,动物血浆中白麻苷的浓度,并对其药代动力学参数进行研究。结果:白麻苷在0.0606~19.4040mg/L的范围内线性关系良好(R=0.9996),低、中、高3个浓度样品的相对回收率分别为102.29%、92.95%、90.11%,日内RSD分别为1.53%、1.07%、3.62%,日间RSD分别为8.33%、3.56%、4.03%。大鼠灌胃大叶白麻总黄酮后,白麻苷在大鼠体内的代谢过程符合开放的二室模型,消除半衰期为474.13min。结论:白麻苷在大鼠体内能迅速分布,并且持续时间较长。
【关键词】 大叶白麻;白麻苷;HPLC;药代动力学
【中图分类号】R284 【文献标志码】 A【文章编号】1007-8517(2019)3-0024-05
Abstract:Objective To establish the content determination method of Quercetin-3-O-sophoroside in plasma, and study the pharmacokinetics feature of Quercetin-3-O-sophoroside in rats. Mehtods XTARRA RP18 column was gradient eluted by acetonitrile-0.2% phosphate solution at 35℃, 1mL/min,360nm. 6 rats were administrated with the purified total flavonoids from Poacynum hendersoniiat a dose of 1.05g/kg, the concentrations of Quercetin-3-O-sophoroside in rat plasma were determined at different administrated time, and calculated the pharmacokinetic parameters. Results Excellent linear relationship was obtained in the range of 0.0606~19.4040mg/L(R=0.9996), the relative recoveries of low, medium and high concentration samples were 102.29%,92.95% and 90.11%, the intra-day RSD were 1.53%,1.07% and 3.62% , the inter-day RSD were 8.33%,3.56% and 4.03%.Quercetin-3-O-sophoroside in rats was consistent with the open two-compartment model,the elimination half-life time was 474.13min. Conclusion Quercetin-3- O-sophoroside distributed quickly and existed for a long time in rats.
Keywords:Poacynum henderconii;Quercetin-3-O-sophoroside;HPLC; Pharmacokinetics
白麻属大叶白麻(Poacynum hendersonii Woodson)喜生于盐碱荒地、沙漠及戈壁荒滩等干旱地区,主要分布在新疆、青海、内蒙、甘肃等地区,其中新疆罗布泊、塔里木河、孔雀河畔及阿克苏地区有丰富的大叶白麻野生资源 [1-2]。《维吾尔药志》记载大叶白麻清热凉血、利尿消肿、行气凉肝、镇静安神,用于头晕、心悸、神经衰弱、高血压及肝硬化引起的腹水 [3]。有学者认为,大叶白麻和罗布麻药理活性相似,金丝桃苷、异槲皮苷、紫云英苷等黄酮类成分是二者的主要活性成分。然而,近年研究表明,二者在化学组成上有较大差异 [4-9],比如罗布麻中金丝桃苷、异槲皮苷、紫云英苷的含量均高于大叶白麻,并且二者特征成分不同,大叶白麻含白麻苷、芦丁、biapigenin和加贯叶金丝桃素,罗布麻则含querciturone、乙酰金丝桃苷、穗花衫双黄酮等成分 [8-10]。大叶白麻总黄酮由大叶白麻经乙醇提取、大孔树脂柱纯化制得,其抗炎活性优于罗布麻总黄酮 [11],白麻苷作为其主要成分含量达11.98%,另有研究报道白麻苷具有抗氧化、脑缺血保护等作用 [12-13]。因此,本实验以白麻苷为考察指标,研究大叶白麻总黄酮在大鼠体内的药代动力学特征,以期为大叶白麻的开发利用提供依据。
1 仪器与材料
1.1 仪器 U3000高效液相色谱仪(Thermo),MIKRO 220R冷冻离心机(Hettich),XH-C涡旋混合器(江苏金怡仪器科技有限公司),DT2012电子天平(余姚市金诺天平仪器有限公司),AB265-S分析天平(梅特勒-托利多公司),JY92-2D超聲波清洗仪(昆山市超声仪器有限公司)。
1.2 材料 白麻苷(批号:P09J6R1,上海源叶生物科技有限公司),大叶白麻(新疆),甲醇、乙腈为色谱纯(Sigma),超纯水(自制)。
1.3 动物 SPF级SD大鼠10只,雄性,体重为(200±20)g,新疆维吾尔自治区实验动物研究中心,生产许可证号:SCXK(新)2016-0001。
2 方法
2.1 大叶白麻总黄酮制备 大叶白麻用20倍60%乙醇回流提取2次,每次1.5h,合并2次提取液,浓缩至无醇,过大孔树脂柱,水洗除杂后,以3BV 60%乙醇溶液洗脱,收集洗脱液,浓缩、干燥,HPLC检测黄酮含量 [14]。
2.2 大鼠血浆中白麻苷的含量测定
2.2.1 色谱条件 色谱柱:XTARRA RP18(250mm×4.6mm,5μm);乙腈:0.2%磷酸水溶液梯度洗脱(0~10min,15%∶85%;10~50min,18%∶82%;50~65min,18%∶82%);柱温:35℃;流速:1mL/min;检测波长:360nm;进样量:100uL。
2.2.2 对照品溶液制备 精密称取白麻苷对照品适量,于10mL容量瓶中,用50%甲醇溶解并定容,制成浓度为97.0200mg/L的储备液。分别精密吸取储备液适量,用50%甲醇稀释,制成浓度为97.0200、48.5100、24.2550、19.4040、9.7020、4.8510、2.4255、1.2128、0.6064、0.3032mg/L的系列对照品溶液,4℃保存,备用。
2.2.3 血浆样品预处理 精密吸取大鼠血浆100μl,加入200μL甲醇沉淀蛋白,涡旋2min,13000r/min离心10min,取上清过0.22μm的微孔滤膜,即得。
2.2.4 专属性 将空白血浆、白麻苷添加血浆、灌胃大叶白麻纯化物后血浆,按“2.2.3”项下方法处理,按“2.2.1”项下色谱条件进样,考察方法专属性。
2.2.5 线性关系考察 精密吸取100μL大鼠空白血浆10份,于1.5mL的离心管中,分别加入25μL系列标准溶液,配制成白麻苷浓度为19.4040、9.7020、4.8510、3.8808、1.9404、0.9702、0.4851、0.2426、0.1213、0.0606mg/L的血浆样品,按“2.2.3”项下方法处理,按“2.2.1”项下色谱条件进样,以峰面积为纵坐标,血药浓度为横坐标,绘制标准曲线。
2.2.6 精密度实验制备 白麻苷浓度分别为0.4851、3.8808、19.4040mg/L的血浆样品(n=5),按“2.2.3”项下方法处理,按“2.2.1”项下色谱条件进样,连续3d,分别计算日内RSD和日间RSD。
2.2.7 准确度实验制备 白麻苷浓度分别为0.4851、3.8808、19.4040mg/L的血浆样品(n=5),按“2.2.3”项下方法处理,按“2.2.1”项下色谱条件进样,以标准曲线计算浓度和相对回收率。
相对回收率=测定量/实际添加量
2.2.8 基质效应和提取回收率实验 制备白麻苷浓度分别为0.4851、3.8808、19.404mg/L的血浆样品(n=5),按“2.2.3”项下方法处理,按“2.1.1”项下色谱条件进样,峰面积为SET3。取空白血浆,按“2.2.3”项下方法处理,取上清液后加入对照品溶液,使其浓度与SET3一致(n=5),按“2.2.1”项下色谱条件进样,峰面积作为SET2。将对照品溶液用50%甲醇溶液稀释,使其浓度与SET3一致,按“2.2.1”项下色谱条件进样,重复5次,峰面积作为SET1。
基质效应=SET2/SET1提取回收率=SET3/SET2
2.2.9 稳定性实验 制备白麻苷浓度分别为0.4851、3.8808、19.4040mg/L的血浆样品(n=3),室温下放置24h后测定,考察短时稳定性。于-20℃冰冻30d后取出后测定,考察长期稳定性。
2.3 药代动力学实验 雄性SD大鼠10只,灌胃给药前禁食不禁水。4只大鼠作为空白,6只大鼠灌胃大叶白麻总黄酮(1.05g/kg,按白麻苷折算给药剂量为125.79mg/kg),灌胃体积10mL/kg,于给药前后0、5、10、20、30、45min、1、2、3、4、6、8、12h眼眶后静脉丛取血0.5mL,置于1.5mL已肝素化的离心管中,13000r/min离心10min,分离得到血浆,-20℃保存。
2.4 数据处理 数据均用Excel处理,表示为(x±s),药动学参数采用 PK solution 2.0TM(Summit Research Services,USA)药代动力学软件分析。
3 结果
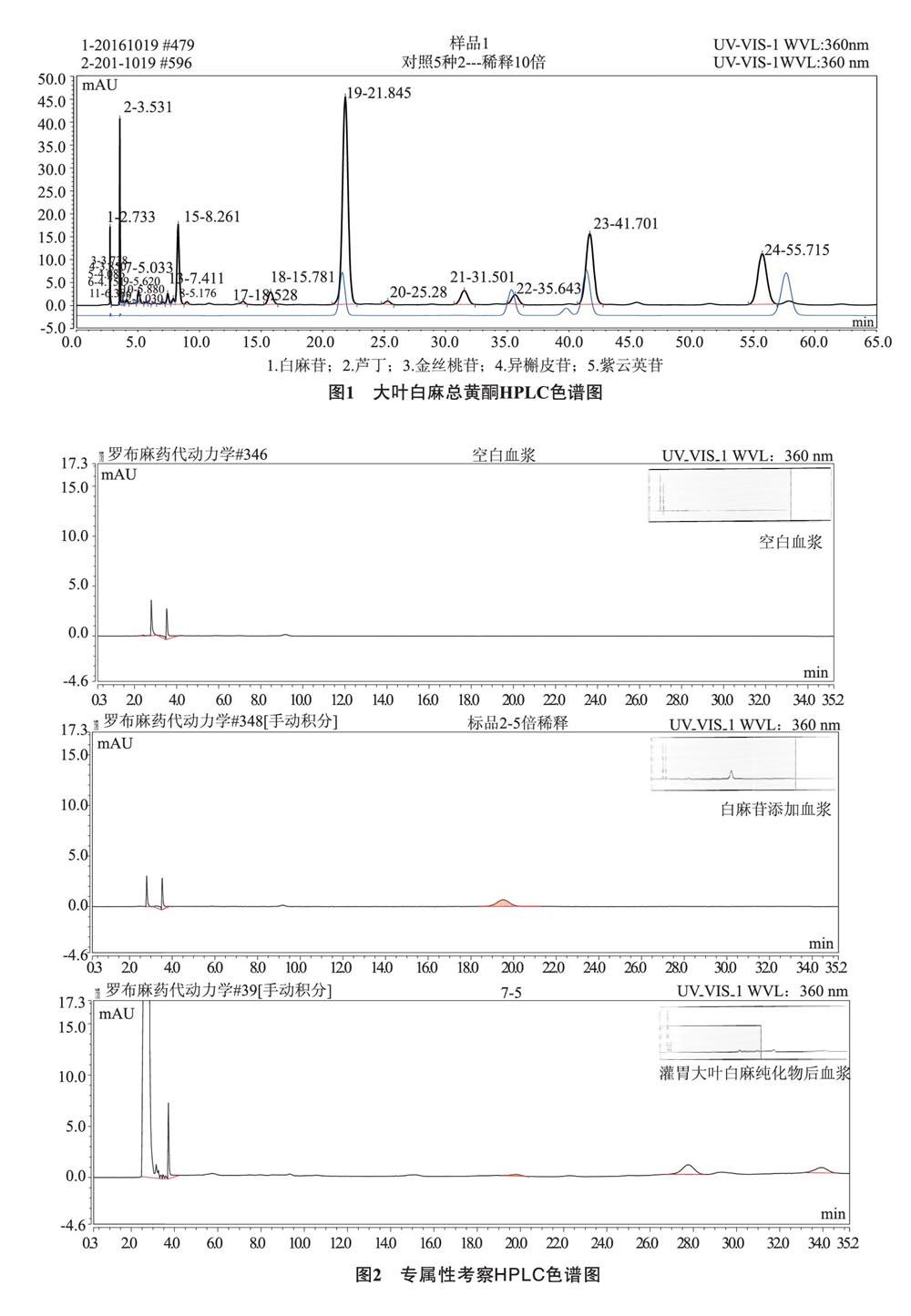
3.1 大叶白麻总黄酮含量测定 HPLC检测,大叶白麻总黄酮中白麻苷、异槲皮苷、紫云英苷、芦丁和金丝桃苷的含量分别为11.98%、7.44%、0.67%、0.30%和0.14%。如图1所示。
3.2 大鼠血浆中白麻苷的含量测定
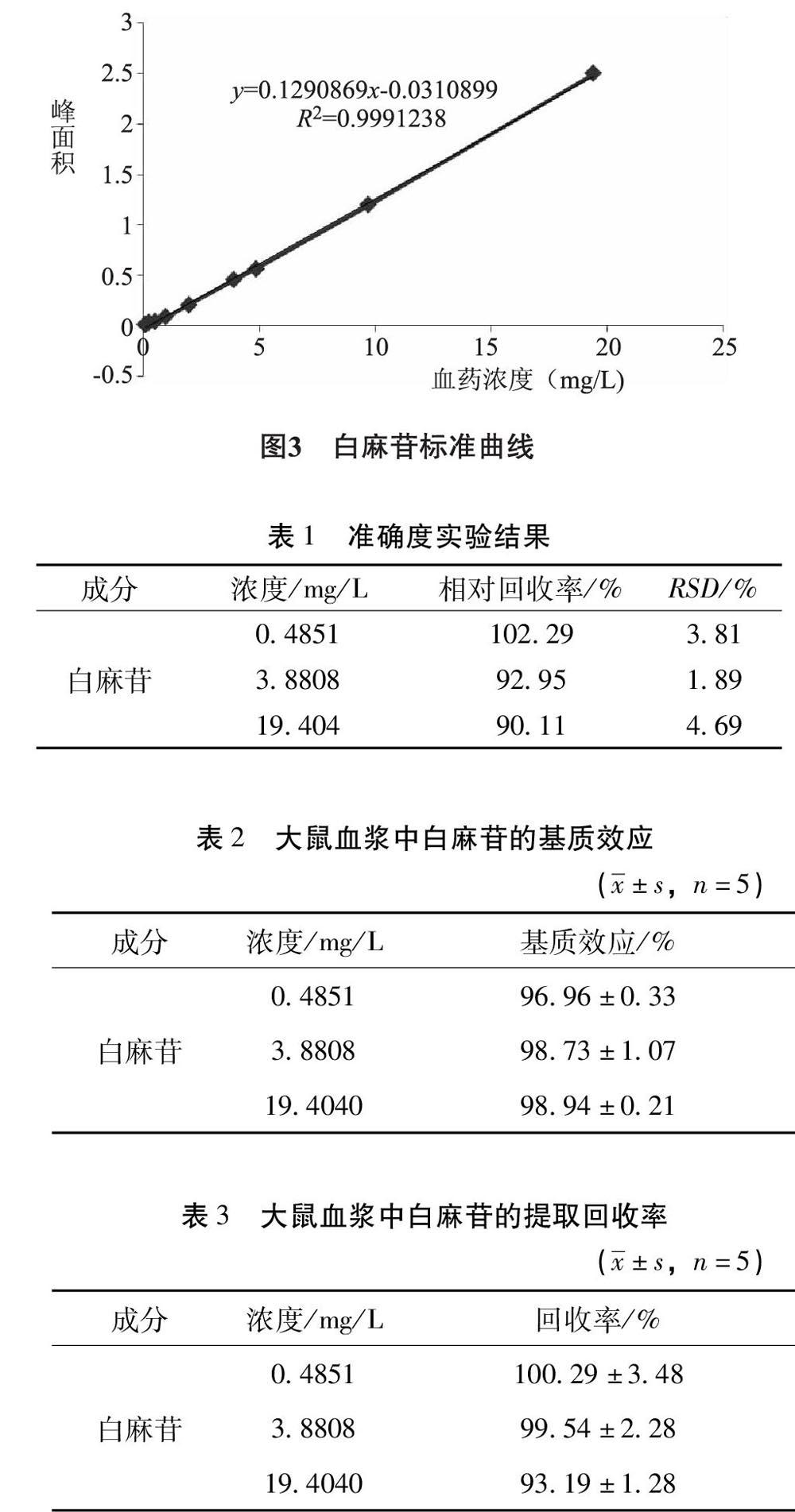
3.2.1 专属性 白麻苷的保留时间为19.793min,分离度>9,理论塔板数>10000,拖尾因子均符合测定要求,空白血浆中内源性物质不干扰白麻苷的含量测定。如图2所示。
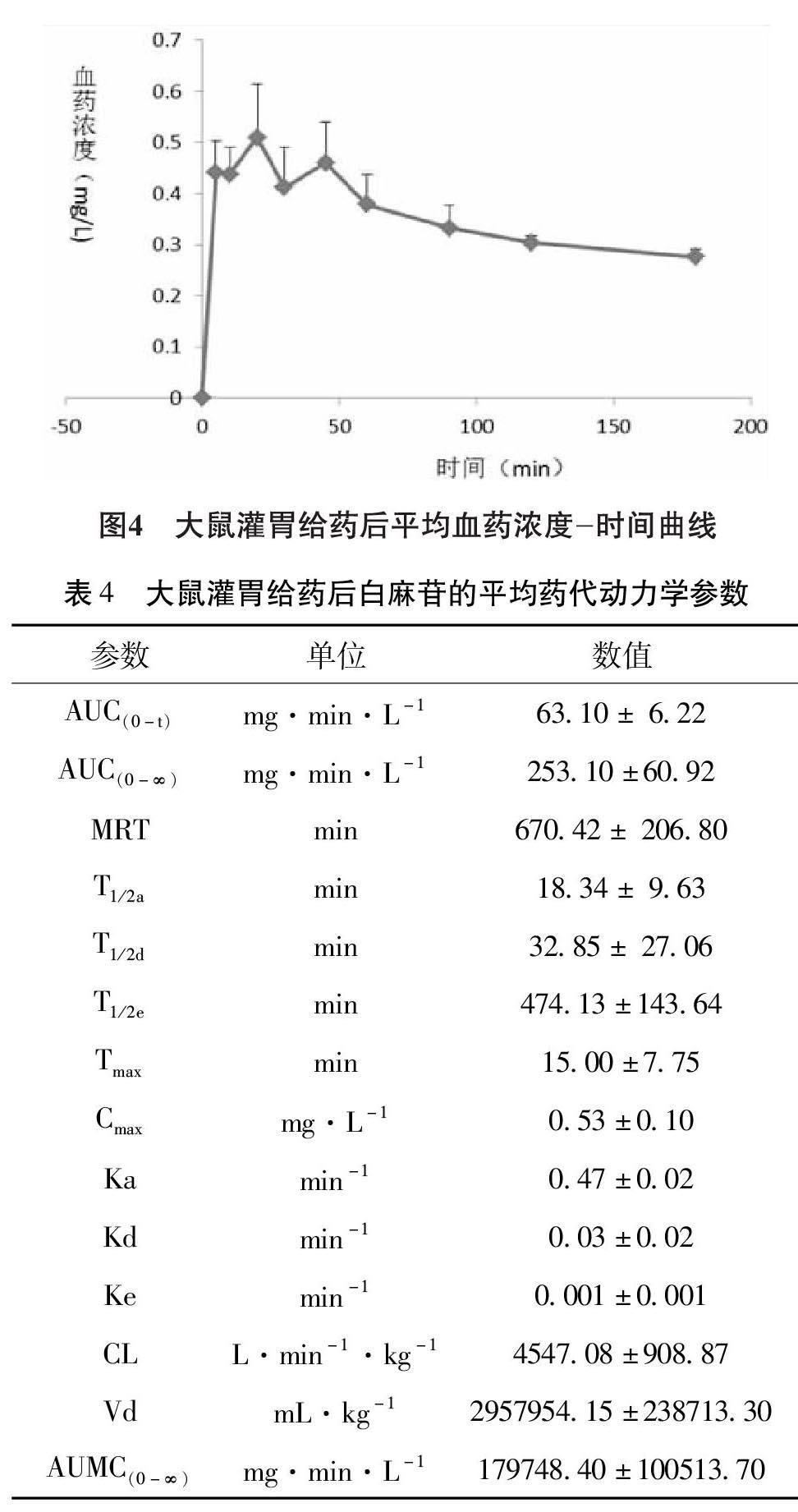
3.2.2 线性关系考察 白麻苷在0.0606~19.4040mg/L的范围内线性关系良好,回归方程为Y=0.1290869X-0.0310899(R=0.9996)。如图3所示。
3.2.5 基質效应和回收率实验 白麻苷检测基本不受基质干扰,平均提取回收率为97.91%,符合生物样品检测要求。见表2、表3。
3.2.6 稳定性实验 ”低、中、高3个浓度的血浆样品,室温下放置24h后测定RSD分别为4.10%、4.08%和4.26%,-20℃冰冻30d后测定RSD分别为3.93%、3.56%和3.69%,血浆样品短时、长期稳定性良好。
3.3 药代动力学实验 6只大鼠以1.05g/kg剂量的大叶白麻总黄酮灌胃给药,3h后检测不到白麻苷,血药浓度-时间曲线如图4所示。 白麻苷在大鼠体内的代谢过程符合开放的二室模型:吸收速率常数Ka=0.47min,表明白麻苷在胃肠道能很快的被吸收;灌胃后血浆中白麻苷在15min即达峰值CMAX=0.53mg/L,且分布速率常数Kd=0.03min,表明白麻苷进入大鼠体循环后,分布迅速;消除速率常数Ke=0.00 1min,消除半衰期t=474.13min,表明白麻苷在体循环中消除的很慢。见表4。
4 结论
本实验建立了大鼠血浆中白麻苷的HPLC含量测定方法,方法专属性良好、简便易行,相对回收率、精密度、稳定性等均符合生物样品的分析要求。以1.05g/kg剂量的大叶白麻总黄酮提取物灌胃大鼠,其主要成分——白麻苷在体内代谢过程符合开放二室模型,在体内能迅速分布发挥药效,同时持续时间较长。大叶白麻总黄酮的主要成分是白麻苷,并含有异槲皮苷、紫云英苷、芦丁及金丝桃苷。文献报道,大鼠灌胃罗布麻提取物后,血浆中可检测到金丝桃苷和异槲皮苷 [15-16]。笔者在实验中尝试检测大鼠血浆中的金丝桃苷、异槲皮苷、芦丁、紫云英苷,但均未检测到化合物原型,而是出现了其他色谱峰,但是鉴于检测手段的局限性,无法确认代谢产物,这与文献报道有一定差异。一方面可能是由于这些黄酮成分代谢很快,在大鼠体内快速转化为其他成分,另一方面也可能与样品处理及方法检出限有关。
参考文献
[1]张云峰.大花罗布麻化学成分的研究[D].乌鲁木齐:新疆医科大学,2003.
[2]孟庆艳,刘圆,孔星芸,白红进.不同采收期大花罗布麻叶中总黄酮的含量测定[J].中国实验方剂学杂志,2010,16(15):50-52.
[3]刘勇民.维吾尔药志[M].乌鲁木齐:新疆科技卫生出版社,1999:57.
[4]Haijuan An, Hong Wang, Yuexiang Lan,et al. Simultaneous qualitative and quantitative analysis of phenolic acids and flavonoids for the quality control of Apocynum venetum L. leaves by HPLC-DAD-ESI-IT-TOF-MS and HPLC-DAD[J].Journal of Pharmaceutical and Biomedical Analysis,2013(85):295-304.
[5]张语迟,刘春明,刘志强,等.罗布白麻与罗布红麻的液相色谱-质谱联用分析[J].分析测试学报,2009,28(10):1148-1154.
[6]韩利文.中药罗布麻叶及其有效部位的质量控制方法研究[D].太原:山西医科大学,2005.
[7]Chi-On Chan , Ching-Ching Lau , Yam-Fung Ng , et al.Discrimination between Leave of Apocynum venetum and Its Adulterant, A. pictum Based on Antioxidant Assay and Chemical Profiles Combined with Multivariate Statistical Analysis[J]. Antioxidants,2015(4):359-372.
[8]宋建平,許虎,陈菲,刘训红,等.罗布麻叶黄酮类成分的UPLC-Q-TOF-MS分析[J].中药材,2014,37(7):1199-1204.
[9]Yuchi Zhang,Chunming Liu,Zhengkun Zhang,et al. Fast differentiation of Apocynum venetum with related species by UPLC/MS and UPLC/SPE/NMR[J]. Med Chem Res ,2012(21):1077-1083.
[10]强静,李奇,刘训红,等.大花罗布麻叶黄酮类成分的分析[J].新疆中医药,2009,27(5):31-34.
[11]张娟,卿德刚,倪慧,等.一种具有抗炎活性的大叶白麻纯化物及其应用:中国,CN201810223169.1 [P]. 2018-3-19.
[12]胡运梅,刘春明,胡杨,等.罗布麻叶黄酮类化合物的酸化提取剂PC12细胞保护作用评价[J].时珍国医国药,2013,24(1):41-43.
[13] Monika A,Olszewska, Anna Presler, et al.Profiling of Phenolic Compounds and Antioxidant Activity of Dry Extracts from the Selected Sorbus Species[J].Molecules,2012(17): 3093-3113.
[14]冯春艳,卿德刚,倪慧,等.2种罗布麻叶中芦丁、金丝桃苷、异槲皮苷的含量比较研究[J].新疆农业科学,2017 , 54(7):1291-1297.
[15]梁珊珊.中药罗布麻质量控制及药效成分体内代谢研究[D].上海:第二军医大学,2012.

