联合检测IL-33、MMP-9、PCT在病毒性颅内感染中的诊断及鉴别诊断价值研究
黄小燕,戴小波,许坚锋,秦德芳,张现伟
(1.广东省人民医院珠海医院/珠海市金湾中心医院检验科,广东珠海 519041;2.珠海高新技术产业开发区人民医院/广东省第二人民医院珠海医院检验科,广东珠海 519085;3.广东省中医院珠海医院检验科,广东珠海 519015;4.广东省中医院珠海医院神经外科,广东珠海 519015;5.广东省中医院珠海医院内五科,广东珠海 519015)
中枢神经系统病毒感染是一种严重的感染性疾病,临床诊断主要依靠病史、临床表现、辅助检查及排除法;一般通过急性或亚急性起病、病毒感染的全身症状和脑膜刺激症状、脑脊液淋巴细胞轻度增高而糖、氯化物含量正常等指标进行诊断,但确诊需脑脊液病原学检查[1]。现有的病原学诊断技术有很多不足:病毒培养虽是“金标准”,但培养时间长,且需要特殊设备,在一般医院无法开展;血清学反应个体差异大;聚合链酶式反应(PCR)诊断意义较大,但需要有条件的实验室才能进行检测,且同样存在假阳性和假阴性的问题。因此现有诊断技术不能很好地满足临床早期诊断需求。为了寻求新的实验室指标来给颅内病毒性感染提供早期诊断依据,课题组通过检测脑脊液及血清中白细胞介素-33(IL-33)、基质金属蛋白酶-9(MMP-9)、降钙素原(PCT)等指标的水平,评估相关指标在病毒颅内感染中的诊断价值,现将相关内容报道如下。
1 资料与方法
1.1一般资料 收集2015年10月至2017年8月广东省中医院珠海医院、珠海市高新技术产业开发区人民医院/广东省第二人民医院珠海医院诊断为病毒性颅内感染(A组)、细菌性颅内感染(B组)及非感染性患者(C组),共44例。A组患者11例,平均年龄(43.4±15.3)岁,其中男2例,女9例。B组患者13例,平均年龄(45.8±15.2)岁,男8例,女5例。C组患者20例,平均年龄(48.5±14.3)岁,其中男11例,女9例。A、B、C 3组患者资料差异无统计学意义(P>0.05),具有可比性。
1.2材料与方法 收集2015年10月至2017年8月在广东省中医院珠海医院、珠海市高新技术产业开发区人民医院/广东省第二人民医院珠海医院各组病例在无菌条件下采集脑脊液2.0 mL,同时抽取静脉血4 mL,离心分离上清液,-80 ℃保存待测。IL-33、MMP-9、PCT均用酶联免疫吸附( ELISA) 方法检测,检测试剂盒由Bio-swamp 公司提供。

2 结 果
2.1血清PCT、MMP-9、IL-33水平比较 A组和B组患者的血清PCT、MMP-9和IL-33水平均高于C组,差异有统计学意义(P<0.05)。A组患者的血清PCT和MMP-9水平低于B组,差异有统计学意义(P<0.05)。但A、B两组的IL-33水平比较,差异无统计学意义(P>0.05)。详见表1。

表1 3组患者血清PCT、MMP-9和IL-33水平
2.2脑脊液PCT、MMP-9、IL-33水平比较 B组脑脊液PCT水平高于A组和C组,差异有统计学意义(P<0.05),但A组和C组的脑脊液PCT水平差异无统计学意义(P>0.05)。A、B两组脑脊液MMP-9和IL-33水平高于C组,差异有统计学意义(P<0.05),但A、B两组间差异无统计学意义(P>0.05)。见表2。

表2 三组患者脑脊液PCT、MMP-9和IL-33
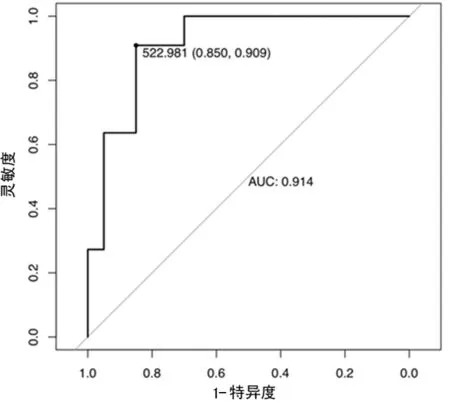
图1 PCT诊断病毒性颅内感染的ROC曲线
2.3PCT、MMP-9、IL-33水平对病毒性颅内感染的诊断价值 由ROC曲线分析,结果显示当血清PCT的阈值为522.981 ng/L时,其对病毒性颅内感染诊断的特异度为0.850,灵敏度为0.909,曲线下面积为0.914。当血清MMP-9的阈值为36.803 μg/L,其对病毒性颅内感染诊断的特异度为0.600,灵敏度为0.909,曲线下面积为0.755。当血清IL-33的阈值为819.603 ng/L,其对病毒性颅内感染诊断的特异度为1.000,灵敏度为0.727,曲线下面积为0.755。见图1~3。
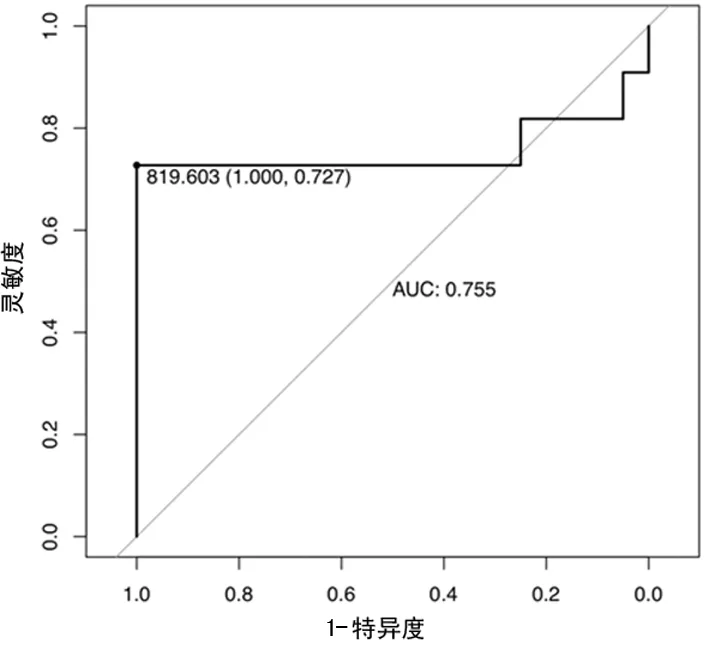
图2 MMP-9诊断病毒性颅内感染的ROC曲线
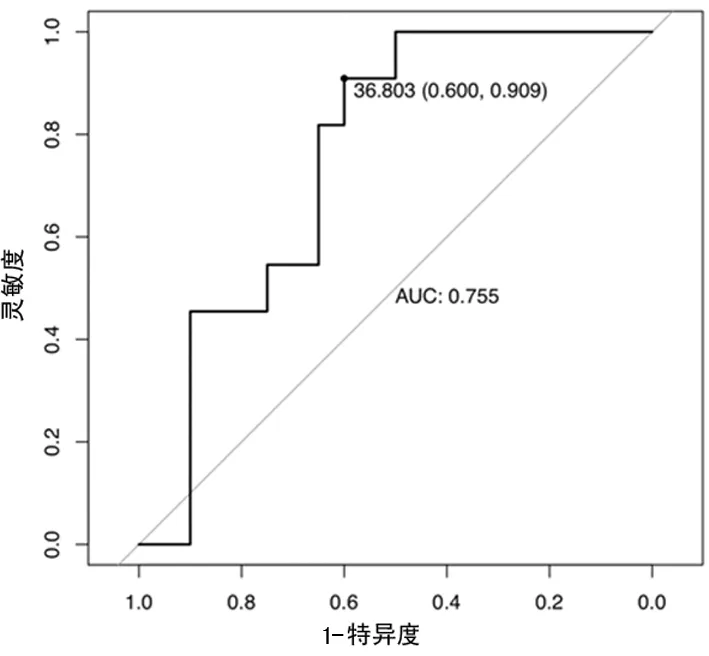
图3 IL-33诊断病毒性颅内感染的ROC曲线
3 讨 论
中枢神经系统病毒感染具有较高的致残率及病死率,早期诊断对改善患者的远期预后具有重要的意义。病毒侵入人体后,引起宿主细胞凋亡、坏死,导致脑组织的直接损伤;另一方面,病毒性感染免疫病理的发生以细胞免疫为主,主要是由Th1细胞、细胞毒性T淋巴细胞(CTL细胞)介导的一种免疫炎性损伤,活化的CTL效应细胞可以杀伤被病毒感染的神经组织细胞,而白细胞介素等细胞因子的释放可以引起一系列的病理变化[2]。损伤相关细胞因子(DAMPs)途径是近些年发现的一种免疫基础途径[3]。IL-33是今年来新发现的白细胞介素家族成员,由组织细胞分泌,是DAMPs相关细胞因子途径的主要组成成分,能快速诱导CTL细胞进行全力攻击,是CTL细胞生物学活性连级放大的主要内源性活性因子,可促进CD8+T细胞和自然杀伤细胞(NK细胞)的脱颗粒作用以及肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)的分泌,从而介导免疫系统对病毒的清除作用,而释放的IFN-γ可诱导IL-33的表达[4-5]。
本研究显示,A组血清IL-33水平高于C组,差异有统计学意义(P<0.05),但与B组血清IL-33水平比较,差异无统计学意义(P>0.05);脑脊液检测结果与血清检测检测相似。上述结果说明在感染后,组织释放大量IL-33,并通过损伤相关细胞因子途径,与模式识别受体(PRRs)相互作用,调节获得性免疫的分化方向,诱导免疫细胞的数量及活性连级放大[6]。
MMPs是一组能降解细胞外基质(ECM)成分的重要的蛋白分解酶,MMP-9是MMPs家族中相对分子质量最大的明胶酶,能降解ECM的主要成分,MMPs主要由免疫活性细胞如中性粒细胞及血管内皮细胞、小胶质细胞、神经细胞等细胞分泌[7]。近年来研究表明,MMPs参与了颅内感染血脑屏障的损害过程,其中MMP-9可能在血脑屏障的破坏过程中发挥重要作用,与颅内感染扩散、血管源性脑水肿和继发性脑组织损伤关系密切[8-9]。本研究结果也表明无论是A组还是B组的血清和脑脊液MMP-9水平,都高于C组,表明在中枢神经系统感染时,血脑屏障受到破坏。A组血清MMP-9水平低于B组,但两组脑脊液中MMP-9水平差异无统计学意义(P>0.05),与部分文献报道不同[10-11],分析可能与细组病例间血脑屏障损伤程度不一,数据离散程度较大有关。
PCT是降钙素的前体,由甲状腺的滤泡旁C细胞以及肺和小肠的神经内分泌细胞分泌。已被证实在全身炎性反应,特别是细菌感染导致的炎性反应时显著升高。细菌内毒素是诱导PCT产生的主要刺激因子之一,通过病原相关分子模式(PAMPs),释放出促炎因子,引起炎性反应及PCT水平的显著升高。同时机体在其他病原体感染、手术、创伤、肿瘤等状况下,由于细胞损伤坏死造成PAMPs物质的释放也能引起PCT水平的升高[12-14]。本研究表明,A组和B组的血清PCT水平高于C组,B组又高于C组,差异有统计学意义(P<0.05)。脑脊液PCT水平B组高于A组与C组,差异有统计学意义(P<0.05),A组与B组比较差异无统计学意义(P>0.05),与部分文献报道相符[15]。
A组血清及脑脊液IL-33水平显著高于C组,说明IL-33参与了颅内病毒性感染的相关病理生理过程,对于病毒性颅内感染的诊断有一定辅助意义,但与细菌性颅内感染鉴别缺乏特异度。在结合外周血及脑脊液PCT情况下,在鉴别细菌及病毒性感染方面具有一定价值。MMP-9对判断感染有一定意义,但在判断感染类型中价值有限。另外,由于本次研究的临床样本数量有限,同时未能反映各细胞因子在病程转归中的变化,因此本次研究临床数据有一定局限性。
4 结 论
病毒性颅内感染的患者血清和脑脊液IL-33、PCT和MMP-9水平均有明显异常变化,且与细菌性颅内感染患者有所不同。联合运用血清IL-33、PCT和MMP-9水平可作为新颖的生化检测指标,帮助诊断和鉴别诊断病毒性颅内感染。

