α-Fe2O3/Bi2WO6复合材料的制备及光催化降解印染废水研究
尹锦锋
(平顶山工业职业技术学院,河南平顶山467001)
印染废水污染环境,严重危害人体健康。为了治理印染废水,近年来,研究人员开发出多种印染废水处理技术[1]。其中,光催化技术可直接利用太阳能催化降解印染废水中的有机物,反应条件温和、降解效率高、操作简单等,引起科研人员的广泛关注[2-3]。
传统的光催化剂TiO2由于禁带宽度较大,只能吸收太阳光中的紫外部分,对太阳能的利用率较低,光催化降解效果较差[4]。近年来,越来越多的半导体被用于光催化领域[5-7]。Bi2WO6因合适的禁带宽度、价带位置及良好的化学稳定性,成为极有发展前景的光催化剂[8-9]。半导体α-Fe2O3具有更窄的禁带宽度,可以吸收太阳光中超过40%的能量,也是极有潜在应用价值的光催化剂[10-11]。但是,单独的Bi2WO6和α-Fe2O3作为催化剂都存在光生载流子容易复合的问题,导致光催化效率较低。此外,单独的光催化系统处理印染废水时,存在降解速度慢的问题,配合Fenton体系,可以达到快速反应的效果。本实验在研究α-Fe2O3、Bi2WO6及α-Fe2O3/Bi2WO6催化性能的基础上,在光催化溶液中引入H2O2,形成光助Fenton体系,分析了H2O2对光催化降解印染废水的影响。
1 实验
1.1 仪器与试剂
D8/Avance X射线衍射仪(XRD),Micromeritics ASAP 2010比表面仪(BET),Varian Cary 100紫外可见分光光度计(UV-Vis),Leybold-Heraeus LHS-10X射线光电子能谱仪(XPS),Hitachi S4800扫描电镜(SEM);Fe(NO3)3·9H2O,Bi(NO3)3·5H2O,Na2WO4·2H2O,乙酸,去离子水。
1.2 α-Fe2O3、Bi2WO6、α-Fe2O3/Bi2WO6的制备
将适量Fe(NO3)3·9H2O放入坩埚中,120℃下干燥2 h,300℃下退火2 h,得到α-Fe2O3。
将4.85 g Bi(NO3)3·5H2O溶于10 mL乙酸中,将1.7 g Na2WO4·2H2O溶于90 mL去离子水中。将两种溶液混合并持续搅拌1 h,形成白色悬浮液,装入高压釜中,140℃下保温20 h,自然冷却后取出、过滤、清洗,在120℃下干燥12 h,300℃下退火4 h,自然冷却后得到Bi2WO6。
利用玛瑙研钵通过机械混合得α-Fe2O3/Bi2WO6复合材料,其中α-Fe2O3质量分数5%时记为BW-Fe(5)。
1.3 光催化降解实验
利用甲基橙(MO)作为模拟印染废水,研究催化剂的光催化活性。溶液的初始pH为5.5,MO初始质量分数为2×10-5,催化剂质量浓度为1 g/L,在有H2O2的实验中,H2O2用量为3 mmol。溶液在黑暗条件下搅拌20 min后,用90 W/m2的紫外光和110 W/m2的模拟太阳光照射,每隔20 min使用UV-Vis测量一次吸光度,并计算MO降解率。
2 结果与讨论
2.1 表征
2.1.1 XRD
从图1中可以看出,α-Fe2O3样品的XRD图谱与标准卡片(JCPDS No.33-0664)吻合,主要峰位于24.1°、33.1°、35.6°、49.5°和54.1°处,分别对应赤铁矿结构的(012)、(104)、(110)、(024)和(116)晶面。Bi2WO6的衍射峰位置与斜方晶系标准卡片(JCPDS No.39-0256)一致,无其他杂峰。在BW-Fe(5)的XRD图谱中只有Bi2WO6的衍射峰,而无法观察到α-Fe2O3的衍射峰,这可能是α-Fe2O3的量较少,超出了仪器的检测限。
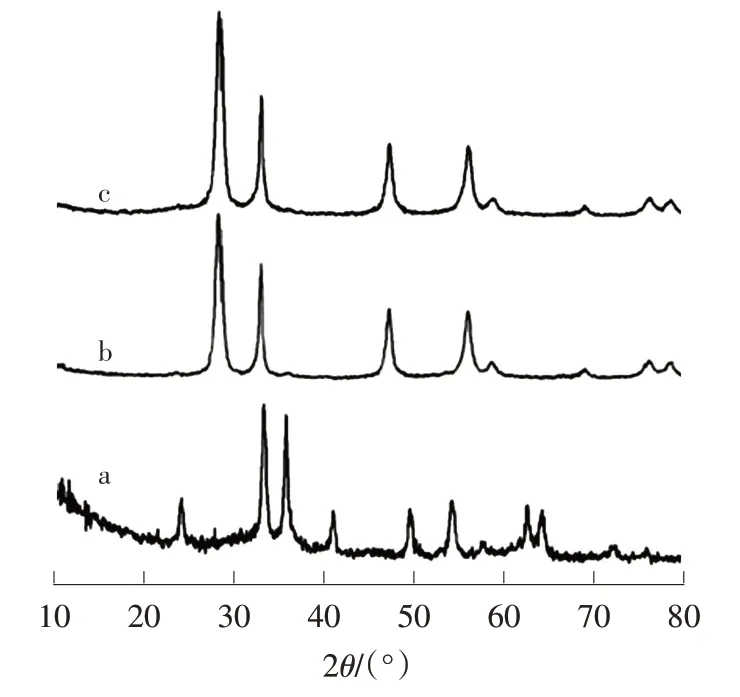
图1 α-Fe2O3(a)、Bi2WO6(b)、BW-Fe(5)(c)的XRD图
2.1.2 UV-Vis
由图2可看出,Bi2WO6在250~460 nm内均有吸收,对应的禁带宽度为2.8 eV。α-Fe2O3具有更广的光谱吸收范围,对应的禁带宽度为2.2 eV,其紫外光部分的吸收归因于O2-(2p)到Fe3+(3d)的直接跃迁,可见光部分的吸收归因于Fe3+(3d)电子的间接跃迁[12]。相比单独的Bi2WO6,BW-Fe(5)的光吸收曲线在可见光区域发生红移,这是由于BW-Fe(5)中存在少量的α-Fe2O3。BW-Fe(5)光吸收曲线的红移有利于吸收更多的太阳光,增加光的利用率。
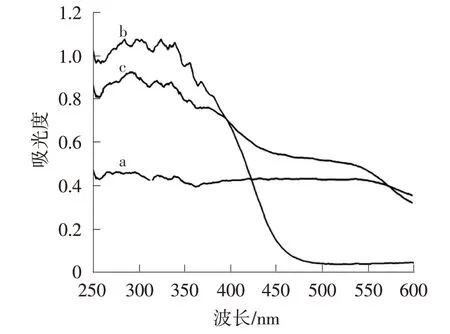
图2 α-Fe2O3(a)、Bi2WO6(b)、BW-Fe(5)(c)的UV-Vis图
2.1.3 SEM和BET
由图3A可以发现,Bi2WO6为三维球状花瓣结构,直径为5~8 μm;由图3B可以看出,在球状花瓣结构中,片状结构垂直插在球的表面[13]。由图3C可以看出,α-Fe2O3为不规则颗粒,直径约为0.1 μm,易团聚。从图3D可以看出,BW-Fe(5)同时存在球状花瓣结构和不规则颗粒,还有片状结构,说明在混合过程中,部分Bi2WO6的球状花瓣结构被破坏。
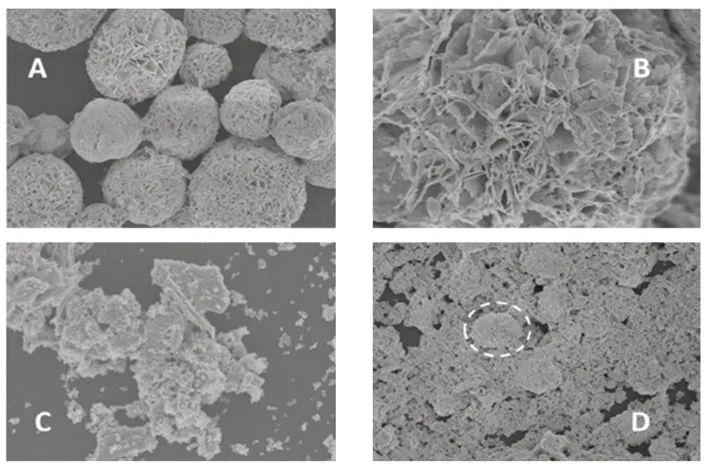
图3 Bi2WO6(A、B)、α-Fe2O3(C)、BW-Fe(5)(D)的SEM图
利用BET测试了Bi2WO6、α-Fe2O3和BW-Fe(5)的比表面积,结果分别为25.0、18.5和16.7 m2/g,这可能是由于混合后部分颗粒团聚,造成比表面积减小。
2.1.4 XPS
图4只检测到O1s、W4f、Bi4f和Fe2p的特征峰,无其他峰存在,进一步证明了BW-Fe(5)由Bi2WO6和α-Fe2O3组成。图4A表明O1s特征峰位于530.10 eV处,归因于529.32、529.65、530.32、530.98和531.26 eV处峰的重叠,分别对应Fe—O、Bi—O、W—O、H2O和·OH。图4B中,36.02和33.91 eV处的峰分别对应W4f 5/2和W4f 7/2。图4C的特征峰位于159.04和164.31 eV处,分别对应Bi4f 7/2和Bi4f 5/2。图4D中,Fe2p的特征峰位于710.42和723.75 eV处,分别对应Fe2p 3/2和Fe2p 1/2,说明在BW-Fe(5)中存在α-Fe2O3。
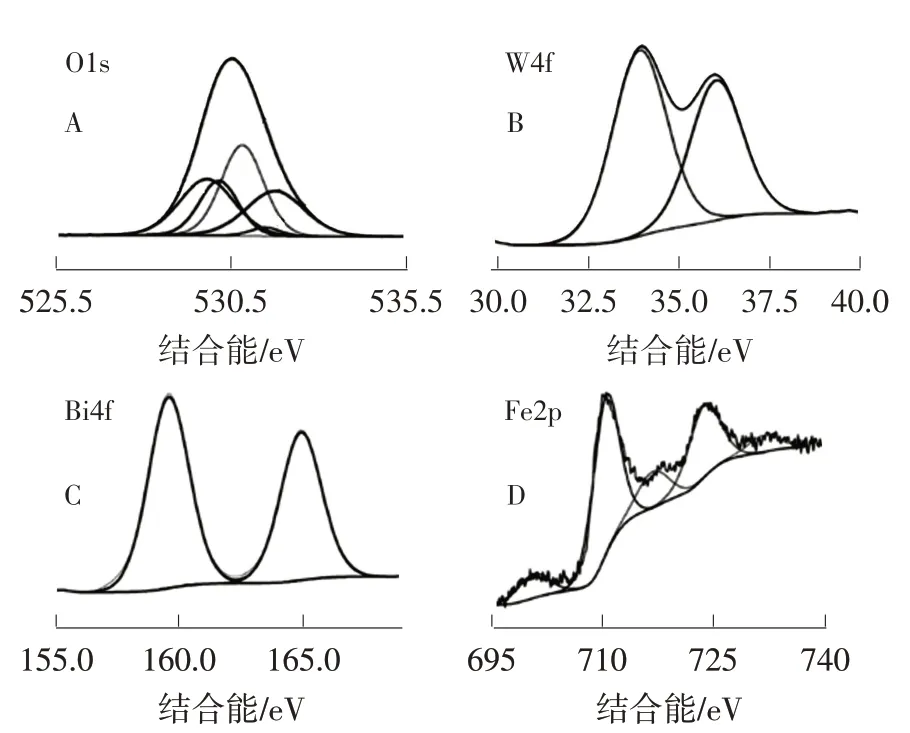
图4 BW-Fe(5)的XPS图
2.2 光催化活性
2.2.1 空白实验(UV/模拟太阳光+H2O2)
为了确认MO的去除是由光催化反应引起,首先研究了UV和模拟太阳光条件下H2O2对MO的降解率。由图5可知,在H2O2和光照同时存在的情况下,MO能够显著脱色,其中UV照射下的脱色效果更为明显,60 min后能够完全降解。
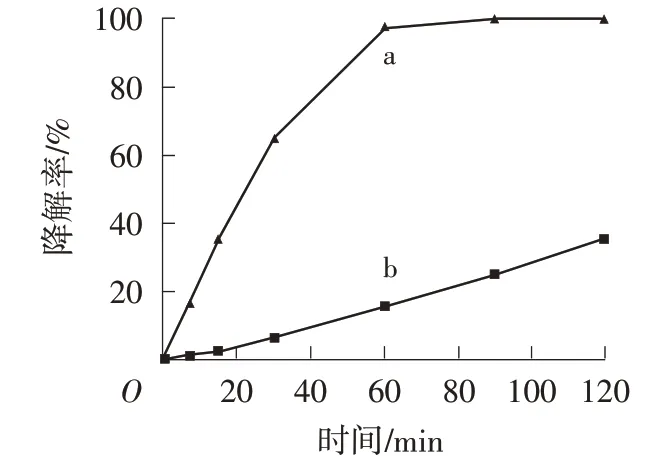
图5 紫外光(a)和模拟太阳光(b)照射下MO+H2O2的降解曲线
如表1所示,空白实验尽管降解率较高,但溶液的TOC仍然较高,120 min后,紫外光照射下MO的矿化度[=(1-TOC初始/TOC120min)×100%]为54.0%,模拟太阳光照射下MO的矿化度为39.1%。
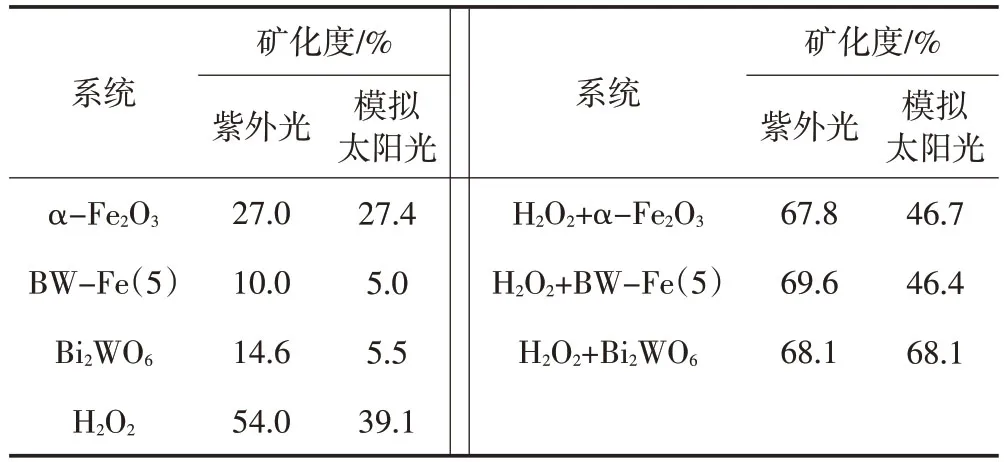
表1 不同系统下的MO矿化度
2.2.2 不同系统
如图6A所示,在没有H2O2、两种光照射条件下,Bi2WO6对MO的降解率极低,120 min后降解率仍然低于10%。此外MO的矿化度也较低。由图6B可知,在存在H2O2的情况下,紫外光照射60 min后,MO完全降解,模拟太阳光照射120 min后,MO的降解率约为45%。对比图5发现,Bi2WO6光催化剂似乎对降解MO并无促进作用,而加入H2O2后,MO的矿化度显著增加,紫外光和模拟太阳光照射后的矿化度均超过68%,说明Bi2WO6与H2O2存在协同作用,两者同时存在更有利于深度降解模拟印染废水。
如图6C所示,在无H2O2情况下,MO的降解率迅速减小,大量的MO吸附在α-Fe2O3表面,这可能是由于—NN—与Fe3+之间的相互作用,当吸附达到平衡后,用紫外光和模拟太阳光照射出现MO光解吸,伴随着光催化降解MO,矿化度分别为27.0%和27.4%。与单独的Bi2WO6光催化反应类似,在没有H2O2的情况下,α-Fe2O3的光催化效率极低。α-Fe2O3的禁带宽度较窄,可以吸收紫外光和大多数可见光,光催化效率较低可能是因为光生载流子容易复合,利用率低。如图6D所示,当α-Fe2O3和H2O2同时存在时,相比单独的α-Fe2O3和H2O2,MO的降解率都显著提升,这是由于α-Fe2O3/H2O2组成的光-芬顿系统能够产生更多的羟基自由基,促进了MO的降解[14]。
由图6E可知,在无H2O2、BW-Fe(5)光催化下,仅有少量MO被降解,表明机械混合并不能显著改善催化剂的光催化活性。如图6F所示,在H2O2+BW-Fe(5)系统下,紫外光照射30 min,MO降解完全,模拟太阳光照射60 min,MO降解率达到85%。当H2O2存在时,BW-Fe(5)对MO的降解率大于单独的H2O2,也大于同等条件下Bi2WO6和α-Fe2O3。BW-Fe(5)+H2O2系统对MO具有较好的矿化作用。单独的Bi2WO6和α-Fe2O3光催化剂产生的光生载流子容易发生复合,BW-Fe(5)光催化活性提升主要是由于两者混合后,光生电子从α-Fe2O3的导带跃迁到Bi2WO6的导带,有效避免了光生电子空穴的复合。此外,在BW-Fe(5)+H2O2系统中,H2O2作为电子受体,H2O作为空穴受体,能够产生更多的羟基自由基,进一步促进MO降解。
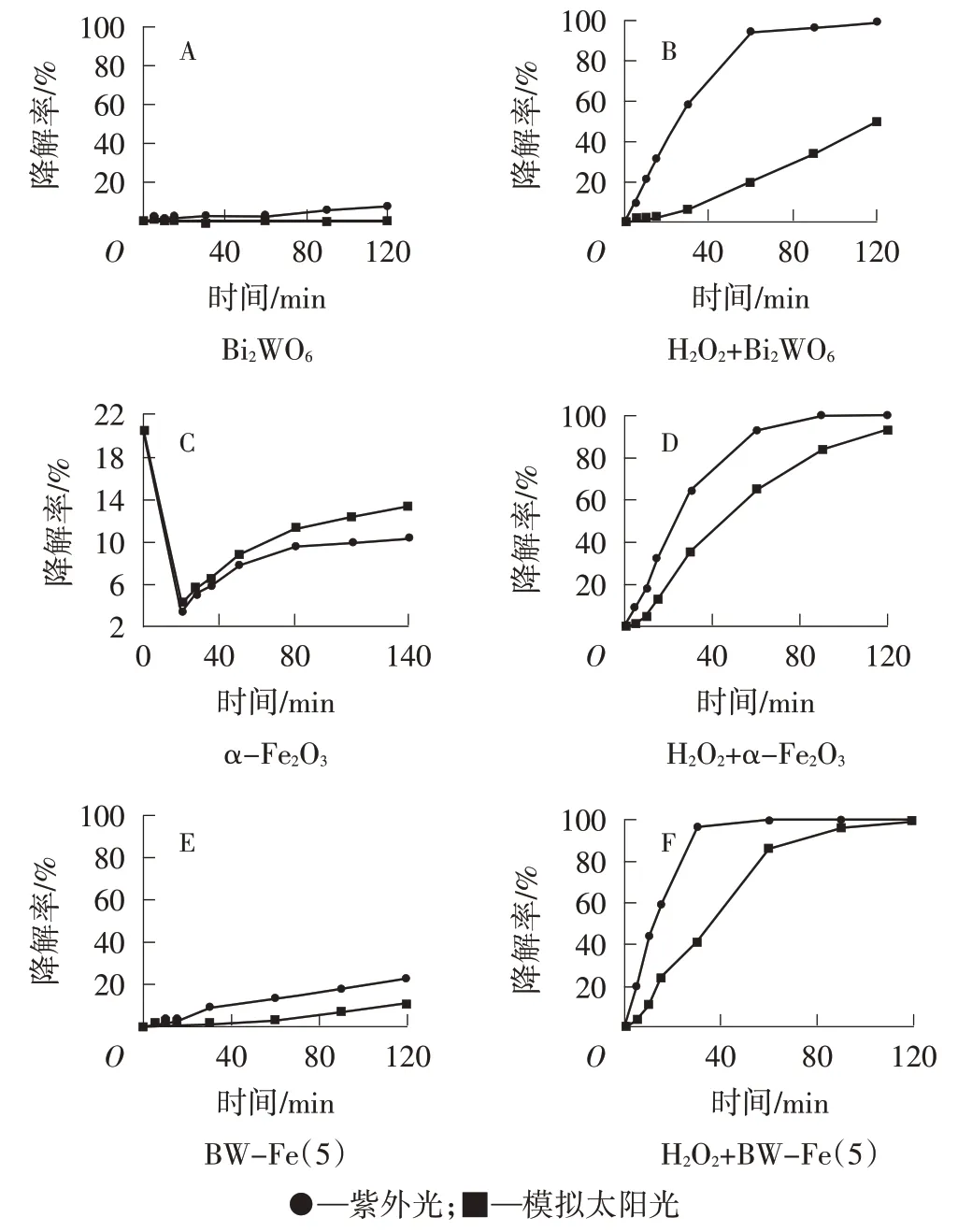
图6 不同系统下MO的光催化降解曲线
3 结论
(1)通过水热法制备了Bi2WO6,热分解法制备了α-Fe2O3,利用机械混合方式成功制得α-Fe2O3/Bi2WO6复合物。相比单独的Bi2WO6,α-Fe2O3质量分数为5%的α-Fe2O3/Bi2WO6混合物BW-Fe(5)在可见光区域的吸收光谱变宽。
(2)在BW-Fe(5)+H2O2光催化系统中,紫外光照射30 min,MO完全降解,模拟太阳光照射60 min,MO降解率达到85%,高于单独的Bi2WO6和α-Fe2O3。光催化活性提升一方面是由于混合物中的光生电子从α-Fe2O3导带跃迁到Bi2WO6导带,有效地避免了光生电子空穴的复合;另一方面是由于在BW-Fe(5)+H2O2系统中,H2O2作为电子受体,H2O作为空穴受体,能够产生更多的羟基自由基,促进了MO降解。

