基于纳米材料的可视化比色检测技术在食源性致病菌检测中的应用研究进展
周静,田风玉,焦必宁*,何悦*
1(西南大学,柑桔研究所,重庆,400712) 2(农业部柑桔及苗木质量监督检验测试中心,重庆,400712)
食源性致病菌的检测是食品安全研究领域的一个重要课题[1]。食源性致病菌引发的传染性疾病逐年增加,给人类健康和全球经济造成了严重的威胁[2]。2017年,CDC’s Foodborne Diseases Active Surveillance Network(FoodNet)报告中指出,在美国由食源性致病菌引发的传染性疾病造成了24 484例感染,5 677例住院治疗和122例死亡[3]。与前3年相比,2017年感染弯曲杆菌、李斯特菌、大肠杆菌的机率有所增加。近十年来,通过食物传播的食源性致病菌感染率基本保持不变。虽然情况有所好转,但是食源性致病菌引发的传染性疾病依然是发病率和死亡率逐步攀升最主要的原因之一。许多食源性致病菌具有非常低的感染剂量,例如,E.coliO157:H7和沙门氏菌的感染剂量低至10个细胞[4]。因此,建立一种快速、可靠、操作简单、易携带、高灵敏性、高特异性的检测方法,对于食源性致病菌的实时监控有着重要的意义。目前应用于实际样品的检测方法主要有平板培养法、分子生物学方法、免疫学方法等。这些方法虽然有很多优点,但也存在耗时长、操作复杂、劳动力消耗大、灵敏度低等缺点,从而在食源性疾病爆发时,无法满足快速准确检测的需求。
近年来,基于纳米材料的食源性致病菌检测方法不断推陈出新。纳米材料指在三维空间中,有一维或多维在纳米尺度(1~100 nm)范围内的材料,或由其作为基本单元构成的材料[5]。目前研究者已构建了多种基于纳米材料检测食源性致病菌的技术,如荧光检测技术、可视化比色检测技术、电化学检测技术等。其中因可视化比色检测技术具有简单、便携、低成本和可裸眼快速直接读出等优点而显现出独特的优势[6]。例如,部分纳米材料除具有独特的光学和电子特性[[7],自身还具有类似生物酶的催化活性,这类纳米材料被称为纳米酶[8]。这些纳米酶可以将过氧化氢(H2O2)的O—O键分解为具有高氧化能力的羟基自由基[9],羟基自由基能氧化过氧化物酶底物,如3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetramethylbenzidine, TMB)、3-乙基苯并噻唑啉-6-磺酸(2, 2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), ABTS)和邻苯二胺(o-phenylenediamine dihydrochloride, OPD),分别生成蓝色、绿色和黄色的氧化产物[10]。纳米酶的出现,为新型可视化比色检测技术的开发提供了更多机会[11]。此外,一些纳米材料的表观颜色在其表面性质发生改变后会发生相应的变化,从而可用于构建可视化比色检测技术,以实现食源性致病菌的定量检测[12]。还有一些自身颜色鲜艳的纳米材料,可直接用于目标菌的可视化比色检测。本文综述了近几年基于纳米材料所构建的可视化比色检测技术在食源性致病菌检测中的应用现状,以期对新的可视化比色技术的开发提供思路。
1 基于纳米材料的可视化比色检测技术在食源性致病菌检测中的应用研究(表1)
1.1 基于纳米酶的可视化比色检测技术
纳米酶是指一类本身具有类似天然酶催化活性的无机纳米材料[13],与天然酶相比,它具有制备工艺成熟、成本低、易于贮存等优势[14]。组成纳米酶的材料主要包括:贵金属纳米材料、金属氧化物以及复合纳米材料。纳米酶的出现,为新型比色传感器的开发提供了更多机会。2007年,GAO等[15]首次发现Fe3O4纳米粒子具有类似过氧化物酶的特性。后来的研究者们相继发现贵金属纳米颗粒如金纳米颗粒(gold nanoparticles, Au NPs)[11, 16]、金属有机框架(metal organic frameworks, MOFs)纳米材料如Cu-MOF[17]、金属氧化物纳米材料如氧化镍纳米颗粒(NiO NPs)[18]等都具有类似天然酶的活性。
1.1.1 基于贵金属纳米酶的可视化比色检测技术
贵金属纳米材料的性质十分稳定,部分贵金属纳米材料还具有类似过氧化物酶的催化特性,其催化活性主要是通过表面吸附和快速电子转移实现的[19]。研究发现,Au NPs、铂纳米颗粒(Pt NPs)、钯纳米颗粒(Pd NPs)[20]以及由它们构成的双金属复合纳米材料,如Au@Pt NPs[16]、Ag@(Pd、Au、Pt) NPs[21]等都具有类似过氧化物酶的催化活性。JIANG等[11]将金黄色葡萄球菌的抗体修饰到Au@Pt NPs表面,结合免疫层析技术,开发了一种新型的可视化比色检测技术。当金黄色葡萄球菌存在时,检测线上固定的抗体可以特异性地捕获目标菌,目标菌再结合抗体修饰的Au@Pt NPs,形成双夹心复合物。此时,Au@Pt NPs在H2O2存在的条件下,催化TMB氧化显色,根据体系内比色信号的变化,实现金黄色葡萄球菌的定量检测。该技术的检测限为100 CFU/mL。SU等[16]也利用Au@Pt NPs实现了对大肠杆菌的定量检测,并且进一步提高了基于双金属纳米材料可视化比色检测技术的灵敏度。他们以Au NPs为模板孵育生长Pt NPs,在制备过程中,加入具有保护和稳定作用的阳离子表面活性剂十六烷基三甲基氯化铵(hexadecyltrimethyl ammonium chloride, CTAC)和能靶向识别E.coliO157∶H7的4-巯基苯硼酸(4-mercaptophenylboronic acid,MPBA)分子,得到MPBA-CTAC-Au@Pt NPs。通过MBPA上的硼酸与细菌表面糖类中所含的顺式二醇基团相互作用,MPBA-CTAC-Au@Pt NPs可有效结合在E.coliO157∶H7表面。加入H2O2,MPBA-CTAC-Au@Pt NPs能催化H2O2氧化TMB显色。该技术在E.coliO157∶H7浓度为7~6×106CFU/mL的范围内具有良好的线性关系,检测限低至7 CFU/mL。此外,WU等[22]用适配体修饰的磁性纳米颗粒(magnetic nanoparticles, MNPs)和该致病菌的抗体(Ab)夹心捕获致病菌,然后加入辣根过氧化物酶(HRP)和二抗(AAb)双重修饰的Au NPs复合酶,得到MNPs-细菌-Ab-AAb-Au NPs-HRP复合物,该复合物上的HRP可催化H2O2氧化TMB显色,从而实现鼠伤寒沙门氏菌的可视化比色检测。该技术的检测范围为1×103~1×108CFU/mL,检测限为103CFU/mL,相比仅使用HRP催化的ELISA法,其灵敏度提高了一个数量级,并且具有更宽的检测范围。
1.1.2 基于有机金属框架纳米酶的可视化比色检测技术
基于贵金属纳米酶开发的可视化比色检测技术,虽然显示出良好的分析性能,但是贵金属材料价格昂贵,且易受到样品中复杂基质的干扰,限制了其应用范围。通过普通金属离子和有机交联剂自组装形成的MOFs材料,由于其表面积大、孔隙率高、稳定性好等优势受到了研究者们的广泛关注[17]。近来研究发现,MOFs材料具有类似过氧化物酶的催化活性,能够在H2O2存在条件下,催化TMB氧化显色。WANG等[17]利用适配体修饰的Cu-MOF材料作为信号探针,适配体修饰的磁性纳米颗粒作为捕获探针,通过简单的磁分离,可以一步实现金黄色葡萄球菌的捕获和识别。该技术在50~104CFU/mL的范围内具有良好的线性关系,最低检测限为20 CFU/mL。
1.1.3 基于金属氧化物纳米酶的可视化比色检测技术
金属氧化物纳米酶通常由过渡金属氧化物纳米材料构成,此类纳米酶和反应底物结合通常伴随着电子转移和化合价的变化[23]。常见的金属氧化物纳米酶有:NiO, CeO2, Co3O4, ZnFe2O4等。金属氧化物纳米酶不但稳定性好,而且制备过程简单、成本低,常用于致病菌的可视化比色检测。PANDIAN等[18]首先将Ni NPs煅烧氧化生成NiO NPs,再通过柠檬酸(citric acid, CA)的修饰,得到CA包被的NiO NPs(CA-NiO NPs);随后在CA-NiO NPs表面修饰鼠伤寒沙门氏菌的Ab,得到能够特异性识别鼠伤寒沙门氏菌的Ab-CA-NiO NPs复合物。一方面,NiO NPs在酸性条件下可催化H2O2氧化TMB显色[10];另一方面,结合在细菌表面的NiO NPs可吸收激光的能量,通过光热作用达到对目标菌靶向杀灭的目的。该技术对鼠伤寒沙门氏菌检测的线性范围为10~106CFU/mL,检测限为10 CFU/mL,在牛奶和果汁中的加标回收率分别为95%~100% 和 92%~99%,满足检测的要求。
此外,由于部分金属氧化物纳米酶的催化活性低,难以在独立存在的情况下发挥作用,故一般利用碳基纳米材料充当载体以改善金属氧化物纳米酶的催化活性。如:ZnFe2O4因具有良好的稳定性和低成本而备受关注,但是裸的ZnFe2O4催化活性较低[24]。采用具有大的比表面积的碳基纳米材料,如还原型氧化石墨烯(reducedgraphemeoxide, rGO)对其进行载负,因ZnFe2O4和rGO之间具有协同效应,可有效提高其催化活性。WU等[14]利用该技术制备了具有高效催化性能的ZnFe2O4/rGO复合纳米材料,并构建了可视化比色适配体检测技术,用于鼠伤寒沙门氏菌的检测。他们首先在微孔板上修饰能特异性识别鼠伤寒沙门氏菌的适配体1分子,实现复杂环境中目标致病菌的准确捕获和分离;然后在ZnFe2O4/rGO表面修饰能特异性识别鼠伤寒沙门氏菌的适配体2分子,利用夹心策略,成功实现了对鼠伤寒沙门氏菌的可视化比色检测。该技术的检测限为11 CFU/mL,具有较高的灵敏度。
1.2 基于纳米材料表观颜色变化的可视化比色检测技术
1.2.1 基于纳米金表观颜色变化的可视化比色检测技术
Au NPs由于制备过程简单,粒径大小可控,生物相容性好,具有独特的物理、化学性质,使得基于Au NPs的表面等离子共振效应所建立的可视化比色检测技术在食品安全分析领域得到很大发展[25]。在混合基质中,分散态的Au NPs呈红色,通过静电作用或者靶向连接作用促使Au NPs发生团聚,其表面等离子共振吸收峰也会发生明显地移动[26]。通过适当引入生物识别元素来调控Au NPs的“分散/聚集”状态,即可实现目标菌的可视化比色检测[27]。ZHENG等[28]将酪氨(tyramine, TYR)修饰到Au NPs的表面,由于HRP可催化H2O2氧化TYR,从而引起TYR修饰的Au NPs发生团聚。基于此,构建可视化比色检测技术用于大肠杆菌的快速灵敏检测。他们首先将捕获抗体(CAb)修饰在磁性纳米颗粒(MNPs)表面得到捕获探针CAb-MNPs;再将检测抗体(DAb)和过氧化氢酶(CAT)修饰到聚苯乙烯微球表面,得到检测探针DAb-PS-CAT。将CAb-MNPs、DAb-PS-CAT与目标菌样品溶液混合,通过抗原-抗体的特异性识别作用得到MNPs-细菌-PS-CAT复合物,利用磁分离富集大肠杆菌。MNPs-细菌-PS-CAT复合物中的CAT可催化H2O2分解生成H2O,溶液中H2O2的减少导致HRP的催化反应无法进行,此时溶液中的Au NPs呈分散状态,显红色。相反,不存在大肠杆菌时,该溶液的颜色由于Au NPs的聚集而呈现蓝颜色。该技术对目标菌检测的线性范围为50~5.0×104CFU/mL,检测限为50 CFU/mL。此外,BUI等[29]通过控制纳米脂质体释放半胱氨酸,达到对Au NPs“聚集/分散”状态的调控,实现了对E.coliO157、李斯特菌及沙门氏菌的可视化比色检测。一方面,在微孔板上修饰单克隆抗体(monoclonal IgG, MI),加入目标致病菌和多克隆抗体(polyclonal IgG, PI),得到MI-致病菌-PI复合物;然后加入生物素化的多克隆二抗(polyclonal anti-IgG, API)和链霉亲和素(streptavidin, SA),得到可以调控脂质体释放半胱氨酸的MI-致病菌-PI-API-Biotin-SA免疫复合物;另一方面,在包裹有半胱氨酸的纳米脂质体(Cys-liposomes)表面修饰有生物素(biotin),通过SA-Biotin连接作用得到MI-致病菌-PI-API-Biotin-SA-Biotin-Cys-liposomes免疫复合物;最后加入Au NPs和PBST(PBS buffer with Tween-20 0.05%),PBST可诱导脂质体裂解释放半胱氨酸。半胱氨酸的硫醇基团与Au NPs结合,其游离的氨基和羧基通过分子间氢键和其他半胱氨酸分子结合,从而可以使Au NPs聚集,发生明显的颜色变化。该技术灵敏度较高,可直接检测个位数的食源性致病菌。另外,SINGH等[30]利用粘菌素作为识别分子,构建了基于Au NPs的可视化比色检测技术,该技术可直接用于检测水中的大肠杆菌。该检测体系没有大肠杆菌时,阳离子粘菌素通过电荷相互作用与阴离子柠檬酸根修饰的Au NPs结合,使Au NPs发生聚集,此时溶液显蓝色;该检测体系存在大肠杆菌时,粘菌素特异性结合大肠杆菌,从而无法促使Au NPs发生聚集,此时溶液显红色。此技术对自来水中的大肠杆菌检测限为10 CFU/mL,对湖水样品中的大肠杆菌检测限为100 CFU/mL,检测时间仅需5 min,且不需要任何昂贵的试剂和仪器设备。
银染放大法也经常被运用到致病菌的可视化比色检测中[31]。银染放大法,即银离子被还原剂,如对苯二酚、抗坏血酸(ascorbic acid, AA)、对氨基苯酚(p-aminophenol, PAP)等还原为零价银,沉积在Au NPs或者金纳米棒(gold nanorods, Au NRs)表面,可以发生多种颜色的变化。例如,当零价银沉积在Au NRs表面时,Au NRs的纵横比显著减小。并且随着银染程度的变化,溶液颜色随之改变[32]。CHEN等[33]首次通过银染的方法实现了对大肠杆菌的多色检测。他们首先利用噬菌体感染大肠杆菌,使其裂解释放β-半乳糖苷酶;p-半乳糖苷酶催化氨基苯基β-D-半乳糖吡喃糖苷(p-aminophenyl-β-D-galactopyranoside, PAPG)还原生成PAP;具有还原性的PAP还原银离子生成金属银,金属银沉积在Au NRs表面,导致Au NRs的纵横比发生显著改变,从而发生多种颜色的变化。虽然基于裸眼可视的检测限仅为1 × 105CFU/mL,但是人眼对于多色(大约1 000万中颜色类型)分辨能力远超同色系(大约64级)的分辨力[6, 34],使得该技术在可视化比色检测领域具有较大的应用潜力。
Au NPs体积的变化,也可导致光学信号的变化[35]。LI等[36]利用抗体修饰的金核特异性结合空肠弯曲杆菌,通过离心过滤器过滤,去除未结合空肠弯曲杆菌的金核,最后AA还原氯金酸在金核的表面生成Au NPs,从而实现检测信号的放大。该技术检测限为1.088×103CFU/mL。CAO等[37]设计了双信号可视化比色检测技术,通过增强检测溶液的颜色深度,达到检测空肠弯曲杆菌的目的。他们首先在金核表面修饰抗体,利用AA还原氯金酸在金核表面生成Au NPs,然后对Au NPs进行银染,进一步加深检测溶液的颜色深度。该技术检测限为106CFU/mL。此外,SUNG等[38]通过还原四氯金酸增大Au NPs的体积,从而增强样品溶液的颜色深度,实现了对金黄色葡萄球菌的可视化比色检测。该技术在牛血清白蛋白(bovine serum albumin, BSA)包被的MNPs表面共价修饰Au NPs和金黄色葡萄球菌的Ab得到Ab-Au NPs-BSA-MNPs纳米复合物;随后该纳米复合物特异性识别金黄色葡萄球菌,并通过磁分离进行多次洗涤富集;然后将金黄色葡萄球菌-Ab-Au NPs-BSA-MNPs复合物溶液注入到直径3 mm的聚二甲基硅氧烷(polydimethylsiloxane, PDMS)孔中,通过孔底部的醋酸纤维膜过滤得到该复合物;最后在PDMS孔中注入四氯金酸和羟胺,以增强检测样品的颜色深度,实现食源性致病菌的可视化比色检测。该技术对于缓冲溶液中的金黄色葡萄球菌的检测限为1.5×103CFU/mL,对牛奶中的金黄色葡萄球菌的检测限为1.5×105CFU/mL。
上述大部分可视化比色检测技术往往需要对金纳米材料进行共价修饰,价钱昂贵且制备时间长,构建基于金纳米材料的无标记可视化比色检测技术会更为经济。JUNG等[39-40]利用巯基化的寡核苷酸探针实现了对Au NPs“聚集/分散”的调控。该技术以巯基化的寡核苷酸探针为引物,靶DNA分子序列为模板进行PCR扩增,扩增后目标序列通过末端的巯基吸附在Au NPs表面,由于扩增的长链DNA带有丰富的负电荷,在静电力的作用下,使得空间排斥增强,从而使得Au NPs在盐诱导下不会发生聚集;相反,如果没有靶DNA分子存在,巯基化的寡核苷酸DNA探针可引起Au NPs的聚集,从而使得颜色由红色变成蓝色。该技术可检测nM级别的靶标DNA。此外,ROTHBERG等[41]研究发现,单链DNA结合在Au NPs表面时,可以对Au NPs起到稳定化的作用,保护Au NPs在盐诱导下不发生团聚。基于此,MCVEY等[42]提出了用核酸内切酶控制Au NPs聚集的新技术,成功实现了无标记、超灵敏地检测致病菌DNA的目的。首先与目标菌DNA碱基互补配对的RNA与Au NPs相互作用,避免Au NPs在盐诱导下发生团聚,此时Au NPs溶液呈现红色;然而,当该检测体系内含有目标菌DNA时,目标菌DNA和RNA进行碱基互补配对形成DNA-RNA异源双链体结构,该双链体对RNAse H酶促切割敏感,使得目标菌DNA被释放,并进入下一轮与RNA进行杂交、RNAse H酶切、目标菌DNA释放;最后直到所有RNA都被消耗,使得Au NPs失去保护,在高盐环境中发生团聚,溶液变为蓝色。该技术可以检测低至1 pmol/L的目标菌DNA,具有超高的灵敏度和特异性。
以上检测策略通常需要2个或多个步骤完成,操作较繁琐。并且,多个步骤在一定程度上会导致更多的干扰和更多的目标致病菌的损失,从而影响检测的可靠性[43]。“一步检测”由于其免洗涤、简单、高效的特点,受到了研究人员的重视。LIU等[44]构建了双功能纳米探针(CS-Au NPs @ fusion-pVIII)以实现对金黄色葡萄球菌的“一步检测”。pVIII融合蛋白(fusion-pVIII)是一种可特异性结合金黄色葡萄球菌的蛋白。在EDS/NHS的作用下,pVIII融合蛋白的氨基酸链的碳端羧基与Au NPs表面修饰的半胱氨酸(CS)的氨基发生缩合反应得到CS-Au NPs @ fusion-pVIII双功能纳米探针。在含有目标菌的检测体系中,由于该纳米探针上面的pVIII融合蛋白可迅速结合目标菌,在纳米探针的连接作用下Au NPs发生团聚,样品溶液颜色随之变淡。反之无目标菌存在的时候,该检测溶液呈正红色。该技术通过fusion-pVIII对金黄色葡萄球菌的特异性识别能力和CS-Au NPs独特的表面等离子共振特性,成功构建了金黄色葡萄球菌的可视化比色检测体系。30 min内可完成检测,检测限为19 CFU/mL。
1.2.2 基于银纳米颗粒表观颜色变化的可视化比色检测技术
相比Au NPs而言,相同粒径下的银纳米颗粒(Ag NPs)具有更大的消光系数,有望构建更为灵敏的检测技术,以实现致病菌可视化比色检测[45]。同Au NPs相似,通过引入生物识别元素来调控Ag NPs的“分散/聚集”状态,就能产生颜色的变化。ZHENG等[46]在Ag NPs表面修饰MPBA,用于大肠杆菌的检测。MPBA-Ag NPs结合了目标致病菌之后,会由聚集状态变为分散状态,并发生明显的颜色变化。该技术在5×104~1×107CFU/mL的范围内具有良好的线性关系,检测限为0.9×104CFU/mL。由于Ag NPs容易氧化且Ag NPs表面较难修饰所需的识别分子,故对基于Ag NPs的可视化比色检测技术的研究并不多,需要进一步开发一些新的修饰策略,以拓展基于Ag NPs可视化比色检测技术的应用范围[47]。
1.2.3 基于聚合物纳米粒子表观颜色变化的可视化比色检测技术
聚合物纳米粒子性能优异,可用于开发可视化比色检测技术。PDA囊泡是一种典型的聚合物纳米粒子。聚丁二炔(polydiacetylene, PDA)及其衍生物可以通过自组装形成PDA囊泡,PDA囊泡由亲水头部和疏水尾部组成,在640 nm波长处有最大吸收峰,其颜色为蓝色。在外界温度、pH、分子识别等条件的影响下,最大吸光度从640 nm移动到540 nm,其颜色由蓝色变为红色[48]。WU等[12]用一种丁二炔的单体—10,12-二十五碳二炔酸(PCDA)制备了纳米级PDA囊泡,并通过共价偶联将截短的脂多糖-适配体修饰在PDA囊泡表面,从而得到修饰了适配体的PDA探针。E.coilO157:H7与囊泡界面处的适配体之间的特异性识别导致PDA囊泡由蓝色转变成红色,可直接用裸眼读出。该技术在2 h内可实现104~108CFU/mL大肠杆菌的检测,并具有优异的特异性。与标准培养方法相比,此技术对203株临床粪便标本中E.coilO157:H7的检出率为98.5%,表明该技术可用于临床粪便标本的检测。此外,OLIVEIRA等[49]利用PDA与赖氨酸的相互作用开发了赖氨酸-PDA囊泡传感器。具体而言,氨基酸代谢产物可通过间接扰动改变PDA构象。例如沙门氏菌含有能使赖氨酸脱羧生成胺的赖氨酸脱羧酶,在其培养基中加入赖氨酸,赖氨酸脱羧生成的胺会造成细胞外环境pH的增加,从而诱导PDA囊泡从蓝色转变成红色。该技术研究了由赖氨酸脱羧造成的不同酸度对PDA体系颜色变化的影响,从而证实了其开发的赖氨酸-PDA囊泡可以用作比色传感器的构建。由于PDA囊泡独特的色彩特性,PDA囊泡在致病菌可视化比色检测领域将大放异彩[50]。
1.3 基于有色纳米材料的可视化比色检测技术
纳米酶的催化活性,贵金属纳米材料、聚合物纳米材料的表面性质,都容易受到外界环境的干扰。有色纳米材料因其色泽鲜艳、易于制备并且抗干扰能力强,而被越来越多的应用到致病菌的可视化比色检测中。SUN等[51]构建了基于蓝色二氧化硅纳米颗粒(blue-Si NPs)的可视化比色检测技术,成功实现了对鸡白痢沙门氏菌(S.pullorum)的检测。他们首先采用抗体修饰的MNPs对致病菌进行筛选和预富集;随后,加入抗体修饰的blue-Si NPs, blue-Si NPs特异性结合致病菌,形成MNPs-S.pullorum-blue-Si NPs三明治免疫复合物,实现比色信号的放大。该技术灵敏度高,检测限为44 CFU/mL。ALAMER等[52]进一步简化了实验操作步骤,构建了基于有色磁珠的可视化比色检测技术。该技术在羧基化的棉签上面修饰致病菌的抗体得到捕获探针,抗体修饰有色磁珠得到信号探针,通过夹心策略,得到“棉签-目标菌-有色磁珠”三明治免疫复合物,可检测低至10 CFU/mL的目标菌。由于该方法仅使用棉签,就可以收集和检测样品中的致病菌,因此可以利用该方法开发食源性致病菌快速筛查技术。此外,SHIN等[53]使用万古霉素修饰的蓝色聚合物纳米珠(blue-colored polymer nanobeads, NB-vanco)检测革兰氏阳性细菌。万古霉素能和革兰氏阳性细菌细胞壁上的D-丙氨酰-D-丙氨酸亚基发生多价特异性相互作用,使得NB-vanco特异性结合在革兰氏阳性致病菌表面;与致病菌的连接作用使NB-vanco聚集,然后用多孔过滤膜系统过滤掉未结合的单细菌和单珠,得到蓝色聚合物,增强了蓝色信号。该技术对致病菌的检测用时小于30 min,可以实现多种革兰氏阳性致病菌的检测,具有较强的通用性。上述技术都不需要核酸提取,细菌裂解等步骤,将样品前处理最小化,这种简单、快速、经济、轻巧的检测平台更容易应用到实时监测以及现场疾病诊断中。另外,研究人员直接利用红色的Au NPs实现了对食源性致病菌的可视化比色检测。WU等[54]利用多重交叉置换扩增技术(multiple cross displacement amplification, MCDA)和基于Au NPs的侧向层析生物传感器(lateral flow biosensor, LFB)开发了一种可快速检测单增李斯特菌的新型可视化比色检测技术。该技术首先提取单增李斯特菌种的DNA,然后以其特异性基因lmo0733为靶标,分别以5’端修饰地高辛(digoxigenin, Dig)和5’端修饰Biotin的寡核苷酸序列为交叉引物和扩增引物,在61 ℃、20 min的条件下进行多重交叉置换,得到了一条两端分别修饰Dig和Biotin的靶核苷酸链;最后进行LFB检测,LFB检测线上固定的抗地高辛抗体(Anti-Dig)能特异性地捕获靶核苷酸链,靶核苷酸链另一端的Biotin结合SA修饰的Au NPs(SA-Au NPs),形成双抗夹心复合物Anti-Dig-靶核苷酸链-Au NPs,该复合物堆叠在检测线上,聚集了大量的红色Au NPs,产生一条红色条带。为了控制条带的正常功能,检测线后端控制线上固定的生物素化的牛血清白蛋白也会和SA-Au NPs结合,此时,LFB上面显示2条红线为阳性。反之,若不存在靶核苷酸序列,则LFB上面只有1条红线。该技术灵敏度较高可检测低至10 fg的目标致病菌DNA产物,整个过程可在1 h内完成。
此外,SUAIFAN和ALHOGAIL等[55-57]利用食源性致病菌蛋白酶特异性水解多肽的原理设计了一种新型可视化比色传感器。该技术首先将镀金的自粘片堆叠在塑料条上面,随后将表面修饰有特定肽链的MNPs通过共价作用固定在金表面,得到金-多肽-MNPs复合物,表面呈黑色;然后在复合物下方2~3 mm的背面固定圆形永磁纸,在目标致病菌存在时,该致病菌产生的蛋白酶可水解相应的多肽,使得MNPs脱离镀金自粘片,从而呈现出金原本的颜色,随着目标致病菌浓度的增大,金的颜色增强,从而达到对致病菌可视化比色检测的目的。该技术可以检测多种食源性致病菌,对E.coliO157∶H7的检测限为12 CFU/mL,对金黄色葡萄球菌的检测限为7 CFU/mL,对单增李斯特菌的检测限为2.17×102CFU/mL,整个检测过程可在30 s内完成。
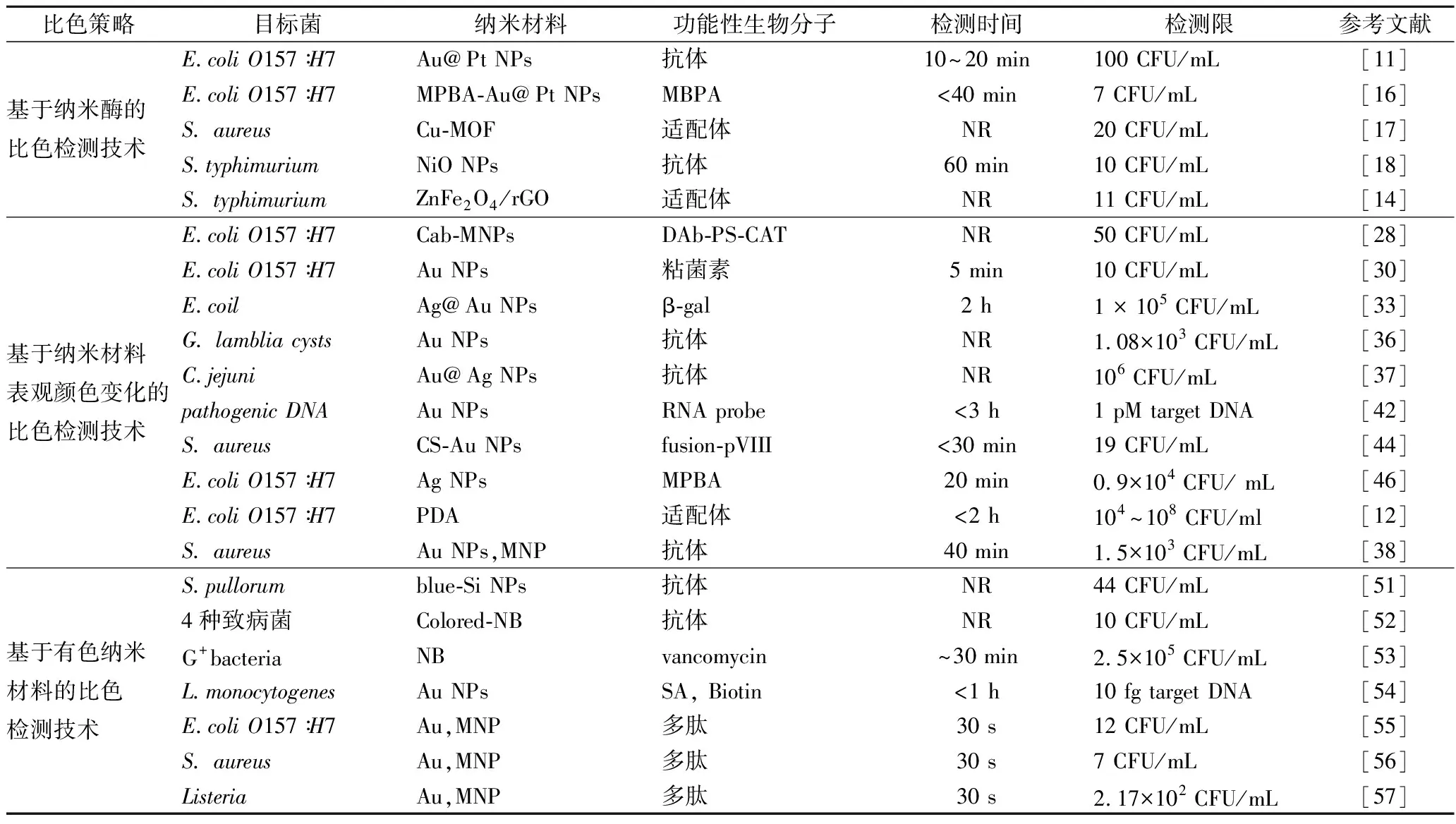
表1 基于纳米材料的可视化比色检测技术在食源性致病菌检测中的应用Table 1 Application of visual colorimetric detection techniques based on nanomaterials in the detection offoodborne pathogenic bacteria
注:NR,未见报道。
3 总结与展望
开发高效、快速、简单、灵敏的食源性致病菌检测技术对保障食品安全具有重要的意义。与传统方法相比,基于纳米材料的可视化比色检测技术具有得天独厚的优势。一些纳米材料具有类似过氧化物酶的活性,可催化H2O2氧化TMB、ABTS、OPD生成蓝色、绿色和黄色的氧化产物;一些纳米材料,如贵金属纳米粒子、聚合物纳米粒子等,在表面性质发生改变后会发生相应的颜色变化;还有一些自身具有明艳色彩的纳米材料,可通过特异性结合在食源性致病菌的表面实现比色信号的放大。基于纳米材料的可视化比色检测技术具有独特的优势,被广泛应用于构建可视化比色检测技术。
随着基于纳米材料的可视化比色检测技术的发展,还有一些问题需要完善解决。在今后构建基于纳米材料的可视化比色快检技术中,还需要注意以下几个问题:
(1)需要进一步控制纳米材料的大小和形状,以达到对其性能的优化。通常减小纳米颗粒的尺寸会增大纳米颗粒的比表面积,从而提高纳米酶的催化活性;改善纳米材料的形状有利于调节纳米材料的消光截面,提高纳米材料的消光系数,可优化纳米材料的比色性能。
(2)生物识别元素(如:DNA/RNA适配体、抗体、抗生素、噬菌体等)标记的纳米材料在可视化比色检测中运用较为普遍,但是这种标记方法耗时耗力,大大降低了方法的实用性。开发无标记可视化比色检测技术,促使生物受体在纳米材料的合成过程中杂交或结合在纳米材料上,将成为未来研发重点之一。
(3)在食品安全分析中,对于食源性致病菌的检测需要分析方法简单、快速、准确,现场快速检测技术的开发是今后的重点研发方向。因此,简单高效的“一步检测”将会愈发受到研究者们的欢迎。
(4)可视化比色检测技术往往存在灵敏度不够,无法进行痕量分析的缺点。结合信号扩增技术可大大提高可视化比色检测技术的灵敏度。目前的信号扩增技术包括杂交链式反应法、链置换法、环介导等温扩增技术、酶切法、级联催化法等。
总之,随着纳米技术的发展,基于纳米材料的可视化比色检测技术将会朝着更加轻巧、灵敏、高效、特异、低成本的方向发展,更多地被运用到现场检测当中。

