典型甜菊糖苷的抗氧化和抗炎活性
张童童,隋晓辰,夏咏梅,Khaing zar myint,陈俊名,刘 湘
(江南大学化学与材料工程学院,食品科学与技术国家重点实验室,江苏无锡 214122)
甜菊提取物主要由甜菊糖苷和很少量(一般质量分数小于5%)的多酚、黄酮和单宁等组成。甜菊提取物如甜菊糖苷现已被用于各种食品,如软饮料、水果、巧克力、酱油、口香糖、酸奶等[1]。随着甜菊糖苷应用的迅速开展,甜菊提取物的抗氧化活性和抗炎活性也受到进一步关注。文献中通常用体外自由基清除能力衡量甜菊提取物的抗氧化活性,用脂多糖(LPS)刺激生长的巨噬细胞Raw264.7作为体外炎症模型表征其抗炎活性。但是,由于文献报道的甜菊提取物样品和研究对象的多样性,对甜菊提取物的抗氧化活性和抗炎活性的认识很难统一;因此需要提供进一步的依据来判别甜菊提取物中何种成分具有抗氧化活性和抗炎活性。
目前文献中大都采用混合甜菊提取物为原料考察相应的抗氧化性。以甜菊糖苷为研究样品时,López等[2]研究证明斯替夫苷在体外不具备抗氧化性,但有文献报道甜菊糖苷在机体内有很好的抗氧化性,例如,甜叶菊茎秆的热水提取物可防止鱼油的氧化[3];甜叶菊的超临界二氧化碳、甲醇水溶液提取物可抑制鲑鱼酱的脂质氧化[4]。在大鼠心脏成纤维细胞中,以斯替夫苷和莱鲍迪苷A为主要成分的混合甜菊糖苷,可增加细胞内还原型谷胱甘肽含量及超氧化物歧化酶和过氧化氢酶的活性[5],从而降低了氧化应激效应。在小麦植株成长过程中,用10-8mol/L的斯替夫苷溶液浇灌植株,发现相比对照组,植物体内过氧化氢酶酶活受重金属污染物的影响减弱很多[6]。当以含多酚和甜菊糖苷的甜菊提取物为研究样品时,同样发现其在体外具有一定抗氧化能力。例如López等[2]考察了0~250 μg/mL甜叶菊乙醇提取物(SREE)清除DPPH自由基和超氧化物自由基的能力,当浓度达到250 μg/mL时,SREE的DPPH自由基和超氧化物自由基清除率分别为90%和81%。在抗炎方面,Boonkaewwan等[7-8]发现1 mmol/L的斯替夫苷可显著抑制脂多糖(LPS)诱导的TNF-α和IL-1β的释放;斯替夫苷及其代谢产物甜菊醇还可通过IκBα/NF-κB信号通路影响细胞介素基因的表达,从而减弱LPS诱导的促炎性细胞介素的产生。Choi等[9]发现在LPS刺激的RAW264.7中,250 μmol/L的莱鲍迪苷A可能通过MAPK和NF-κB抑制炎症反应。
以上对甜叶菊提取物抗氧化性的研究中,采用的甜叶菊提取物样品多为甜菊糖苷混合的粗品,因而可能含有其它脂溶性混合物,例如多酚、黄酮和缩合单宁等抗氧化剂或具有抗炎作用的化合物[3,10],而对甜菊糖苷缺乏研究,更无法根据现有研究结果对甜菊糖苷的抗氧化或抗炎作用进行系统比较。本文拟系统考察代表性甜菊糖苷及其代谢产物清除DPPH和ABTS自由基的能力,初步探讨甜菊糖苷结构的不同对其清除自由基能力的影响,并以脂多糖(LPS)刺激生长的巨噬细胞Raw264.7作为体外炎症模型,考察上述甜菊化合物的抗炎作用,以期为甜菊糖苷的使用提供参考。
1 材料与方法
1.1 材料与仪器
斯替夫苷(St,97% HPLC)、莱鲍迪苷A(RA,99% HPLC) 常州牛塘化工有限公司;莱鲍迪苷C(RC,85% HPLC) 青岛GLG生命科技集团;悬钩子苷[11](Ru,96% HPLC)、甜菊醇双糖苷[12](Sbio,99% HPLC)、甜菊醇[13](Ste,99% HPLC)、异甜菊醇[14](Isoste,98% HPLC) 自制;葡萄糖基甜菊糖苷(St-glu,各组分峰面积百分比分别为:St 11.23%,RA 4.68%,单葡萄糖基斯替夫苷37.52%,二葡萄糖基斯替夫苷10.73%,单葡萄糖基瑞鲍迪苷A 35.83%) 韩国国立全南大学功能性糖酶和微生物基因组学实验室赠送;甜菊酚(43% HPLC,还原糖20%,水分4.6%,甜菊糖苷0.13%) 诸城浩天药业有限公司;胰蛋白酶(2500 U/mg,BR) 国药集团化学试剂有限公司;DMEM培养基(高糖) 美国Gibco公司;胎牛血清 杭州四季青有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) GR,上海华蓝科技有限公司;噻唑蓝(MTT)、青霉素-链霉素溶液(100 μg/mL链霉素和100 U/mL青霉素) 上海碧云天生物技术有限公司;脂多糖(LPS) 美国Sigma公司;96孔细胞培养板 美国Costar公司;细胞刮刀 美国Corning公司;鼠巨噬细胞Raw264.7(ATCC TIB-71) 中国科学院细胞所;95%乙醇、二甲基亚砜、碳酸氢钠、氢氧化钠、浓盐酸、乙二胺四乙酸二钠、亚硝酸钠、浓磷酸、对氨基苯磺酸、N-1-萘乙二胺盐酸盐 AR,国药集团化学试剂有限公司;Griess A试剂:用三蒸水充分溶解无水对氨基苯磺酸1.0 g和浓磷酸(85%)6 mL,定容至100 mL;Griess B试剂:用三蒸水充分溶解N-1-萘乙二胺盐酸盐0.1 g,定容至100 mL;脂多糖(LPS)溶液:用三蒸水配制1 mg/mL的LPS储备液,用0.22 μm无菌过滤器过滤除菌,再用无菌的PBS溶液稀释成100 μg/mL的工作用液,4 ℃避光保存,临用时用DMEM培养基稀释到1 μg/mL。
3111二氧化碳培养箱 美国Thermo Epectron Corporation;XDS-1A倒置显微镜 上海精密仪器仪表有限公司;SW-CJ-2PD双人单面净化工作台 苏州净化设备有限公司;HH-4恒温水浴锅 江苏金坛市宏华仪器厂;MM-I微量振荡器 上海精科实业有限公司;μQuant酶标仪 美国Bio-Tek公司。
1.2 实验方法
1.2.1 甜菊糖苷抗氧化活性的测定 分别测定1 mg/mL待测样品对DPPH·和·OH的清除率,并进一步测定了2~20 mg/mL甜菊双糖苷、甜菊醇和异甜菊醇对DPPH·清除率的影响及悬钩子苷对·OH清除率的影响。分别测定1 mg/mL甜菊酚(含量43%)和VC(99%)的DPPH·和ABTS+·清除率。
1.2.1.1 DPPH·清除率测定 将1 mL待测样品(1 mg/mL)加入3 mL的DPPH溶液(0.25 mg/mL)中,在30 ℃水浴中避光反应30 min,在517 nm处测定样品所对应的吸光值。根据DPPH标准曲线计算出样品中DPPH的含量,按照式2计算出样品对DPPH·的清除率[15]。
DPPH·的清除率(%)=(1-C样品/C空白)×100
式(1)
式中,空白对照样品中用水代替甜菊糖苷溶液,C样品-样品中DPPH含量,C空白-空白DPPH含量。
1.2.1.2 ·OH清除率测定 取1 mL 6.57×10-3mol/L FeSO4水溶液,2 mL 0.24 mg/mL水杨酸乙醇溶液,取 1 mg/mL的待测样品2 mL于15 mL具塞试管中,空白用水代替,在37 ℃水浴中预热30 min,加入引发剂1 mL 0.01 mol/L H2O2,在37 ℃水浴中反应40 min,在510 nm处测定不同样品所对应的吸光值,按照式3计算样品对·OH的清除率[16]。
·OH的清除率(%)=(1-A样品/A空白)×100
式(2)
式中,A样品-样品的吸光度,A空白-空白的吸光度。
1.2.1.3 ABTS+·清除率测定 称取0.0768 g ABTS和0.0133 g过硫酸钾溶解于10 mL pH7的PBS缓冲液(4.5×10-3mol/L)中,25 ℃避光孵育12 h得ABTS+·溶液。用乙醇将上述溶液稀释至414 nm吸光度为1.50。取0.6 mL待测样品加入至4 mL稀释的ABTS+·溶液中测量其414 nm处吸光度[17]。
ABTS+·的清除率(%)=(1-A样品/A空白)×100
式(3)
式中,A样品-样品的吸光度,A空白-空白的吸光度。
1.2.2 甜菊糖苷抗炎活性的测定
1.2.2.1 鼠巨噬细胞Raw264.7的培养 将细胞接种于含100 U/mL青霉素、100 mg/mL链霉素和10%的胎牛血清的DMEM高糖培养基中,置于37 ℃、5% CO2培养箱中培养。
1.2.2.2 MTT法检测甜菊糖苷对Raw264.7细胞增殖的影响 在有无LPS存在(1 μg/mL)的情况下,分别检测甜菊糖苷对Raw 264.7细胞增殖的影响。用细胞刮刀刮取对数生长期的细胞,用0.25%胰蛋白酶37 ℃消化5 min,调节细胞浓度至5×104个/mL。将细胞接种于96孔板中,每孔100 μL,置于37 ℃、5% CO2培养箱中培养至细胞长至对数生长期。吸弃上清液,加入用培养基配制的25~250 μg/mL甜菊糖苷溶液150 μL(其中甜菊醇双糖苷、甜菊醇、异甜菊醇用含有0.5% DMSO的培养基配制),空白以新培养基或者含有0.5% DMSO的新培养基替代,每个样品设6个复孔。将加药后的96孔板于37 ℃、5% CO2培养箱中培养48 h。每孔加入0.5 mg/mL MTT溶液100 μL,37 ℃培养4 h,吸弃上清液,每孔加入150 μL DMSO,在微量振荡器上振荡10 min,用酶标仪在570 nm下测定每孔所对应的吸光度,计算细胞存活率。
细胞存活率(%)=(A实验组/A对照组)×100
式(4)
式中,A实验组-药物作用后样品的吸光度,A对照组-未经药物作用样品的吸光度。
1.2.2.3 Griess法检测甜菊糖苷对Raw264.7细胞的NO的释放量 取对数生长期的Raw264.7细胞,用细胞刮刀刮取细胞,调节细胞浓度至5×105个/mL。将细胞接种于96孔板中,每孔100 μL,置于37 ℃、5% CO2培养箱中培养至细胞长至对数生长期。吸弃上清液,加150 μL药品,药品设置空白组、LPS组(1 μg/mL)、药品组和LPS+药品组,每个样品设6个复孔。将加药后的96孔板于37 ℃、5% CO2培养箱中培养24 h。取每孔上清液加入50 μL Griess A试剂,在微量振荡器上振荡数次,于37 ℃培养箱中反应10 min,再向各孔中加入50 μL Griess B试剂,在微量振荡器上振荡数次,于37 ℃培养箱中反应10 min,用酶标仪在540 nm波长下测定各孔所对应的吸光度值,根据NO标准曲线y=0.0211x(R2=0.9991)计算NO的含量。
1.3 数据处理
每个样品设3个平行,采用Excel 2016软件进行数据分析。测定结果以平均值±标准差表示。
2 结果与分析
2.1 甜菊化合物的体外抗氧化性
2.1.1 甜菊糖苷的体外抗氧化性 本实验选取一系列甜菊化合物研究其抗氧化活性(图1)。所选择的甜菊糖苷中,甜菊醇苷元上糖基取代基数量依次为:莱鲍迪苷A(RA)、莱鲍迪苷C(RC)>斯替夫苷(St)>悬钩子苷(RU)>甜菊醇双糖苷(Sbio)>甜菊醇(Ste)、异甜菊醇(Isoste)。RU、St、RA和St-glu等在C19位上有一个葡萄糖基,C13位上的葡萄糖基团则依次增多;而Sbio、Ste和Isoste的共同点是其C19位无葡萄糖基,以羧酸形式存在。一般认为,多羟基化合物如多糖具有一定还原能力或DPPH·清除力[18-20],因此若羟基在清除自由基中起主要作用,推测糖基取代基数量多的样品应该具备稍强的清除自由基能力。

图1 甜菊糖苷对DPPH·和·OH的清除率
如图1A所示,多葡萄糖基的甜菊糖苷清除DPPH·的能力很弱,这与López等[2]认为斯替夫苷无DPPH·清除能力相符,而Sbio、Ste和Isoste的DPPH·清除能力相对较强,并呈浓度依赖关系(图1B)。因此葡萄糖基的增加没有明显影响清除DPPH·的能力,这说明甜菊化合物的DPPH·清除能力不是由羟基主导的。图1C则表明甜菊糖苷清除·OH较弱且无明显的构效关系,其中RU清除·OH的能力较强并呈浓度依赖关系(图1D)。López等[2]研究发现St在体外不具备DPPH·和超氧自由基的清除能力,这与本文研究发现甜菊提取物中主要甜菊糖苷清除DPPH·的能力较弱一致。
2.1.2 甜菊酚的体外抗氧化性 由2.1.1结果可知甜菊糖苷清除·OH的能力较弱,清除DPPH·的能力与其结构相关,而且甜菊提取物中主要甜菊糖苷清除DPPH·的能力并不强。而López选用的甜叶菊乙醇提取物含有28 wt%的甜菊糖苷(全部折算成St)和2.2 wt%的多酚[2],250 μg/mL下甜叶菊提取物和VC两者的DPPH·清除能力接近的结果。为了研究文献中甜菊提取物自由基清除能力的来由,实验以VC对照,测定了相同质量浓度(1 mg/mL)甜菊酚(含量43%)的DPPH·和ABTS+·清除率(图2)。

图2 粗甜菊酚的自由基清除率
图2中43%的粗甜菊酚即表现出与VC接近的DPPH·清除率;以净物质计算,甜菊酚的DPPH·清除率可能达到VC的2倍,ABTS+·清除率则略低于VC;Can等[21]用DPPH和ABTS法测得甜叶菊甲醇提取物的半清除率分别介于0.533~0.398 mg/mL和6.637~17.382 mg/mL之间,本研究结果与Can的实验结果趋势一致。由此可见,文献报道的甜菊提取物的抗氧化性应该主要是由于其中的甜菊酚产生的[2],但考虑到López的样品中如此低的甜菊酚含量(总酚2.2 wt%),以及他们报道的St没有自由基清除能力的实验结果,那么或许也存在组分间相互作用的结果。另一方面,Yu等[3]起初也认为他们获得的甜菊热水提取物中总酚含量很低,提取物对鱼油的氧化抑制应该不来自于甜菊酚,但是通过进一步的实验发现,其中抗氧化性最强的仍然是一种甜菊酚,只是它的DPPH·清除率也不高。
2.2 甜菊糖苷的抗炎作用
2.2.1 甜菊糖苷对鼠巨噬细胞Raw264.7的作用 本研究先以LPS刺激鼠巨噬细胞Raw264.7生长,以较高浓度(250 μg/mL)的甜菊糖苷考察其对Raw264.7的细胞毒性,同时初步确定无细胞毒性的甜菊糖苷浓度范围,再以此浓度考察甜菊糖苷对鼠巨噬细胞Raw264.7的抗炎效果。
如图3所示,在有LPS与无LPS的条件下,除Sbio、Ste、Isoste以外,浓度为250 μg/mL的其余5种甜菊糖苷处理后的Raw264.7的存活率大都在100%左右,细胞毒性等级为0级。图3的结果表明,由于Sbio、Ste和Isoste相对其它五种甜菊糖苷的最大结构差异是其C19位无葡萄糖基,以羧酸形式存在,因此其细胞毒性可能与此羧基有关。
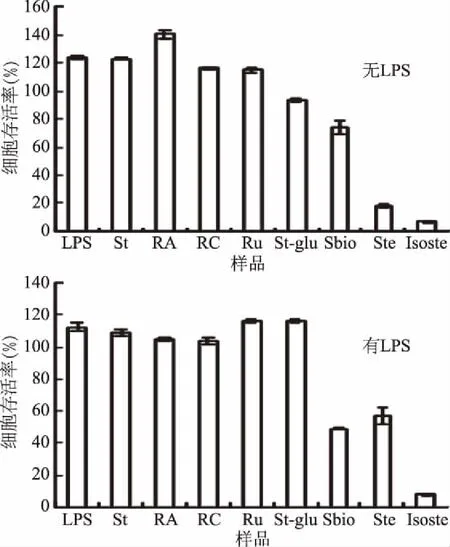
图3 甜菊糖苷对Raw264.7细胞存活率的影响
另一方面,实验进一步考察了不同浓度Sbio、Ste、Isoste对的Raw264.7的存活率的影响,结果如图4所示。在有LPS与无LPS的条件下,Raw264.7的存活率与Sbio、Ste、Isoste的浓度呈负相关,且上述两种条件下0~100 μg/mL的Sbio、Ste和Isoste处理的细胞存活率均仍然接近100%且三者均呈浓度依赖关系。而目前研究中Boonkaewwan[7-8,22-23]考察了1 mmol/L的St对几种炎症细胞的作用;发现1 mmol/L的St可显著抑制脂多糖(LPS)诱导的TNF-α和IL-1β的释放;St及Ste抗炎的机制是通过IκBα/NF-κB信号通路影响细胞介素基因的表达,从而减弱LPS诱导的促炎性细胞介素的产生。进一步地,Li等[24]研究了St对Raw264.7抗炎作用及其信号通路,发现St对Raw264.7的抗炎作用并不明显,但其作用机制和Boonkaewwan报导的抗炎作用机制是基本一致的,主要原因在于两者实验中的St最高剂量相差4倍之多。由此可知,Li等[24]在研究St对Raw264.7抗炎作用时使用的剂量(50~200 μg/mL)是合理的,但其仅测定了St的抗炎作用,因此本文进一步考察了几种典型甜菊糖苷的抗炎作用。

图4 Sbio、Ste、Isoste对鼠巨噬细胞Raw264.7存活率的影响
2.2.2 甜菊糖苷对Raw264.7细胞NO释放量的影响 如图5所示,Raw264.7在未被脂多糖刺激时,也会产生少量的NO(<5 μmol/L),但被脂多糖刺激后,NO的产生量上升到15~20 μmol/L左右,这说明脂多糖刺激鼠巨噬细胞Raw 264.7引起了急性炎症反应。相对于空白对照,6种甜菊糖苷对未被脂多糖刺激的Raw264.7细胞NO的产生量没有影响,说明甜菊糖苷不会诱导NO的产生,即本身不会引起炎症反应。但对于被脂多糖刺激的Raw264.7细胞,6种甜菊糖苷随着浓度的增大会不同程度的抑制NO的产生,只是除了Isoste外,其它几种物质的影响都较低。异甜菊醇随着浓度增大,NO的产生量逐渐降低,相对于脂多糖刺激后产生的NO含量,100 μg/mL时降低了约30.7%,这说明异甜菊醇对LPS刺激产生的炎症模型,具有相对较好的抗炎效果。

图5 甜菊糖苷对鼠巨噬细胞Raw264.7的NO释放量的影响
3 结论
低浓度下(5 mg/mL),RU、St、RA和St-glc对DPPH·的清除率为VC的1.18%~1.69%,而Sbio、Ste和Isoste较其它几种物质对DPPH·的清除能力相对稍强,其DPPH·的清除率是上述有甜味甜菊糖苷的4~6倍,清除DPPH·的能力与C13和C19位上葡萄糖基的个数或者糖基种类无关,可能与C19和C13位上连接的官能团不同有关,其中Sbio、Ste和Isoste C19均为羧基,由此可推羧基可能有助于清除DPPH·。但所试验的甜菊化合物对ABTS+·的清除能力都弱,且没有结构相关性。简言之,甜菊糖苷对两种自由基的清除能力都较弱,但作为甜味剂使用的同时,能兼具一定的抗氧化活性。因此文献中甜菊提取物的抗氧化性应该主要是由于样品中的可能存在的甜菊酚产生的;除此之外,甜菊提取物中的甜菊糖苷在体内外表达的抗氧化性可能与自由基清除以外的通路有关。
250 μg/mL的St、RA、RC、RU和St-glu对鼠巨噬细胞Raw264.7均无细胞毒性,Sbio、Ste、Isoste对Raw264.7细胞的存活率呈浓度依赖关系。以1 μg/mL脂多糖刺激鼠巨噬细胞Raw264.7建立炎症模型,考察6种甜菊糖苷的抗炎活性。发现6种甜菊糖苷对未被LPS刺激的Raw264.7细胞NO的产生量没有影响,说明甜菊糖苷不会诱导NO的产生,即本身不会引起炎症反应。而对被LPS刺激的Raw264.7细胞,6种甜菊糖苷随着浓度的增大会不同程度的抑制NO的产生量,除了Isoste外,其它几种物质的抑制作用都较低。Isoste随着浓度增大,所诱导的NO产生量逐渐降低,相对于LPS刺激后NO的产生量,100 μg/mL的异甜菊醇对NO的产生量降低了约30.7%。因此在所试验的甜菊化合物中,Isoste是一种相对较好的抗炎药物。

