鲍鱼内脏蛋白的提取及水解肽的抗氧化活性研究
梁 杰,赵晓旭,汪秀妹,杨志强,汪少芸
(1.莆田学院环境与生物工程学院,福建省新型污染物生态毒理效应与控制重点实验室,福建莆田 351100;2.福州大学生物科学与工程学院,福建福州 350108)
生物活性肽具有抗菌[1]、抗氧化[2-3]、抗心血管疾病[4]、抗癌[5]、神经保护活性[6]、抗炎症[7]、抑制肥胖[8]等多种生理功能[9-12]。海洋生物因为生活环境与陆地环境的巨大差异(低温、高压、高盐度、避光、低氧)而具有结构奇特、功能特殊的生物学特性。鲍鱼(Abalone)是一种营养价值和药用价值较为全面的优质动物蛋白,由于其高蛋白、低脂肪、低胆固醇的特点,加上滋味鲜美的口感,素有“海味之冠”的美誉[13]。我国海域辽阔,鲍鱼资源丰富,近十年养殖增长率高达54.68%,2016年养殖产量已达13.97万吨,其中福建省鲍鱼产量约占全国鲍鱼产量80%[14-15]。除鲜活鲍鱼外,罐头鲍鱼、干鲍鱼是鲍鱼目前的主要销售方式,鲍鱼加工企业在生产过程中产生大量的内脏下脚料,造成环境污染。内脏主要包括性腺、消化腺、胃等器官,内脏约占鲍鱼体重的20%~30%,其中含有丰富的蛋白质、氨基酸、脂质、维生素、多糖和矿物质等,具有较高的研发价值[15]。目前鲍鱼内脏的主要加工方法是简单加工成饲料、鱼粉,没有对其营养价值进行充分开发利用。相关研究证实,鲍鱼内脏蛋白具有一定的抗氧化能力,说明其中含有抗氧化能力的氨基酸序列和活性物质[16]。
本文以鲍鱼加工下脚料鲍鱼脏器为原料,以蛋白提取率为指标,通过响应面法优化提取内脏蛋白,以水解度和抗氧化能力为指标对蛋白进行酶解,筛选最适工具酶,进一步对水解肽进行抗氧化性质测定及应用研究,为开发海洋生物源抗氧化肽提供理论依据。
1 材料与方法
1.1 材料与仪器
鲍鱼脏器 福建莆田汇丰食品加工有限公司提供;酸性蛋白酶(2.4×104U/mL)、中性蛋白酶(1.3×105U/mL)、碱性蛋白酶(1.9×105U/mL)、木瓜蛋白酶(1.1×105U/mL)、复合蛋白酶(2.1×105U/mL) 诺维信(中国)生物技术有限公司;2,6-二叔丁基-4-甲基苯酚 分析纯,美国Sigma;牛血清蛋白、考马斯亮蓝G-250、盐酸、氢氧化钠、三氯乙酸、1,1-二苯基-2-三硝基苯肼、甲醇 分析纯,国药集团化学试剂有限公司。
FD-1B-55型冷冻干燥机 北京博医康实验仪器公司;UV2550紫外/可见分光光度计 日本岛津;DHG-9030A电热恒温鼓风干燥箱 上海精宏;MDF-U333型超低温冰箱 日本三洋;PB-10型精密数显酸度计 赛多利斯;3-18K冷冻离心机 德国SIGMA;BS-100A自动部份收集器 上海沪西分析仪器厂有限公司;FS-450台式数控超声波处理仪 上海生析超声。
1.2 实验方法
1.2.1 鲍鱼脏器蛋白提取工艺
1.2.1.1 提取工艺 将鲍鱼内脏置于-18 ℃低温冰箱冷藏,取适量置于组织捣碎机充分匀浆,冷冻干燥后密封备用,称取一定质量内脏于一定浓度NaOH中充分搅拌后,置于超声波处理器中(150 W)浸提,充分反应后,以10000 r/min将抽提液离心30 min取上清;不断搅拌并向体系中加入1 mol/L盐酸溶液,对体系pH实时抽测,调节pH,放置于层析冷柜中(4 ℃)静置30 min后,蛋白质充分凝集形成沉淀,10000 r/min离心10 min,弃上清液,反复使用去离子水水洗沉淀至pH为7.0,将沉淀蛋白质冷冻干燥至恒重,得到蛋白质冻干粉,-20 ℃冷藏备用。
1.2.1.2 提取蛋白单因素实验 以蛋白提取率为评价指标,固定初始条件设置为:碱浓度1.0%,超声波时间15 min,提取时间30 min,料液比1∶10 g/mL,提取温度40 ℃,分别考察碱浓度(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%)、超声波时间(5、10、15、20、25 min)、提取时间(超声后10、20、30、40、50、60 min)、料液比(1∶6、1∶8、1∶10、1∶12、1∶14、1∶16、1∶18、1∶20、1∶22 (g/mL))、提取温度(50、60、70、80、90 ℃)等条件对鲍鱼脏器蛋白提取效果的影响,每个因素的最佳水平带入下个因素进行实验,确定各因素的适宜范围。
1.2.1.3 响应面试验的设计 通过分析单因素实验,选取对提取率影响较为显著的因素:碱浓度,超声波时间,提取时间,提取温度,通过Design-Expert 8.0软件Box-Behnken方法,以蛋白质提取率为响应值设计响应面优化实验。因素水平及编码表1所示:
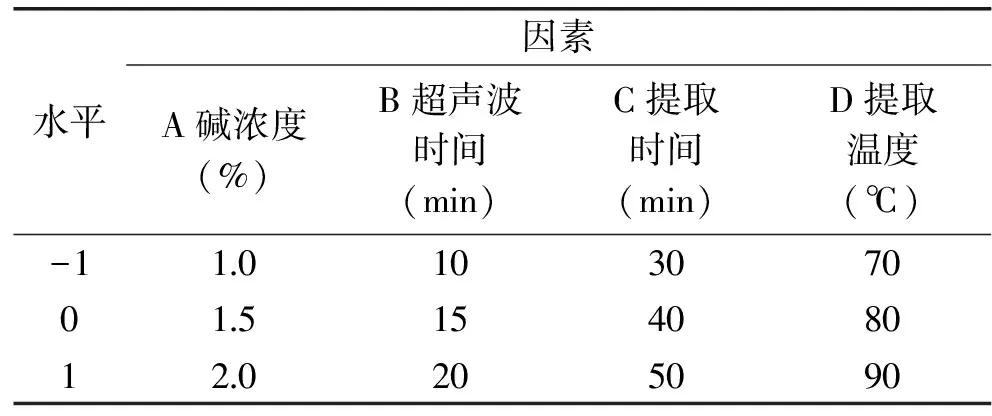
表1 试验设计因素及编码水平Table 1 Factors and levels of experimental design
1.2.1.4 粗蛋白沉淀的pH范围确定 参考文献[17]的方法,以蛋白沉淀率为指标,取蛋白提取上清液,用HCl调节pH至2.5、3.0、3.5、4.0、4.5、5.0、5.5,层析冷柜4 ℃下静置30 min后,蛋白质充分凝集形成沉淀,10000 r/min离心10 min,弃上清液,水洗沉淀至pH为7.0,冷冻干燥至恒重。
式(1)
1.2.1.5 鲍鱼脏器蛋白提取率的测定 鲍鱼脏器总蛋白含量的测定采用凯氏定氮法,碱提取液中蛋白含量测定采用Bradford法测定。得到蛋白质含量标准曲线回归方程:蛋白质含量(μg/mL)=(A595-0.0051)/0.0056,R2=0.9984,提取率计算公式如下:
蛋白质提取率(%)=提取液中蛋白质含量×100/鲍鱼脏器总蛋白含量
式(2)
1.2.2 水解肽制备工艺优化
1.2.2.1 最适蛋白酶的筛选 选取五种蛋白酶,对蛋白进行酶解,以DPPH自由基和OH·自由基清除率和水解度(DH)为指标评价酶解效果,筛选最适蛋白酶;各酶的最适条件见表2。反应条件设置为:蛋白冻干粉用去离子水配制为浓度为2%(w/v),酶活力800 U/g,酶解pH、温度分别在各酶的最适条件下,恒温水浴震荡反应一定时间,水解至终点沸水浴灭酶10 min,冷却后以10000 r/min离心10 min,收集上清液,进行水解度和DPPH自由基和OH·自由基清除活力的分析测定。
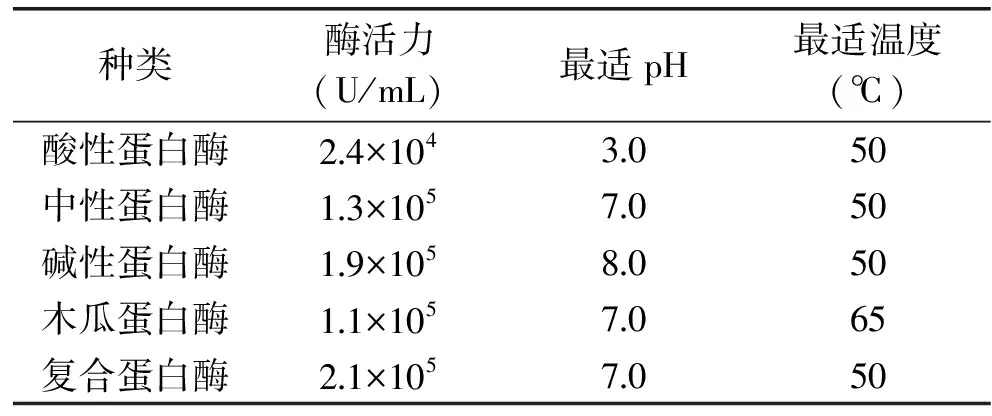
表2 蛋白酶最适pH和温度Table 2 Suitable hydrolysis pH value and temperature for proteases
1.2.2.2 DPPH自由基清除率的测定 参照文献[18]的方法测定DPPH自由基清除率。用95%乙醇配制0.1 mmol/L的DPPH溶液,避光冷藏,将待测样品稀释10倍;将2 mL测试样品溶液与2 mL DPPH溶液加入到同一试管中,摇匀后进行避光反应,静置30 min后,测定波长517 nm处吸光值Ai;同时测定2 mL DPPH溶液与2 mL溶剂(去离子水)混合后的吸光度A0,以及2 mL测试样品溶液与2 mL 95%乙醇混合后的吸光度Aj。计算公式如下:

式(3)
1.2.2.3 水解度的测定 采用甲醛滴定法参照文献[19-20]测蛋白质水解度。量取蛋白酶解液5 mL并加入60 mL蒸馏水充分混合均匀,采用0.2 mol/L标准NaOH溶液调节酶解至pH8.2,再加入pH8.2的甲醛溶液20 mL,最后用0.1 mol/L标准NaOH溶液标定,记录pH至9.2时所消耗的标准NaOH溶液的体积。计算公式:

式(4)
式中:ΔV:滴定样品与蛋白原液所消耗的标准NaOH溶液体积差;C:NaOH标准溶液浓度,mol/L;W:原料克数,g;Vtot:酶解液的总体积,mL;V:滴定所用的酶解液体积,mL;n0:水解前每克蛋白游离的氨基毫摩尔数,mmol/g;n:水解后每克蛋白游离的氨基毫摩尔数,mmol/g;htot:原料蛋白质中所含肽键总数,mmol/g;Pro%:样品的蛋白质含量;110:氨基酸平均分子量。
1.2.2.4 OH·自由基清除率的测定 参照文献[21]的方法测定OH·自由基清除率。依次准确移取5 mL 2 mmol/L FeSO4溶液和5 mL 6 mmol/L过氧化氢溶液,混合均匀后用6 mmol/L水杨酸溶液定容于25 mL容量瓶刻度处,摇匀后快速在510 nm处测定A0值。在反应体系中加入1 mL酶解液,摇匀后立即测定As值。计算公式如下:

式(5)
1.2.2.5 还原力的测定 采用铁氰化钾法参照文献[22]测定还原力。在不同浓度样品各1 mL(空白对照用1 mL去离子水代替),依次加入2.5 mL 1%的铁氰化钾溶液和2.5 mL 0.2 mol/L的磷酸盐缓冲液(pH6.6),摇匀后放入已设置好50 ℃恒温水锅内,充分反应20 min,然后加入2.5 mL 10%的三氯乙酸(TCA)溶液,混匀后以3000 r/min的速率离心分离10 min,取2.5 mL上清液于另一试管中,加入2.5 mL去离子水和2.5 mL 0.1%的FeCl3,混匀后静置,充分反应10 min后产生蓝色沉淀,用紫外分光光度计测定700 nm波长处吸光值,吸光值与样品的还原能力有关,蓝色沉淀越多则溶液的吸光值越大,该样品的还原能力越强。
1.2.3 水解肽的分离纯化及应用研究
1.2.3.1 水解肽的分离纯化 将酶解液冻干粉用去离子水复溶后上样到处理妥当的Sephadex G-50(Φ2.5×200 cm)凝胶过滤层析柱上,自动部份收集器设置流速:0.3 mL/min,10 min/管;检测波长:214 nm,收集洗脱液绘制洗脱曲线。收集各组分后浓缩冻干,用磷酸盐缓冲液(pH7.4)配制成浓度为2.0 mg/mL,参照1.2.2方法,依次考察各组分羟基自由基清除能力、DPPH自由基清除能力及还原力,并与未分离的酶解液冻干粉原液对比。
1.2.3.2 水解肽的抗氧化应用研究 选择市售新鲜猪肉和猪肥膘肉味原料(质量比4∶1)500 g,并用绞肉机绞碎至5 mm大小,加入12 g食盐并充分斩拌均匀,此为基础配方。添加抗氧化剂后继续搅拌均匀,置于4 ℃冰箱中冷藏备用。
预处理:①在处理过的猪肉中添加抗氧化肽,添加量分别为:0.1%、0.5%、1.0%,混合均匀后置于4 ℃冷藏,测定样品在2、4、6、8、10、12、14 d时的POV和TBA值,研究抗氧化肽在不同添加量情况下对猪肉制品脂肪氧化的影响;②在预处理过的猪肉样品中依次添加抗氧化剂0.02% VC(VC用少量去离子水溶解)、0.02% BHT及不添加任何抗氧化剂的样品对照组,混合均匀后置于4 ℃冷藏,测定样品在3、6、9、12、15 d时的POV和TBA值,将抗氧化肽与其他抗氧化剂的抗氧化能力作比较[23]。
过氧化值(POV)的测定:参照闫文杰等[24]的方法,取10 g冷藏肉块放入三角瓶中,并准确量取300 mL CM液(氯仿∶甲醇=2∶1,v/v)加入三角瓶,充分震荡后抽提1.5 h并进行过滤,往滤液中入2/5体积1% NaCl溶液,静置分层后,下层为脂肪提取液,将提取液置于用旋转蒸发器设置40 ℃水浴蒸发浓缩,得到脂肪。油脂过氧化物值(POV)按照国家规定的GB/T 5009.37-2003方法进行测定。计算公式如下:
式(6)
式中:X:样品所含过氧化值的量,meq/kg;C:样品中铁的含量,μg;C0:对照组铁的含量,μg;m:样品质量,μg;V1:样品被稀释后的体积,mL;V2:测定时量取的样品体积,mL;55.84:铁元素的原子量;2:换算因子。
硫代巴比妥酸值(TBA)的测定:参照文献[25]中的方法,取10 g冷藏的试样置于洁净干燥的烧杯中,加入40 mL 10%三氯乙酸,14000 r/min均质10 min,2000 r/min离心5 min后过滤,将滤液转移至50 mL容量瓶中,补充10%三氯乙酸并定容至50 mL,静置使其充分反应10 min;准确移取5 mL滤液和5 mL 0.02 mol/L TBA溶液,充分混匀;调节水浴锅温度95 ℃,置于该温度下密封保温50 min,冷却至室温测定523 nm处吸光值。
1.3 数据处理
采用Origin 8.5软件作图,通过Design-Expert 8.0进行响应面设计及优化分析。
2 结果与分析
2.1 鲍鱼脏器蛋白提取工艺研究
2.1.1 单因素实验结果 如图1A可知,随着碱液浓度提高,提取率先迅速增大,NaOH浓度为1.5%时达到最大值79.25%±0.76%,这是由于NaOH对构成蛋白质分子的氢键造成破坏,同时一些极性基团发生解离,改变蛋白质表面带电情况,增强蛋白质分子在溶液中的溶解[26];NaOH浓度高于1.5%时提取率下降,是由于碱性太强可能造成肽键断裂、并产生脱羧、脱氨等副反应,生成蛋白交联产物如赖氨酸-丙氨酸(lysinoalanine,LAL)、组氨酸-丙氨酸(histidinoalanine,HAL)等,影响蛋白质的功能特性[26],因此,最佳碱浓度为1.5%。

图1 各因素对蛋白质提取率的影响
采用单一的碱液浸提方法提取蛋白,效率较低,提取过程通过超声波辅助技术,可显著提高蛋白质的提取效率[27-28]。利用超声波产生的剪切和空化作用使溶剂迅速渗入物质内部,加强溶液的扩散能力和蛋白质的溶出效率[26],增大了溶液和底物的接触面积,同时产生局部升温,促进反应进行,提高蛋白质的浸提率。
由图1B可知,随着超声波作用时间增加,超声波的空化效应和机械效应加速蛋白分离而不断溶出,处理时间为15 min蛋白提取率达到最大值76.40%±1.16%,此后时间继续延长,提取率降低,可能是超声时间过长积累反应结果,破坏了蛋白质分子之间的氢键、二硫键等化学键,蛋白质构象受损。因此,选择最佳超声波时间为15 min。
如图1C所示,在提取初始阶段随着时间增加,提取率也不断提高,当提取过程进行40 min时,提取率达到最大值81.55%±0.89%,提取过程继续进行,提取率出现急速下降的情况,可能是提取时间过长,大部分蛋白质已经完全溶解,因此,最佳提取时间为40 min。
提取温度对鲍鱼脏器蛋白提取率的影响如图1D所示,高温导致肽键断裂,蛋白质变性,可能发生凝胶作用,影响提取效果,因此70 ℃为鲍鱼蛋白变性的临界点,这与文献资料中研究发现的大多数蛋白质在62~80 ℃时处于变形临界点的观点相一致。因此,最佳提取温度为70 ℃。
料液比对蛋白提取率的影响如图1E所示,提取率随料液比的增大先上升后下降;料液比达到1∶18 g/mL时,提取率为最大80.12%±0.11%。一定范围内,大的料液比可以降低体系的粘度,使蛋白质样品在溶液中处于分散的状态,加快蛋白质向体系溶出的过程;而料液比太小,则溶液的粘度提高,影响蛋白质向溶液中溶解过程的发生,在料液比为1∶20~1∶22 g/mL时,提取率下降,蛋白质向提取液中溶出到一定程度后不再继续溶解,故选择1∶18 g/mL为最佳料液比。
2.1.2 响应面试验设计及结果分析 通过Box-Behnkend Design(BBD)方法进行响应面试验,结果如表3所示。根据各项的回归系数建立回归模型,二次多项回归方程为:
Y=81.43+0.070A+0.38B-1.08C+0.62D+0.26AB+1.22AC-1.52AD+2.96BC-0.78BD+0.58CD-5.65A2-4.07B2-1.65C2-1.81D2

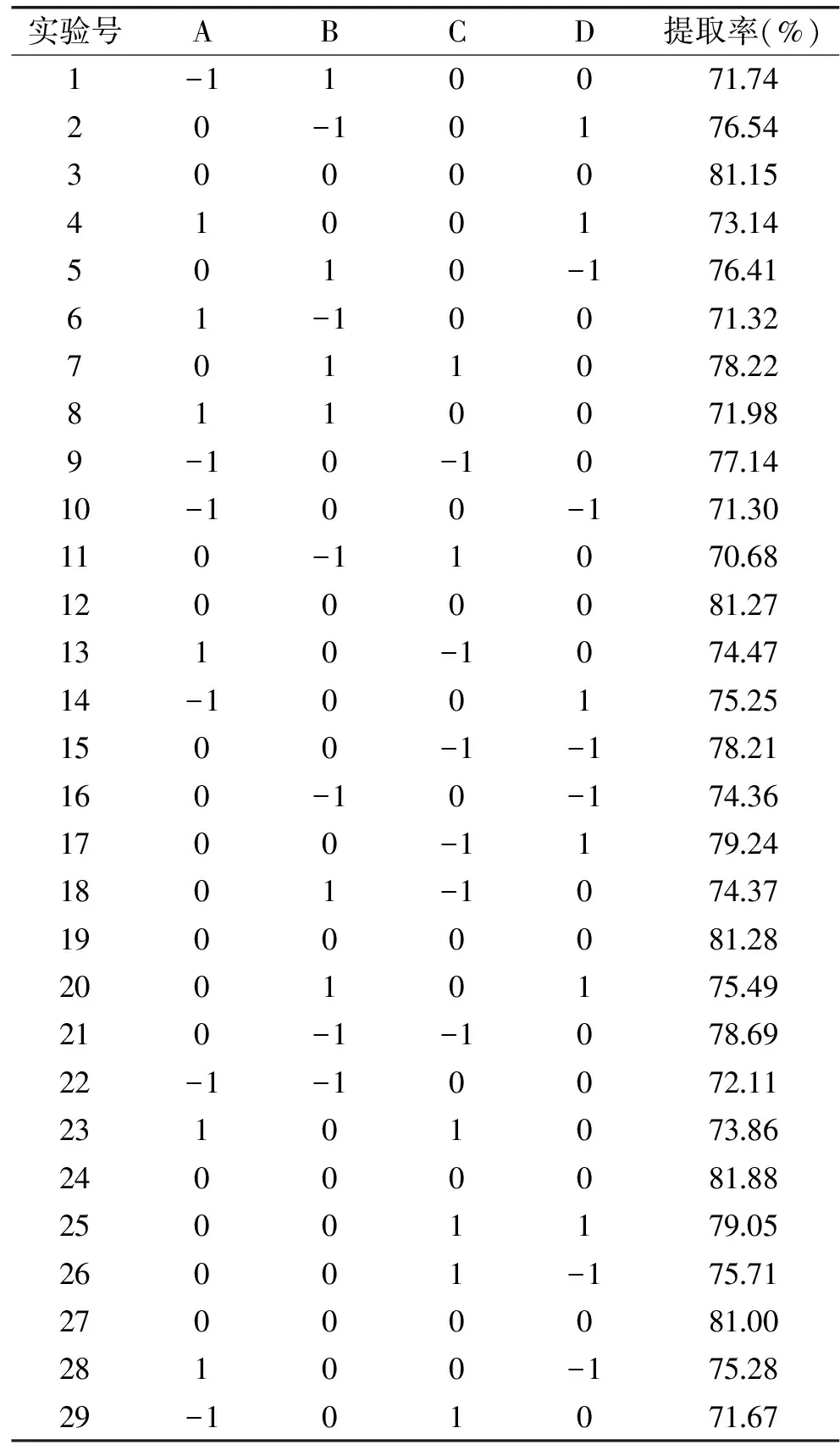
表3 响应面设计及试验结果Table 3 Design and results of response surface
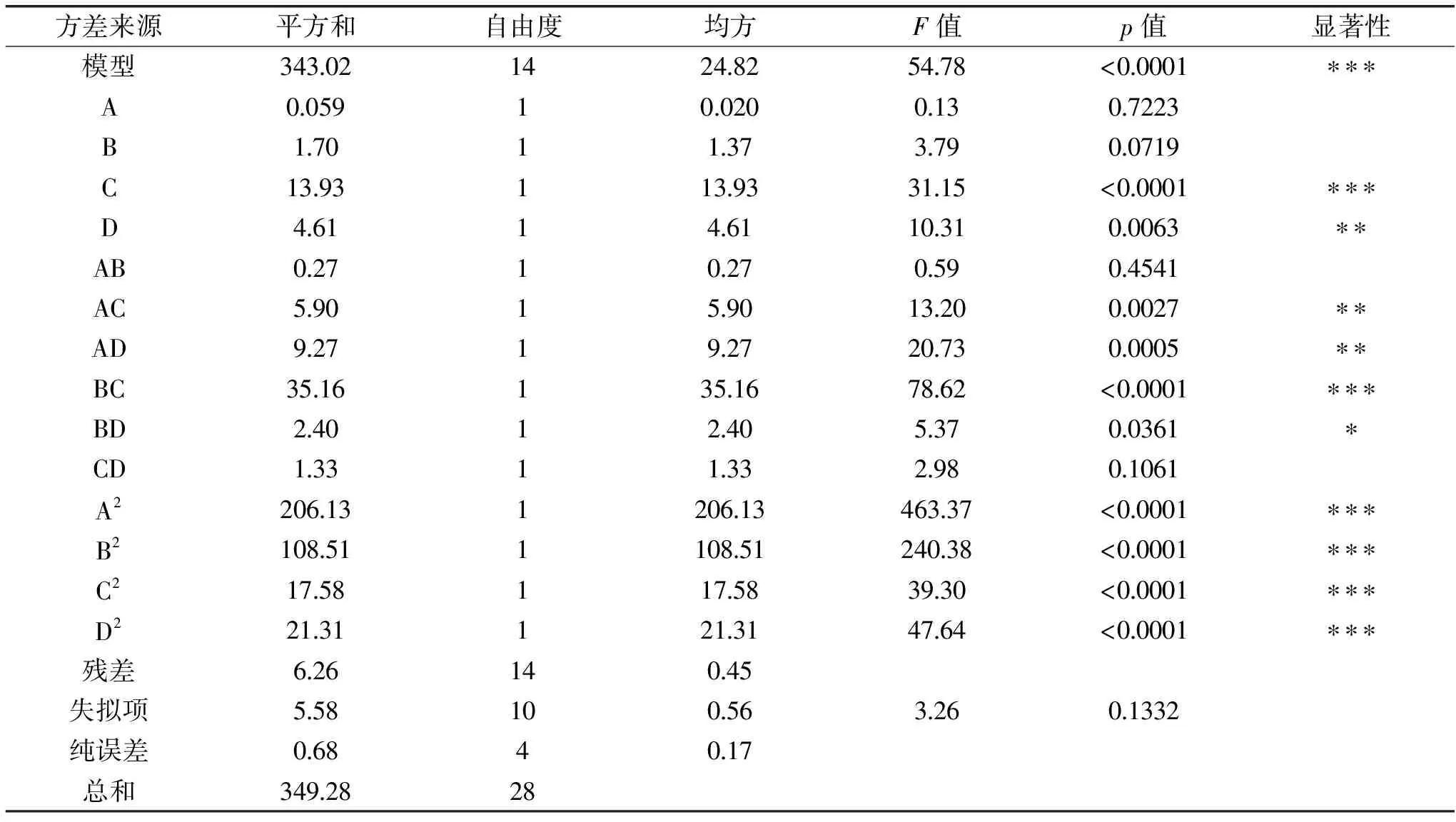
表4 响应面回归方程方差分析Table 4 ANOVA for response surface quadratic model
进一步表明各单因素对响应值的影响并非简单的线性关系,而是极其错综复杂的;各因素影响主次顺序依次为:C(提取时间)>D(提取温度)>B(超声波时间)>A(碱浓度)。
2.1.2.1 响应面分析 为进一步分析各因素对响应值的影响,绘制和分析各因素交互作用的响应面图,结果如图2。响应曲面坡度和等高线形状反映了提取条件发生变化时,蛋白提取率响应值的敏感程度:若曲面陡峭,则提取条件变化时响应值敏感,若曲面坡度平缓,则提取条件变化对响应值影响不敏感;等高线为椭圆形表示交互作用影响显著,为圆形表示交互作用影响不显著,等高线密集,也表明交互作用显著[29-30]。由图2可知,超声波时间与提取时间,碱浓度与提取温度,碱浓度与提取时间,超声波时间与提取时间之间的交互对响应值影响显著,与表4的方差分析表一致。
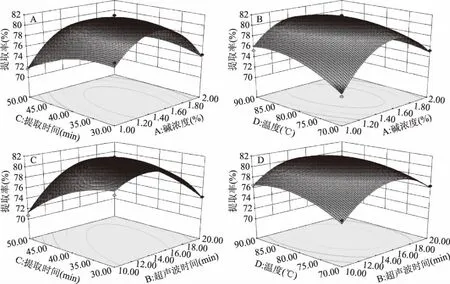
图2 各因素交互作用对蛋白提取率影响的响应面图
2.1.2.2 最佳蛋白提取条件的确定及验证 通过Design-Expert 8.0软件进行回归分析,得到提取鲍鱼内脏蛋白最优工艺为:碱浓度1.47%,超声波时间14.34 min,提取时间35.57 min,提取温度81.56 ℃。此优化工艺下的提取率预测值:81.69%。为便于实际操作,设置碱浓度1.5%,超声波时间14.5 min,提取时间35.5 min,提取温度81.5 ℃,在此条件下验证试验,重复三次,可得鲍鱼蛋白提取率81.01%±0.43%,误差0.83%,表明该回归模型可应用于生产实践中。
2.1.3 粗蛋白沉淀的pH范围确定 结果如图3所示,pH在3.0~4.5之间时,曲线上升蛋白沉降量达到最大值,且在该pH范围内始终处于较高水平。蛋白质是两性电解质,大部分蛋白质等电点在酸性范围,两性电解质在溶液处于等电点时,溶解度最低;蛋白质分子之间虽然通过肽键相互连接,但仍有大量可解离的基团和氨基酸残基,使得蛋白质分子所带静电荷随着溶液pH的变化而发生改变。综合考虑蛋白沉降率和时间成本等因素,调节溶液pH范围至3.0~4.5来沉淀蛋白质。此条件下,蛋白质的沉降率约为84.56%±0.57%。
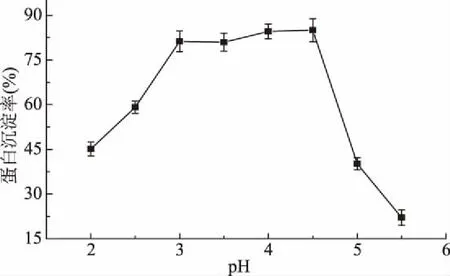
图3 不同pH对鲍鱼脏器蛋白沉淀的影响
2.2 制备水解肽最适蛋白酶的筛选
以水解度和自由基清除能力为指标筛选最适蛋白酶,制备较强抗氧化能力、营养丰富的抗氧化肽。由图4可得出五种蛋白酶水解度大小依次为:木瓜蛋白酶>复合蛋白酶>碱性蛋白酶>中性蛋白酶>酸性蛋白酶。水解能力最强木瓜蛋白酶是一种巯基蛋白酶,作用位点主要为Lys、Arg、Phe的羧基端,由木瓜蛋白酶酶解所得的多肽溶解度、乳化能力、发泡能力都有所提高且腥味减弱,且木瓜蛋白酶中含有的3个二硫键使得其具有良好热稳定性和酸碱稳定性[31]。如图5所示,木瓜蛋白酶酶解液清除DPPH自由基和OH·自由基能力最高,清除率分别为63.17%±0.92%、24.23%±0.45%,这与图4所示各种蛋白酶水解能力大小排序基本一致。蛋白质被酶催化水解时所断裂的肽键数目是衡量水解度的标准之一,水解度越高,酶解生产的游离氨基酸和水解肽占比例也越大,含有较强抗氧化能力的活性肽段数量相应的也就越多。综上所述,筛选木瓜蛋白酶为最适蛋白酶,调节至最佳条件进行酶解,所得上清液冻干即为抗氧化肽样品。
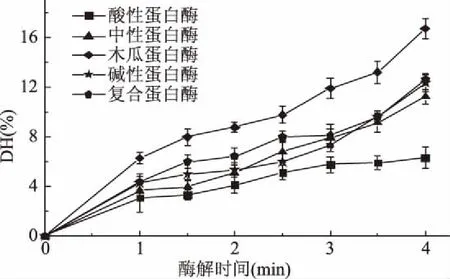
图4 最适蛋白酶的筛选
2.3 水解肽的分离纯化及应用研究
2.3.1 水解肽的分离纯化 将鲍鱼内脏水解肽冻干粉通过Sephadex G-50凝胶过滤层析柱分离,收集洗脱液绘制洗脱曲线如图6所示,洗脱液在214 nm处有三个峰值,将其依次命名为P1、P2、P3。
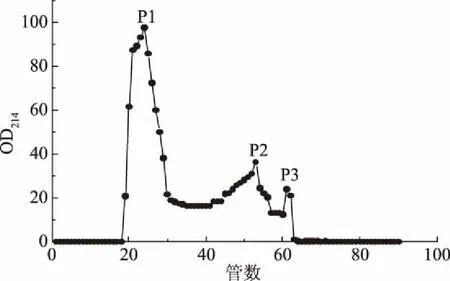
图6 Sephadex G-50凝胶层析洗脱曲线
2.3.2 各组分抗氧化活性比较 由图7可知,P1清除羟基自由基的能力最强,清除率为79.25%±1.12%,比原液的64.26%±0.66%高出14.99%;而P2、P3组分的羟基自由基清除率均低于原液,分别为46.25%±1.44%、14.25%±1.10%,P3的羟基自由基清除率约为P2的三分之一。P1组分清除DPPH自由基的能力最强,清除率为90.45%±0.46%,比原液的80.12%±1.34%高出10.33%,而P2、P3组分的DPPH自由基清除率均低于原液,分别为61.45%±0.46%、26.52%±1.56%,表明P2也具有一定的抗氧化能力。经预实验得出2.0 mg/mL组分的还原力无显著性差异,缺乏代表性,因此还原力采用组分浓度为3.0 mg/mL进行检测分析。由图8可知,各组分的还原能力与自由基清除能力情况一致,即P1还原能力最强,在700 nm下吸光值达到0.598±0.05,P2、P3还原能力依次递减,吸光值分别为0.370±0.04、0.232±0.05。综上,P1抗氧化能力最强,收集作为目标抗氧化肽段作为后续研究。

图7 各组分自由基清除率能力
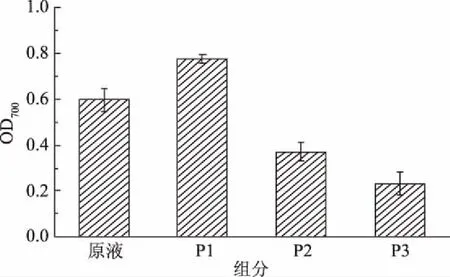
图8 各组分还原能力
2.3.3 水解肽抗氧化应用研究
2.3.3.1 过氧化值(POV)的变化 不同质量分数的抗氧化肽对冷藏猪肉POV的影响情况如图9A,随着冷藏时间延长,各组猪肉样品的POV值先增大到一定程度后降低,且在前6 d随时间延长逐渐缓慢增加,油脂在此期间被氧化速率缓慢;第9 d开始POV值上升速度呈快速增长趋势,到第12 d时各试验组POV值达到最大值;12~15 d POV值的升高、降低呈现出不规律的变化趋势,表明随着氧化程度的加深,样品氧化加剧与POV值没有呈线性相关,这是因为油脂发生深度氧化时,氢过氧化物的分解速率超过生成速率,这时POV值就会降低。冷藏储存期,对照组的POV值始终高于添加抗氧化剂的样品组,试验组POV值随着抗氧化肽浓度的增大而减小,表明抗氧化肽在脂-肉体系中的抗氧化作用在一定范围内随着浓度的升高而增强,添加浓度为1.0%抗氧化肽的样品组POV值变化差异不显著(p>0.5),说明抗氧化肽浓度为1.0%时对冷藏猪肉的储存效果良好。添加不同浓度抗氧化肽对油脂都具有一定的抗氧化效果,但与人工合成的BHT和VC相比,抗氧化能力尚有提升空间,VC抑制油脂氧化能力略高于BHT。

图9 鲍鱼抗氧化肽处理猪肉样品在冷藏期的POV值和TBA值
2.3.3.2 硫代巴比妥酸(TBA)的变化 不同质量分数的抗氧化肽对猪肉样品在冷藏期TBA影响情况如图9B,随着冷藏时间的延长,各样品组TBA值均呈现不断上升的趋势,表明氧化反应随时间的延长仍然在不断的进行中。不添加的空白组TBA值始终高于添加抗氧化剂的处理组,随着抗氧化肽浓度提高,TBA值基本呈减小的趋势,这是由于抗氧化肽能有效抑制不饱和脂肪酸的氧化产物醛类的生成。在储存期前3 d,包括空白组在内的各样品组的TBA值无显著差异;从第6 d起,加入抗氧化剂的样品组的TBA与空白组之间开始存在显著性差异性(p<0.05),空白组的TBA值大于样品处理组;第12 d时,可以清除的看到各组TBA值随抗氧化肽的增加而减小,空白组TBA值明显高于其他样品组;第15 d时,各处理组TBA值都达到最大值,空白组最大为1.522 mg/kg,其次是抗氧化肽浓度为0.1%的处理组TBA指为0.821 mg/kg,其余依次为0.02% BHT>0.50%抗氧化肽样品组>1.0%抗氧化肽样品组>0.02% VC,TBA值分别为0.521、0.501、0.497、0.428 mg/kg。抗氧化肽质量分数为0.1%与0.5%的样品组的TBA值之间存在显著差异(p<0.05),抗氧化肽质量分数为0.5%与1.0%样品组的TBA值之间无显著差异。与添加0.02% BHT的样品组相比,抗氧化肽浓度为0.5%与1.0%样品组的TBA值低于0.02% BHT,此时抗氧化肽抑制油脂自动氧化能力高于人工合成的抗氧化剂BHT。
3 结论
本文通过超声波技术辅助碱提酸沉得到鲍鱼内脏蛋白,通过响应面试验优化可得:碱浓度1.5%,超声波时间14.5 min,提取时间35.5 min,提取温度81.5 ℃,在此条件下可得鲍鱼蛋白提取率81.01%±0.43%,筛选木瓜蛋白酶为最适蛋白酶制备抗氧化肽,分离纯化后得到抗氧化肽对OH自由基、DPPH自由基都具有较好的清除能力及还原力。收集抗氧化能力最强的部分,其对羟基自由基清除率为79.25%±1.12%,DPPH自由基的清除率为90.45%±0.46%。考查鲍鱼抗氧化肽对猪肉样品的抗氧化效果良好。本研究表明:鲍鱼内脏中含有抗氧化活性肽,它的抗氧化能力可与人工合成的抗氧化剂相媲美,为其在食品、化妆品和医药等领域开发天然抗氧化剂提供实验基础。

