LC-MS/MS法同时测定大鼠组织中士的宁、马钱子碱及其代谢物
李嘉华,苏晓纯,刘奕明,林爱华
(广州中医药大学第二临床医学院1. 中药药代动力学实验室、2. 珠海医院药剂科,广东 广州 510120)
士的宁(strychnine,STR)和马钱子碱(brucine,BRU)作为中药马钱子的主要药效生物碱成分,具有明显的镇痛[1-2]、抗炎[3-4]、抗肿瘤[5-7]、中枢神经系统兴奋[8-9]等多种药理活性。研究表明,其代谢产物士的宁氮氧化物(strychnine N-oxide,SNO)和马钱子碱氮氧化物(brucine N-oxide,BNO)的毒性比原型物大大降低,且具有较好的生物活性。目前,关于4种成分的组织测定方法主要包括高效液相色谱法(HPLC),但存在分析时间长、灵敏度较低、专属性和特异性不强等缺点[10-11]。本研究旨在建立快速、灵敏、准确的液相色谱-质谱联用法(LC-MS/MS),同时测定大鼠组织中STR、BRU、SNO和BNO的含量,比较正常和毒性剂量马钱子总碱给药后,4种成分的组织分布情况,为其在生物体内的代谢动力学研究提供测定方法,并为其毒性机制和药理作用研究等提供更准确、可靠的科学依据。
1 材料
1.1 药品与试剂士的宁对照品(批号131030)、马钱子碱对照品(批号131040),成都普菲德生物技术有限公司;士的宁氮氧化物对照品(批号S450162)、马钱子碱氮氧化物对照品(批号S450142),Sigma-Aldrich公司;盐酸麻黄碱对照品(批号0714-9402),中国药品生物制品检定所,对照品纯度均>98%。乙醇为分析纯;甲酸、乙酸铵、甲醇,均为HPLC色谱纯;水为Milli-Q超纯水;马钱子总碱由南京中医药大学药剂实验室馈赠,其中士的宁占33.33%,马钱子碱占21.28%。
1.2 仪器SHIMADZU LC-20A高效液相色谱(日本岛津公司);API4000+型液相色谱-三重四级杆质谱联用仪(LC-MS/MS),配备Turbo Ionspray离子源(ESI)及Analyst 1.6数据处理系统(美国AB Sciex公司);Thermo SPD121P P1 真空离心浓缩仪(美国Thermo Fisher公司);BF2000-30A氮气吹干仪(北京八方世纪科技有限公司);Microfuge 16台式微量离心机(美国Beckman Coulter公司)。
1.3 实验动物SPF级SD大鼠,♂,体质量(225±25)g,购于广东省医学实验动物中心,合格证号:(粤)44007200008985。实验前禁食12 h以上,自由饮水。
2 方法
2.1 色谱与质谱条件色谱条件:色谱柱为ZORBAX Eclipse XDB-C18柱(2.1 mm×150 mm,3.5 μm);流动相A为10 mmol·L-1乙酸铵(用甲酸调pH 4.0),流动相B为甲醇,梯度洗脱:B相0~1 min,5%;1~6.5 min, 5%~70%;6.5~7.5 min,70%;7.5~7.6 min,70%~5%;7.6~11 min,5%,流速0.2 mL·min-1;柱温30 ℃,进样量5 μL。
质谱条件:电喷雾ESI离子源,检测方式为正离子多离子反应检测(MRM);喷雾电压为5500 V;雾化温度为350 ℃。其他质谱参数设置分别为:碰撞气(CAD)12 psi;雾化气(GAS1)20 psi;帘气(CUR)40 psi;用于定量分析的离子对分别为m/z 335.3→184.1(士的宁),395.3→324.3(马钱子碱), 351.4→334.1(士的宁氮氧化物),411.2→394.2 (马钱子碱氮氧化物),166.2→148.3(内标盐酸麻黄碱)。
2.2 溶液的制备分别精密称取STR、BRU、SNO和BNO 1.05 mg、1.17 mg、1.06 mg和1.17 mg,甲醇溶解,配成浓度分别为105、117、106、117 mg·L-1的储备液。精密称取盐酸麻黄碱(IS)1.39 mg,甲醇溶解,得到终浓度为139 μg·L-1的内标工作液。精密称取适量马钱子总碱,PBS ∶乙醇=80 ∶20溶解,配成浓度0.3 g·L-1的溶液。以上溶液均于4 ℃冷藏备用。
2.3 组织匀浆样本处理各组织样品称重,以质量体积比1 ∶3的比例加入超纯水,匀浆。精密移取内标工作液(139 μg·L-1)20 μL,常温真空浓缩后加入组织匀浆200 μL,震荡涡旋30 s混匀,加入40 μL氨水碱化,涡旋30 s,加入4 mL氯仿,充分涡旋2 min,3 750 r·min-1离心10 min,取下层有机相于35 ℃下N2吹干,使用200 μL流动相[甲醇 ∶10 mmol·L-1乙酸铵(用甲酸调pH 4.0)=40 ∶60]复溶,涡旋2 min,14 000 r·min-1离心15 min,过滤,取上清液进行分析,进样量5 μL。
2.4 给药与组织样品采集SD大鼠随机分为正常和毒性剂量组,每组25只。每组大鼠按时间点随机分成5组,每个时间点5只。正常和毒性剂量组分别灌胃马钱子总碱溶液1.2 mg·kg-1(STR 0.4 mg·kg-1,BRU 0.2554 mg·kg-1) 和3.0 mg·kg-1(STR 1 mg·kg-1,BRU 0.6385 mg·kg-1),分别于给药后5、15、30、60、120 min麻醉,分离心、肝、脾、肺、肾和脑,脏器用超纯水洗净,滤纸吸干,于-80 ℃保存。
3 结果
3.1 专属性分别取来自6只大鼠的空白肾组织匀浆(以肾组织为代表),空白肾组织匀浆加4种待测物和内标,以及大鼠灌胃给药后的肾组织匀浆样品,按照“2.3”项下操作,在选定的检测条件下考察5种分析成分。Fig 1结果显示,STR、BRU、SNO、BNO和内标的保留时间分别为8.31、8.33、8.86、8.82、7.56 min,组织中内源性物质不会对待测成分产生干扰,峰形良好。
3.2 标准曲线与定量下限分别精密吸取适量STR、BRU、SNO和BNO储备液,用甲醇逐级稀释成系列标样,精密吸取200 μL标样,真空浓缩,分别加入到200 μL空白大鼠组织匀浆中,按“2.3”项下操作,分别以STR、BRU、SNO和BNO与内标盐酸麻黄碱的峰面积比值对各自相应的浓度进行加权(1/X2)线性回归。定量下限(LLOQ)为标准曲线的最低浓度。所得回归方程及定量下限见Tab 1,各成分在测定范围内线性关系良好。
3.3 精密度与准确度分别配制低、中、高浓度的质控样品:STR 3.00、30.03、390.39 μg·L-1,BRU 3.01、30.10、390.90 μg·L-1,SNO 0.901、9.01、117.13 μg·L-1,BNO 0.901、9.01、117.12 μg·L-1,按“2.3”项下操作,每个质量浓度平行5份,连续测定3 d,以当天随行的标准曲线测定质控样品浓度。结果显示,心、肝、脾、肺、肾、脑组织中的相对回收率和日内、日间精密度分别为STR:(87.66±1.01)%~(112.51±3.40)%、2.13%~9.31%、1.29%~14.70%;BRU:(87.16±1.07)%~(110.49±1.74)%、2.83%~9.36%、1.34%~14.13%;SNO:(86.84±1.71)%~(113.77±5.19)%、2.14%~10.02%、0.34%~14.90%;BNO:(85.94±1.43)%~(113.29±5.46)%、2.05%~9.31%、0.90%~14.30%。均符合生物样品分析的方法学要求。
3.4 提取回收率及基质效应按“3.3”项下操作,配制低、中、高3个浓度水平的STR、BRU、SNO、BNO组织质控样品(以肾组织为代表),每个浓度平行操作5份,按“2.3”所述操作,进样考察,峰面积记作A1;取空白组织匀浆同样操作,N2吹干后残渣分别加入相应低、中、高浓度的对照品溶液复溶,进样考察,峰面积记作A2,以A1/A2×100%为提取回收率(Tab 2)。分别配制含有低、中、高浓度STR、BRU、SNO、BNO的混合标准品溶液,直接进样,峰面积记作A3,以A2/A3×100%为基质效应,见Tab 2。
3.5 稳定性按“3.3”项下操作,配制低、中、高3个浓度STR、BRU、SNO、BNO的质控样品(以肾组织为代表),每个浓度5个样本,分别考察样品在室温放置4 h,反复冻融3次,以及制备好的待测液4 ℃放置12 h条件下的稳定性。Tab 3结果表明,4种成分在上述条件下均较为稳定。
3.6 组织分布大鼠单次灌胃马钱子总碱溶液正常和中毒剂量后,正常剂量组STR在各组织中含量排列顺序为:肾>脾>肝>肺>心>脑(Fig 2A),毒性剂量组的顺序依次为:肾>肝>肺>脾>心>脑(Fig 2B);正常剂量组BRU含量依次为(Fig 3A):肾>肝>脾>肺>心>脑,毒性剂量组的含量依次为:肝>肾>脾>肺>心>脑(Fig 3B);正常剂量和毒性剂量组SNO含量依次为:脾>肝>肾>肺(Fig 4)。代谢产物BNO浓度低于定量限。
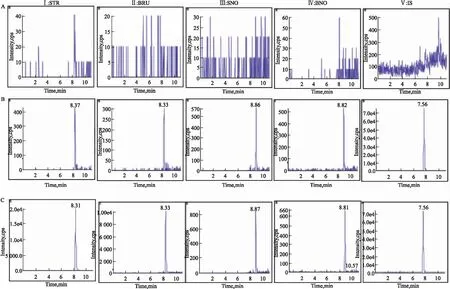
Fig 1 Representative MRM chromatograms
A: Blank kidney homogenate; B: Blank kidney homogenate spiked with analytes and IS; C: Kidney homogenate obtained from a rat after intragastric administration of Semen Strychni total alkaloids.
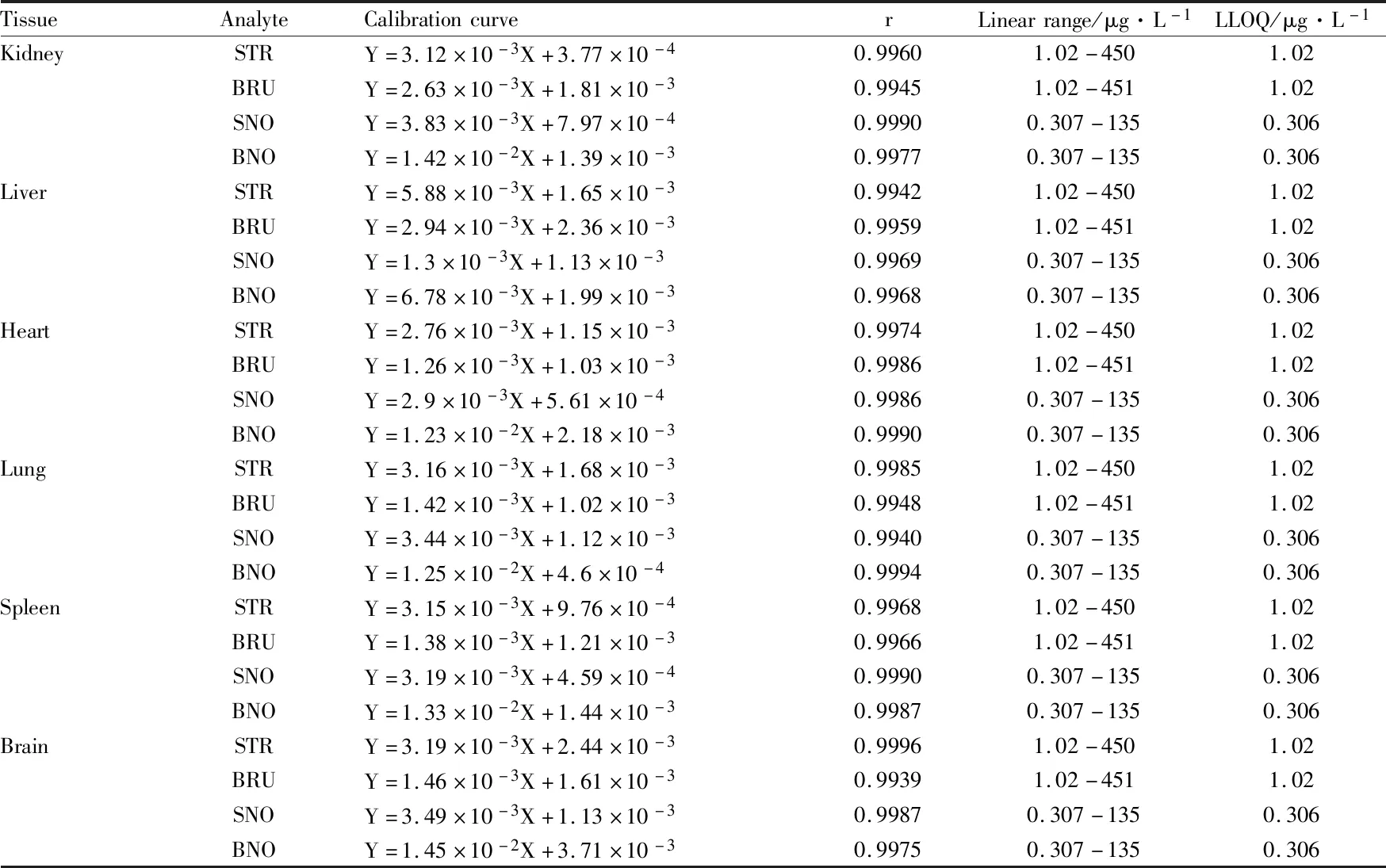
Tab 1 Standard curves and lower limit of quantification of strychnine, brucine, strychnine N-oxide and brucine N-oxide in samples
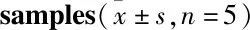
Tab 2 Recovery and matrix effect of strychnine, brucine, strychnine N-oxide and brucine N-oxide in kidney QC
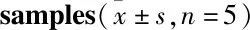
Tab 3 Stability data of strychnine, brucine, strychnine N-oxide and brucine N-oxide in kidney QC
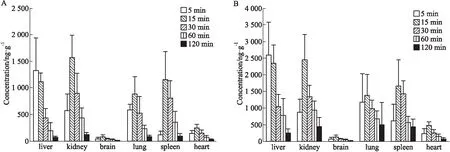
Fig 2 Tissue distribution of strychnine in rats following single intragastric administration of total alkaloids from Semen
A:Normal dose; B: Toxic dose.
4 讨论
本文建立了LC-MS/MS同时测定大鼠心、肝、脾、肺、肾、脑组织中马钱子碱、士的宁及其氮氧化物含量的分析方法,以10 mmol·L-1乙酸铵(用甲酸调pH=4.0)-甲醇为流动相进行梯度洗脱,内源性杂质干扰小,峰形对称,分离度好;采用正离子多离子反应检测,质谱响应及灵敏度高。在样品前处理条件优化过程中,比较了不同处理方法(甲醇沉淀法、氯仿液液萃取法),并进一步考察了氯仿多步和一步液液萃取,及氯仿体积(3、4 mL)对4种待测物提取回收率的影响。另外,由于马钱子碱和士的宁均为碱性药物成分,因此,采用氨水碱化生物样品[12],提高提取效率。
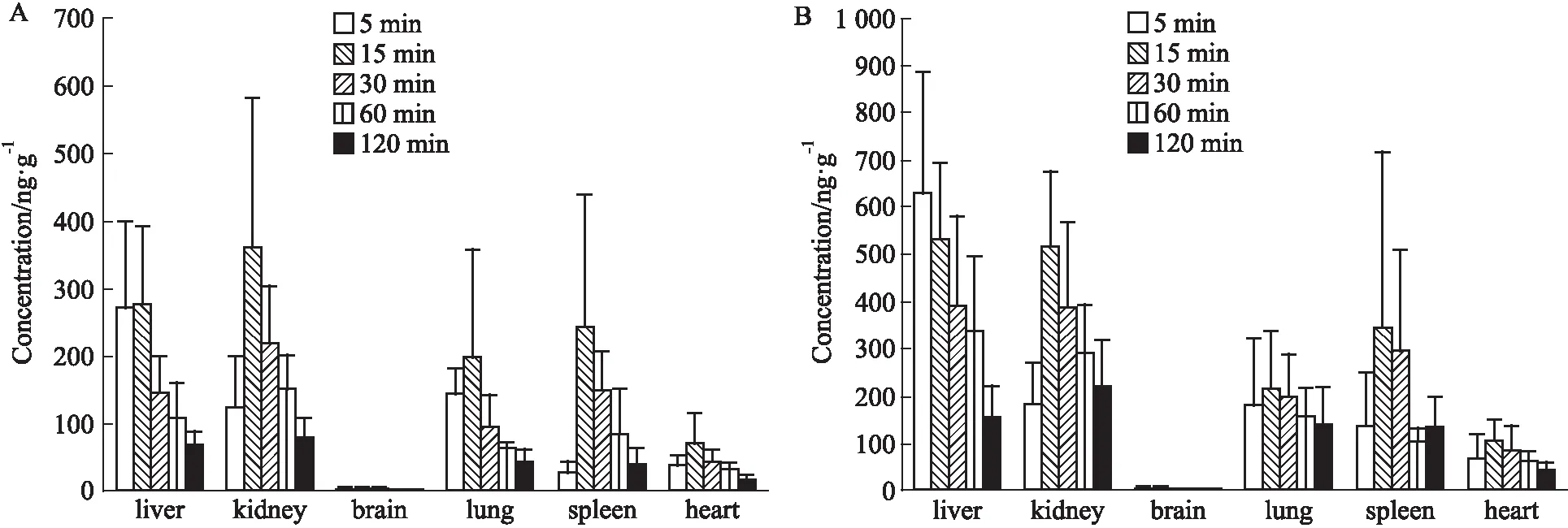
Fig 3 Tissue distribution of brucine in rats following single intragastric administration of total alkaloids from Semen
A: Normal dose; B: Toxic dose.
Fig 4 Tissue distribution of strychnine N-oxide in rats following single intragastric administration of total alkaloids from Semen
A: Normal dose; B: Toxic dose.
组织分布结果显示,正常和毒性马钱子总碱剂量下,STR和BRU在大鼠主要脏器中分布相似,其中以肝脏和肾脏最高,脾脏浓度也较高,脑中的分布量最少。提示STR和BRU可能存在肝脏的代谢或胆汁排泄;肾脏很可能是其主要的排泄途径;脾脏浓度较高,推测这与其具有免疫调节的作用可能有关;STR和BRU均能透过血脑屏障,但透过能力有限。
两种剂量给药后,SNO在主要脏器中均能检出(脑、心除外),但是浓度较低,远低于STR原型物,说明在体内STR确实可转化成SNO,但STR可能不是以SNO的形式在体内蓄积。BRU在体内可代谢成BNO[13-14],本实验仅在毒性剂量给药后的个别肝脏样品中测到,但测得的BNO浓度低于定量下限。
综上所述,本研究建立了灵敏、快速和准确的LC-MS/MS法测定STR、BRU、SNO和BNO,基于该法比较了正常和毒性剂量马钱子总碱给药后,4种成分在大鼠组织中的分布特征,为其在生物体内的代谢动力学研究奠定了基础,并对阐明其药理毒理机制有重要意义。