白藜芦醇通过促进线粒体自噬减轻小鼠脑缺血/再灌注损伤的实验研究
向 菲,李明航,徐 露,田晓翠,刘海林,刘道航,董 志
(1. 重庆市生物化学与分子药理重点实验室,2. 重庆医科大学药理学教研室,重庆 400016;3. 重庆医药高等专科学校药学院,重庆 401331)
中风的年发病率和死亡率在过去的30年间逐年上升,其中缺血性脑中风占有很大比例[1]。当积极采取措施恢复缺血脑组织血供时,反而对机体造成二次打击的现象被称之为脑缺血/再灌注(ischemia/reperfusion,I/R)损伤。这是一个涉及多种机制的复杂的病理生理过程。其中血液的复灌使得细胞大量产生远超于其所能负荷的氧自由基(reactive oxygen species,ROS),线粒体作为自由基的主要来源之一和首要攻击对象,受损严重。功能失常的线粒体不仅不能持续有效地为大脑供能,还会释放大量促凋亡因子,激发线粒体凋亡通路[2]。可见,确保线粒体健康对减轻I/R损伤的重要性。
线粒体自噬是一个特异性靶向受损线粒体,并将其降解掉的过程,通过对受损线粒体的及时清除,它可以有效阻断受损线粒体引发的细胞死亡[3]。此外,自噬所生成的氨基酸、脂肪酸等小分子化合物可以被机体回收利用,重新参与到细胞的物质代谢中。因此,调控线粒体自噬对I/R损伤的治疗具有重要意义。白藜芦醇(resveratrol,Res)是一种多酚类化合物,广泛存在于葡萄、花生等天然植物中。其所具备的多重药理作用得益于对沉默信息调节因子1(silent information regulator 1,SIRT1)的激活[4]。SIRT1最早被人熟知是它的抗衰老作用,近年来几种有前景的脑缺血治疗方法,如缺血预处理、热量限制,以及其他化合物的使用均涉及对其的调控[5]。因此,SIRT1成为了减轻I/R损伤的重要靶点。研究发现,在Res众多神经保护机制中,SIRT1对线粒体结构功能,以及线粒体相关通路发挥着重要调控作用[6]。但其分子机制还不十分清楚。故本实验拟利用线栓法建立小鼠I/R损伤模型,观察Res对I/R损伤的保护作用,及其可能涉及的对线粒体自噬的调控,为中风病人的线粒体靶向治疗提供新的思路。
1 材料
1.1 实验动物C57BL/6J ♂小鼠96只,体质量(22~25) g,SPF级,由重庆医科大学实验动物中心提供,许可证号:SCXK渝2012-0001。
1.2 试剂Res(R5010)、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl-tetrazolium chloride solution,TTC)(17779)均购自Sigma公司;3-甲基腺嘌呤(3-methyladenine,3-MA)(S2767),购自Selleck公司;组织线粒体分离试剂盒(C3606)、增强型ATP检测试剂盒(S0026)、线粒体膜电位检测试剂盒(C2006)、蛋白印迹相关试剂,均购自江苏碧云天生物技术有限公司;抗体SIRT1(8469S)、细胞色素C(cytochrome C,CytC)(4272S)、p62(5114S)、微管相关蛋白3B(microtubule-associated protein light chain 3B,LC3B)(3868S)、抑制素2(prohibitin 2,PHB2)(14085S),均购自CST公司;抗体外膜移位酶20(translocase of outer membrane 20,TOM20)(11802-1-AP)、β-actin(60008-1-lg)、环氧酶Ⅳ(cycloxygenaseⅣ,COXⅣ)(11242-1-AP),均购于Proteintech公司;其余试剂均为国产分析纯。
1.3 仪器立体定位仪(瑞沃德公司);微量进样针(宁波三爱仪器厂);-80 ℃超低温冰箱、低温离心机(Thermo公司);湿式转膜仪、垂直电泳槽(六一仪器厂);酶标仪、凝胶成像系统(Bio-Rad公司);流式细胞仪(Beckman Coulter公司);透射电镜(Hitachi公司)。
2 方法
2.1 大鼠脑I/R模型的建立及给药方案采用线栓法建立小鼠右侧大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型。腹腔注射质量分数为4%的戊巴比妥钠麻醉小鼠后,将其仰卧固定,常规消毒,取颈部正中纵切口,逐层分离组织,分别用自制小拉钩拉向两旁进行固定。在显微镜下分离出右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),结扎ECA,动脉夹暂时夹毕CCA和ICA。在ECA结扎处远心端剪一斜口,经此斜口插入顶端硅胶包被的直径0.18 mm的线栓,经ICA进入大脑前动脉(anterior cerebral artery,ACA)的起始部,遇轻微阻力即停止。栓塞1 h后,拔出线栓,再灌注24 h,模拟急性脑梗死模型。假手术组除不插栓外,其余步骤同模型组。
2.2 分组与给药将小鼠随机分成4组:假手术组(Sham组)、脑缺血/再灌注模型组(I/R组)、Res处理组(Res组)、Res处理加3-MA抑制剂组(Res+3-MA组)。Res用体积分数为0.50的乙醇溶解,再用生理盐水稀释配制。小鼠在用药前称重,分别腹腔注射给予Res(30 mg·kg-1),每天1次,d 5术前30 min再给药1次。I/R组予以溶剂处理。Res+3-MA组小鼠于拔栓时用微量注射器向右侧脑室(前囟点旁开1 mm,右侧冠状缝后0.3 mm,腔深3 mm)给予7.5 μg 3-MA[3]。在造模过程中用白炽灯加热,维持肛温37 ℃左右。
2.3 TTC染色检测脑梗死体积术后24 h,小鼠麻醉后,立即取脑,置于-20 ℃中冰冻。待组织冻硬后,在冰上将大脑由前向后做冠状切片。放入质量分数为2%的TTC染液中,37 ℃避光染色20 min,隔10 min翻动1次。红色为正常组织,白色为梗死灶。染色完成后,于质量分数为4%的多聚甲醛中固定,4 ℃过夜后拍照。为排除梗死侧大脑水肿对计算的影响,采用公式:(对侧半球体积-同侧半球正常脑组织体积)/对侧半球体积×100%,计算损伤侧脑梗死体积。
2.4 神经功能评分缺血/再灌注24 h后,参照改良的Longa评分[7]对小鼠的神经功能进行评分。0分:无明显神经功能缺损;1分:提尾时,对侧前肢不能前伸;2分:向缺血对侧转圈;3分:不能承受对侧自身重量;4分:无自主运动或意识障碍。分值越高,说明动物行为障碍越严重。
2.5 线粒体和胞质的分离参照组织线粒体分离试剂盒说明书,取新鲜脑组织,称重,剪碎,按照50 mg组织加入500 μL预冷的线粒体分离试剂A的比例加入分离试剂A,匀浆10次左右。收集匀浆液,于600×g,4 ℃离心10 min,收集上清于11 000×g,4 ℃离心10 min,沉淀即为线粒体。余下上清液于12 000×g,4 ℃离心10 min,所获得上清即为细胞质蛋白。所有操作均在4 ℃进行。
2.6 线粒体膜电位(mitochondrial membrane potential, MMP)检测先使用组织线粒体分离试剂盒快速获取线粒体,参照线粒体膜电位检测试剂盒(JC-1)使用说明书,取0.9 mL稀释好的JC-1染色工作液,加入0.1 mL总蛋白量约为50 μg纯化线粒体。混匀后,使用流式细胞仪分析各组红绿荧光转变。
2.7 线粒体检测ATP水平参照增强型ATP检测试剂盒说明书,按每20 mg组织加入约120 μL裂解液的比例加入裂解液,在4 ℃条件下,用玻璃匀浆器匀碎。所得裂解液于12 000×g,4 ℃离心5 min,收集上清待测。另外用ATP检测裂解液将ATP标准溶液稀释成适当的浓度梯度。96孔板中每孔加入100 μL ATP检测工作液,室温放置3~5 min,待本底ATP耗完后,再往孔内加入20 μL样品或标准品,最后使用具有检测化学发光的多功能酶标仪读取相对光单位值。为了消除误差,把ATP的浓度换算成mmol·g-1蛋白的形式。
2.8 透射电镜检测线粒体超微结构缺血/再灌注24 h后,深度麻醉麻醉小鼠,用预冷的体积分数为2.5%的戊二醛固定液经心脏灌流固定脑组织,完毕后快速取脑。于冰上用双面刀片切取损伤侧海马1 mm3大小的组织块,置于盛有预冷的体积分数4%的戊二醛中,送至重庆医科大学生科院电镜室做后续处理,并采集图片。
2.9 Western blot法检测蛋白的表达收集各组脑组织,使用RIPA蛋白裂解液(RIPA ∶PMSF=100 ∶1)裂解脑组织总蛋白、线粒体和胞质蛋白,并用BCA法测蛋白浓度。取40 μg蛋白,进行聚丙烯胺凝胶电泳分离蛋白,再以湿法转膜将蛋白转至PVDF膜上,质量分数为5%的脱脂奶粉室温封闭1 h后,加入一抗4 ℃孵育过夜。次日再加二抗孵育1 h,最后显影成像,Image Lab软件(Bio-Rad)对Western blot结果进行灰度分析。
3 结果
3.1 3-MA阻断Res对小鼠I/R损伤的保护作用TTC染色和Longa评分结果显示,与模型组相比,Res预处理可以明显减少I/R小鼠损伤侧梗死体积(Fig 1A、1B),降低神经行为学评分分值(Fig 1C)。当对Res预处理组给予3-MA干预后,小鼠脑梗死体积和神经行为学评分与Res预处理组相比均增加。结果表明,Res可以减轻小鼠脑I/R损伤,且这一过程中自噬发挥着积极作用。
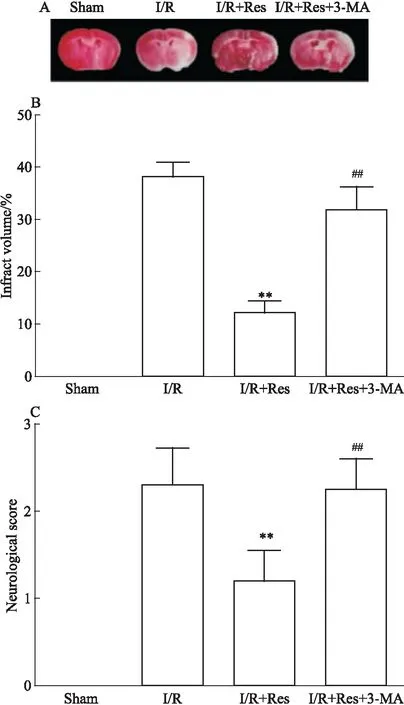
Fig 1 3-MA blocked neuroprotective effects of Res in I/R injured brains
3.2 3-MA抑制Res对小鼠I/R脑组织SIRT1水平的上调Fig 2的Western blot结果显示,与模型组相比,Res预处理组中,SIRT1表达增多。当对Res预处理组给予3-MA干预后,SIRT1表达减少。说明Res在发挥脑保护作用过程中,与其对SIRT1的调控有关。
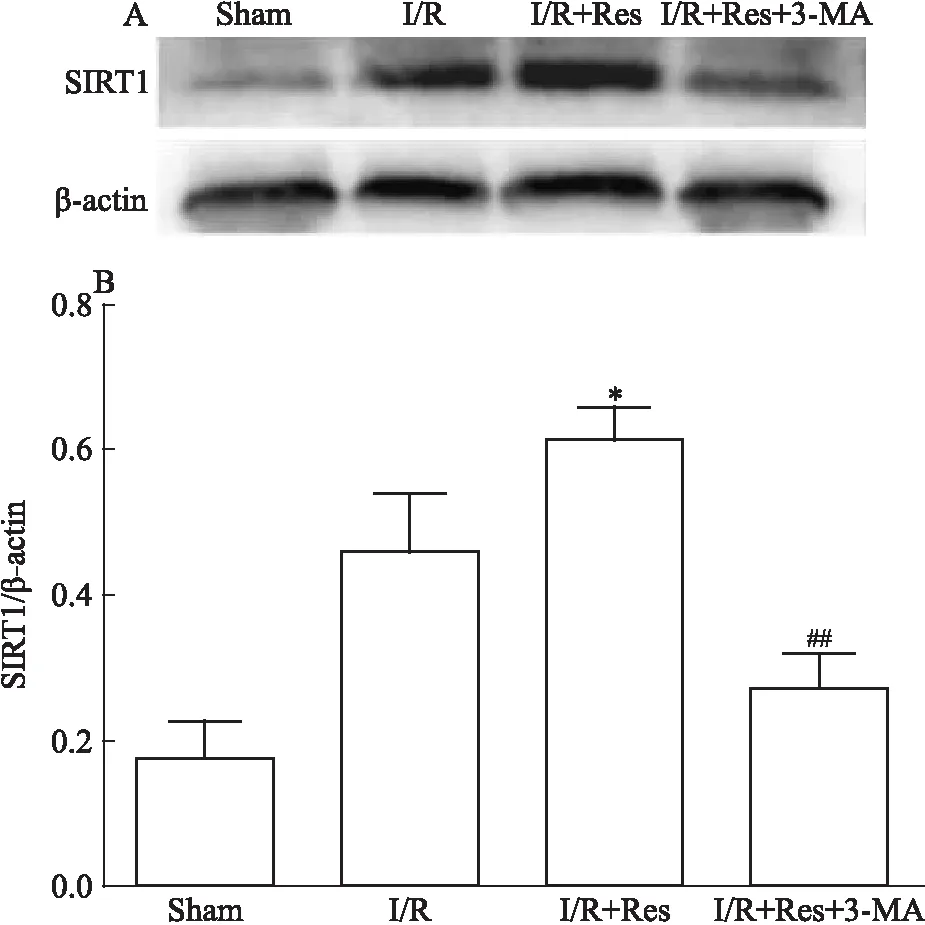
Fig 2 3-MA inhibited Res-induced expression of SIRT1 in I/R injured
*P<0.05vsI/R;##P<0.01vsI/R+Res
3.3 3-MA抑制Res对小鼠I/R脑组织线粒体自噬水平的上调Fig 3的Western blot结果显示,与模型组相比,Res预处理组中,p62表达减少,LC3B-Ⅱ表达增多,蛋白PHB2和TOM20的表达均减少。当对Res预处理组给予3-MA干预后,p62表达增多,LC3B-Ⅱ表达减少,PHB2和TOM20表达明显增多。说明Res所发挥的脑保护作用与促进线粒体自噬有密切关系。
3.4 Res减少I/R小鼠脑组织中线粒体CytC释放的作用被3-MA抑制Fig 4的Western blot结果显示,与模型组相比,Res预处理明显降低了线粒体中CytC的释放量。当对Res预处理组给予3-MA抑制自噬后,胞质中的CytC明显增多。说明Res诱导的自噬激活可以减少线粒体中促凋亡蛋白的释放。
3.5 Res对I/R小鼠脑组织中线粒体相关功能指标的保护作用被3-MA阻断MMP和ATP检测结果显示,与模型组相比,Res预处理明显提高了MMP(Fig 5A、5B),改善了线粒体ATP合成能力(Fig 5C)。当对Res预处理组给予3-MA抑制自噬后,MMP降低,线粒体ATP合成能力受损。结果表明,Res调控的线粒体自噬可以减轻I/R导致的线粒体损伤。
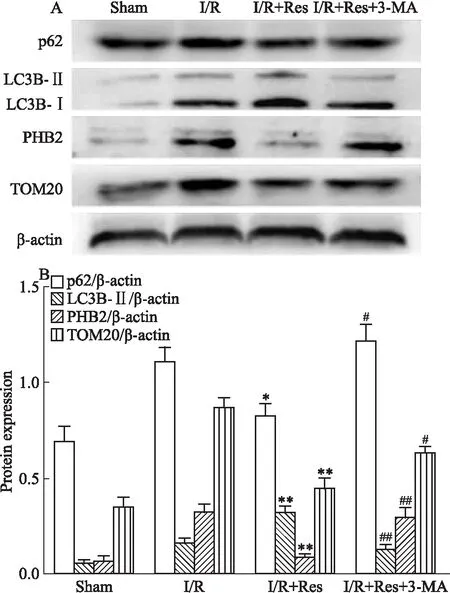
Fig 3 3-MA prevented Res-induced mitophagy
*P<0.05,**P<0.01vsI/R;#P<0.05,##P<0.01vsI/R+Res
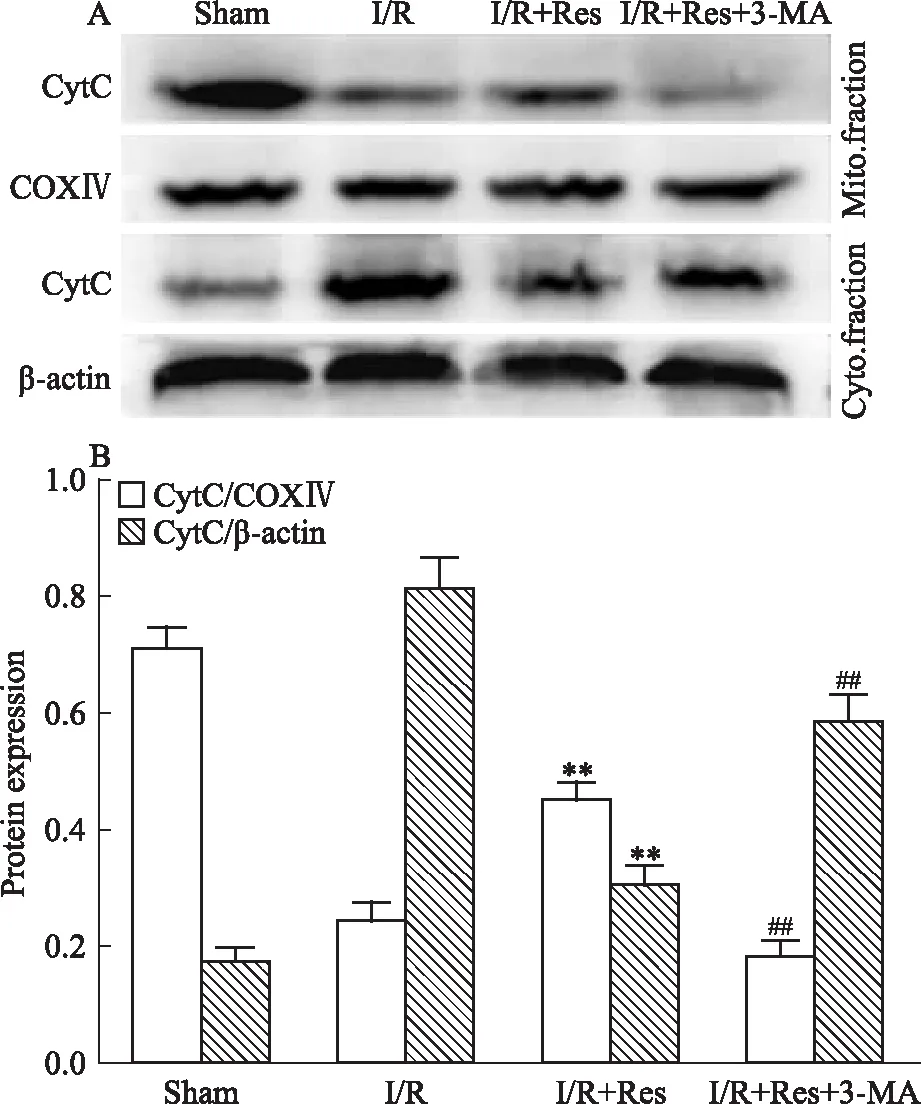
Fig 4 3-MA redistributed location of CytC
**P<0.01vsI/R;##P<0.01vsI/R+Res
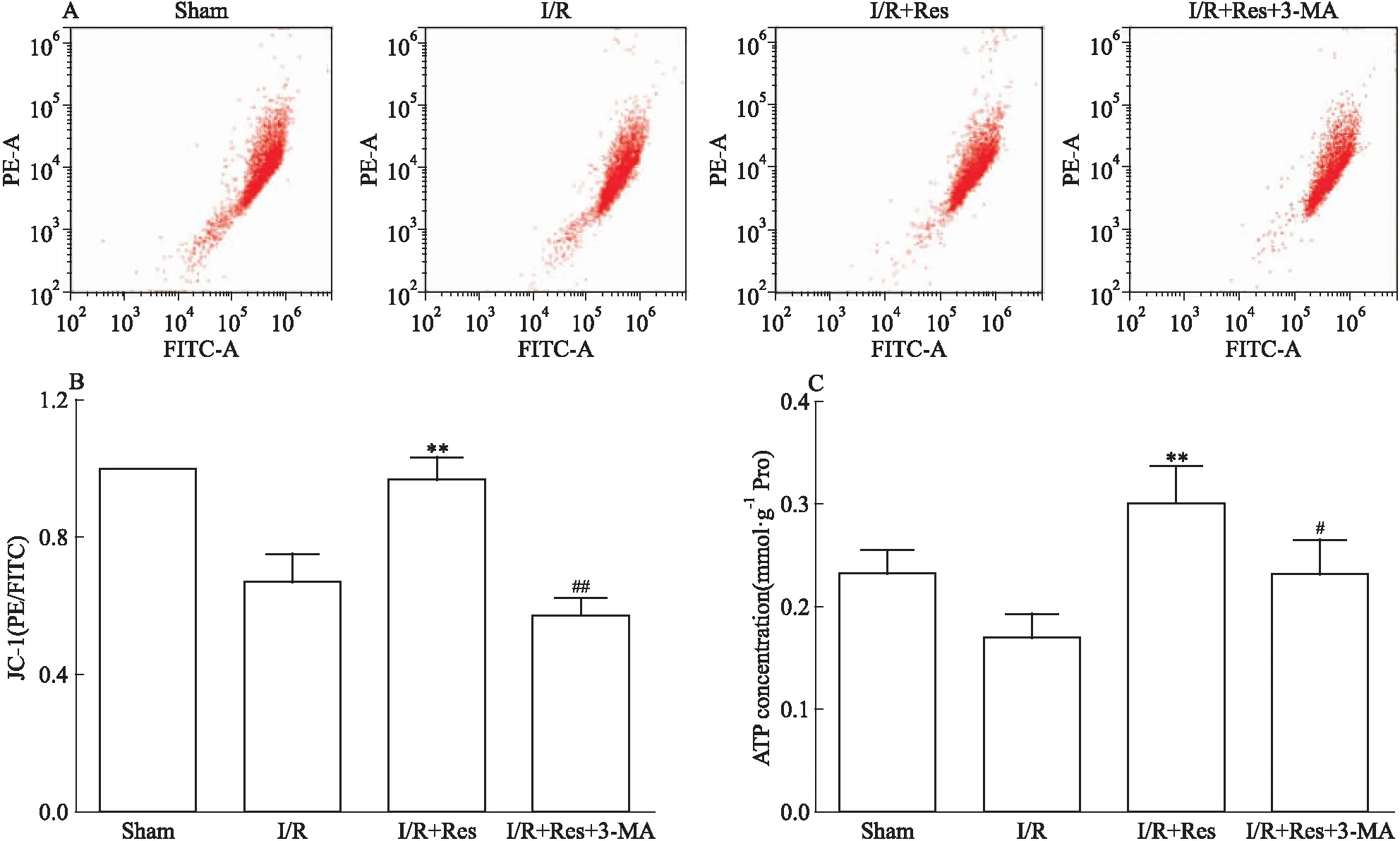
Fig 5 3-MA blocked mitochondrial protection of Res in I/R injured
A: Flow cytometry analysis of JC-1 to measure mitochondrial membrane potential; B: The quantitative diagram of A diagram; C: Luminescence of the cellular ATP levels were detected using a microplate reader.**P<0.01vsI/R;#P<0.05,##P<0.01vsI/R+Res.
3.6 Res对小鼠I/R脑组织线粒体超微结构的保护作用被3-MA阻断Fig 6的透射电镜检测结果显示,模型组中,线粒体明显肿胀,内部嵴破坏或消失,且呈现空泡样结构。在Res预处理组中,线粒体损伤情况明显得到改善,且红色箭头处可见线粒体中受损部分与健康部分正发生裂解,提示有发生自噬的可能[8]。对Res预处理组给予3-MA,抑制自噬后,线粒体结构明显受损。说明Res在减轻脑损伤的作用中,其所调控的线粒体自噬的重要性。
4 讨论
Res具有广泛药理活性[9],近年来其受到许多学者的关注。在本研究中发现,Res可以减少小鼠脑组织I/R损伤后的梗死体积,降低神经行为学评分。并且该实验还观察到Res可以减少I/R损伤导致的线粒体中CytC释放,提高线粒体MMP和ATP水平,因此Res的神经保护作用与其保障线粒体功能有关。但是当在原有的Res预处理的基础上,另外再给予自噬抑制剂3-MA后,Res的神经保护作用受到了抑制,而且以上所提及线粒体功能相关指标结果也显示,Res对线粒体的保护作用遭到了破坏,说明Res对线粒体结构和功能的保护有线粒体自噬的参与。
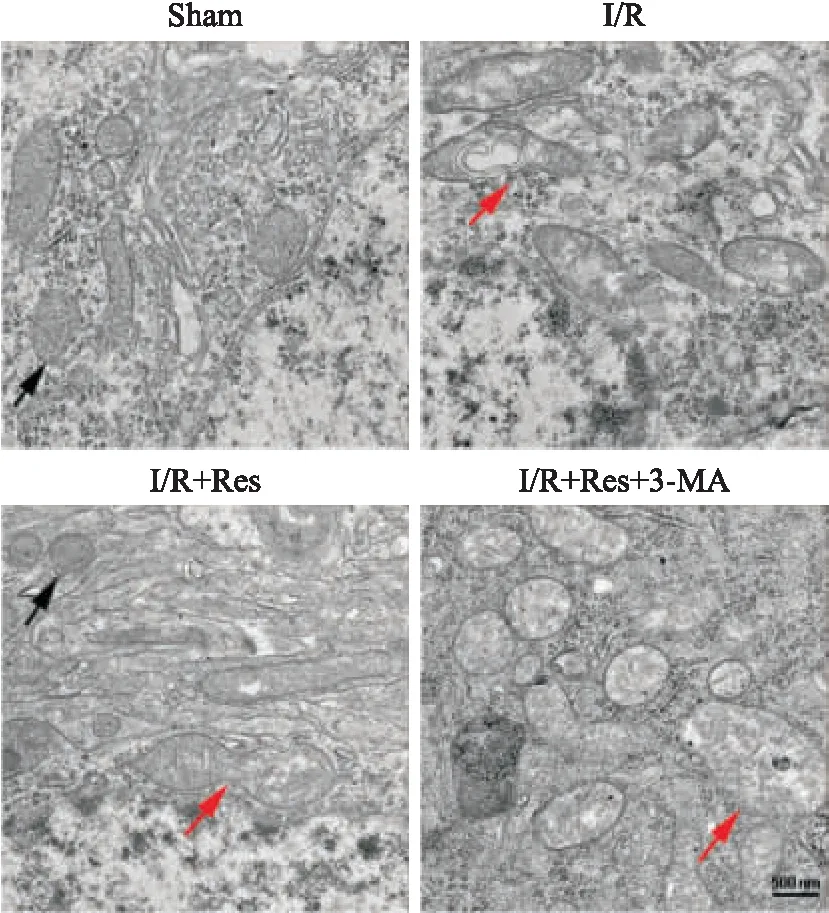
Fig 6 Changes of mitochondrial ultrastructure investigated by electron microscopy(scale bar:500 nm)
Black arrows show healthy mitochondria. Red arrows show destroyed mitochondria.
Res的药理活性与SIRT1密切相关。SIRT1作为烟酰胺腺嘌呤二核苷酸依赖的蛋白去乙酰化酶,可以调控多种组蛋白以及非组蛋白的去乙酰化水平,从而进一步调控凋亡、氧化应激、炎症的发生[10]。有文献报道,SIRT1还可以乙酰化Atg5、Atg7、Atg8以及LC3等自噬相关蛋白,从而促进自噬发生[11-12]。线粒体自噬作为选择性自噬的一种,同样也会受到这些蛋白的调控。p62、LC3B-Ⅱ在自噬/线粒体自噬中,分别发挥着标记并聚集受损蛋白、线粒体,以及形成自噬小体的作用,均在自噬过程中占据重要地位。因此,本研究选取p62、LC3B-Ⅱ为自噬/线粒体自噬发生的标志性蛋白。此外,佐证线粒体自噬的发生还需要检测线粒体相关蛋白的变化。其中,分布于线粒体外膜上的蛋白TOM20可反映出线粒体含量变化,而分布于线粒体内膜上的蛋白PHB2因其结构里具有的LC3结合域[13],有助于受损的线粒体被自噬小体锚定并最终降解,是近来被证实的线粒体自噬标记物。本实验研究结果显示,Res可以激活SIRT1,提高LC3B-Ⅱ,降低p62、PHB2、TOM20蛋白表达,当在Res预处理的基础上额外给予3-MA时,Res所引起的这些蛋白变化均被翻转。因此,进一步说明Res在减轻小鼠I/R损伤中促进了线粒体自噬发生,而且这个过程可能受到SIRT1的调控。
面对再灌注所造成的大量功能失常线粒体的堆积,线粒体自噬的参与尤为重要。它们的激活一是有效地防止损伤进一步扩大,二是为线粒体更新提供物质基础,以保证大脑的能量供应。由此可见,线粒体自噬在I/R损伤中的重要意义。但是线粒体自噬同自噬一样,均存在着许多争议。有学者认为,在缺血性脑中风中,血液复灌会导致自噬/线粒体自噬过度激活,使其从保护性角色转换成了破坏性角色。因此,抑制自噬/线粒体自噬可以减轻I/R损伤[14]。也有学者持不同的观点,认为在复灌中适当促进线粒体自噬,选择性地降解受损线粒体,对神经细胞存活十分有益[15]。总之,不必要或是不充分的降解线粒体才是自噬导致细胞死亡的原因。所以在未来的研究中,更应该关注针对不同疾病及其不同阶段中,对自噬发生强弱的控制上。
在本实验中,我们发现Res引起的线粒体自噬减轻了线粒体损伤,最终起到了脑保护作用。在对于线粒体稳态的调控中,线粒体自噬只属于其中的一环,其中还涉及到线体粒生物合成、线粒体裂解与融合相关机制的调控[8]。有文献报道,Res激动SIRT1后,可进一步调控过氧化物酶体增殖物激活受体γ辅助激活因子-1α,从而促进线粒体生物合成[2],起到平衡线粒体自噬的作用。此外,线粒体是一种处于动态变化的细胞器,其在裂解与融合这两个对立过程中维持着线粒体形状、大小、数量以及生理功能。其中,在线粒体裂解的协助下,线粒体中受损部分发生选择性自噬,而剩余的健康部分则在线粒体融合的调控下重新组装一个新的线粒体。因此,线粒体在这4部分的共同协调下维持着正常水平。本实验在电镜下观察到,Res处理组中有线粒体正处于裂解状态,提示进一步线粒体自噬的可能发生。可见,Res所发挥的脑保护作用可能涉及到对整个线粒体工作网络的调节,但是它们之间的作用机制还有待研究。
综上所述,Res减轻小鼠脑组织I/R损伤,可能与其对线粒体自噬的调控,以最终确保线粒体质量有关。本研究提示线粒体可能是治疗脑中风的重要靶点,因此,进一步探讨维护线粒体健康的调控机制,寻找相关药物作用靶点,对防治脑缺血疾病具有借鉴意义。