酰胺质子转移加权成像评估高级别胶质瘤异柠檬酸脱氢酶基因状态
陈永露,谢新凤,梅颖洁,杨粤龙,吴晓玲,刘红军,黄 飚*
(1.广东省医学科学院 广东省人民医院放射科,广东 广州 510080;2.飞利浦医疗保健事业部,广东 广州 510080)
胶质瘤是最常见的原发性脑肿瘤,其中约50%以上为高级别胶质瘤,患者预后较差[1]。2016年版WHO中枢神经系统肿瘤分类标准中,对于胶质瘤增加了一个分子学标志物——异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)[2-3]。IDH突变型高级别胶质瘤患者预后优于IDH野生型[4]。研究[1]发现IDH突变型和野生型间变性星形细胞瘤患者的生存期分别为65个月及31个月,IDH突变型和野生型胶质母细胞瘤患者的生存期分别为20个月及15个月。无创预测IDH基因型对胶质瘤患者诊疗及预后有重要意义。MR酰胺质子转移加权(amide proton transfer weighted, APTw)成像属化学交换饱和转移(chemical exchange saturation transfer, CEST)成像的一种[5],可无创探测组织中游离蛋白质及多肽链上酰胺质子与水氢离子交换速率,进而对疾病进行诊断[6]。本研究探讨高级别胶质瘤APTw成像信号变化与肿瘤IDH基因型的关系,以期在术前提供IDH基因信息,为临床决策提供依据。
1 资料与方法
1.1 一般资料 收集2016年5月—2018年3月本院因疑诊胶质瘤而接受头颅MR平扫、增强及APTw成像检查并经手术病理证实为高级别胶质瘤的25例患者,其中IDH野生型组16例,IDH突变型组9例,其一般情况见表1。所有患者MR检查前未接受任何治疗及干预;排除有金属物置入史、神志不清、幽闭恐惧症及因运动伪影而无法达到诊断要求者。
1.2 仪器与方法 采用Philips Ingenia 3.0T MR仪,15通道头部线圈。扫描序列包括轴位T1W、T2WI-FLAIR,增强T1W及APTw。采用三维TSE-Dixon序列对全肿瘤层面行APTw成像,2个射频发射源交替用于饱和脉冲。饱和脉冲强度2 μT,持续时间2 s。通过多次采集TSE-Dixon扫描获得APTw频率序列(±3.5、±3.42、±3.58、-1 540 ppm)。在±3.5 ppm处采集3个不同TE获得用于校正磁场不均匀性的B0图。成像参数:TR 5 775 ms,TE 6 ms,FOV 212 mm×182 mm×40 mm,体素1.8 mm×1.8 mm×4.4 mm,扫描时间6 min 15 s。
1.3 APTw图像分析 采用Philips磁共振仪自带软件自动重建B0校正ATPw图像。在APTw图像±3.5 ppm处计算偏置磁化转移率(asymmetric magnetization transfer ratio, MTRasym):MTRasym(3.5 ppm)=Ssat(-3.5 ppm)/S0-Ssat(+3.5 ppm)/S0,其中Ssat及S0分别为有和无射频的成像信号强度。所得MTRasym值定义为APT值,APT值越大,APT信号越高。由1名有20年以上神经影像学诊断经验的医师在不知病理结果的情况下独立分析图像。于T2WI-FLAIR图像上逐层勾画肿瘤实质部分,在APTw图像上获得相应层面肿瘤实性部分为ROI,避开常规序列中发现的血管、囊变、坏死区及易出现磁敏感伪影区,逐层测量APT值(图1、2),计算各层均值。间隔1周后由同1名医师以同样方法再次测量APT值。
1.4 病理及分子检查 对胶质瘤手术标本进行标准化处理,依据2016年版WHO中枢神经系统肿瘤分类进行定性和分级。将术后肿瘤组织固定、包埋、切片,切片厚度10 μm。采用ABI3500Dx测序仪对PCR产物进行测序。IDH1野生型:IDH1基因394位碱基为CC,395位碱基为GG,132位密码子为CGT,氨基酸为R/R。IDH1突变型:IDH1基因395位碱基发生G>A突变,导致精氨酸被组氨酸取代。
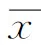

表1 IDH野生型和突变型患者一般资料
图1 患者女,47岁,胶质母细胞瘤(IDH突变型,WHO Ⅳ级) A.肿瘤主体位于左侧额顶叶,肿瘤实性成分T1WI呈低信号; B.肿瘤实性成分T2WI呈稍高信号; C.增强扫描实性成分轻度不均匀强化,周围水肿带未见强化; D.肿瘤实性成分在T2WI-FLAIR呈稍高信号; E.于T2WI-FLAIR图像中肿瘤实性成分绘制ROI; F.APTw示肿瘤实性区域呈高信号,APT值为1.7% (箭示肿瘤实性成分;箭头示肿瘤周围水肿带) 图2 患者女,59岁,间变性星形细胞瘤(IDH野生型,WHO Ⅲ级) A.肿瘤主体位于左侧顶颞叶,肿瘤实性成分增强扫描呈环形强化,中央见坏死囊变区,周围水肿带未见强化; B.肿瘤实性成分在T2WI-FLAIR呈稍高信号,中央囊变坏死呈低信号,于T2WI-FLAIR勾画肿瘤实性成分为ROI(蓝色区域),避开囊变坏死区; C.APTw图像肿瘤实性区域呈高信号,APT值2.18% (箭示肿瘤实性成分;箭头示肿瘤周围水肿带)
2 结果
IDH突变型组9例中,4例肿瘤仅累及单一脑叶,其中额叶2例,颞叶1例,岛叶1例;另5例为跨脑叶生长。IDH野生型组16例中,9例肿瘤累及单一脑叶,其中顶叶4例,额叶3例,颞叶1例,枕叶1例;7例肿瘤跨脑叶生长,其中2例位于中线区。
IDH突变型(图1)肿瘤信号尚均匀,其实性成分呈T1WI低信号,T2WI-FLAIR高信号(较周围水肿稍低),强化不均匀,部分区域强化较弱,APTw图像呈高信号,较瘤周水肿组织信号明显增高。IDH野生组(图2)肿瘤内信号混杂,常规序列图像显示肿瘤内多发斑片状、类圆形长T1长T2信号,T2WI-FLAIR呈稍高、等信号,强化不均匀,APTw图像肿瘤实性成分表现为高信号,较对侧正常脑白质明显增高。
IDH野生型组及IDH突变型组APT值分别为(3.21±0.82)%和(2.23±0.72)%,差异有统计学意义(t=2.98,P<0.05);观察者内测量可重复性高(ICC=0.919)。
鉴别IDH突变型和IDH野生型的ROC曲线见图3,AUC为0.84(P<0.05),APT值阈值为2.12%,诊断IDH野生型的敏感度为93.8%,特异度为66.7%。
3 讨论
不同高级别胶质瘤对放射治疗的敏感性、耐药性、术后复发及患者总体生存时间差异很大,肿瘤IDH突变状态对患者预后更有至关重要的影响。本研究观察高级别胶质瘤患者术前APTw成像与IDH突变类型,发现IDH野生型胶质瘤APT值明显高于IDH突变型,提示APTw成像可在术前无创预测高级别胶质瘤患者IDH突变状态。
APTw成像是一种新型MR分子功能成像方法,在给予细胞内蛋白质和多肽的酰胺质子特定频率饱和脉冲后与周边水质子进行化学交换,将部分饱和质子的能量转移到水质子,通过探测水质子信号改变来反映APTw信号强弱[5]。现阶段APTw成像研究主要集中于脑部疾病[6-7],包括脑卒中、肿瘤和神经退行性疾病等。已有多项研究证实APTw成像可为胶质瘤术前分级[8-10]及治疗效果评价[11]提供重要信息。由于胶质瘤肿瘤细胞排列致密及过度增殖的病理生理学行为导致其过度表达蛋白质和多肽[12],故肿瘤区域APTw成像表现为高信号。
2016年WHO中枢神经系统肿瘤分类首次引入分子参量,促进了脑肿瘤的临床、实验室检查、影像学及流行病学研究[1,3],其中IDH在胶质瘤分类中尤为重要。Verhaak等[13]研究发现IDH与胶质瘤的预后有密切关系,IDH突变型胶质瘤患者较IDH野生型患者有较长无进展生存期,对高级别胶质瘤患者的预后有较高的预测价值。IDH1表达于细胞质和过氧化物酶体,是三羧酸循环中的一种关键限速酶,2008年有学者[14]在癌症基因组测序计划中发现IDH1基因突变与胶质瘤关系密切。本研究中分子学检测主要根据IDH1基因相应碱基位点是否出现突变,基因突变后,三羧酸循环过程受阻,肿瘤增殖细胞蛋白质和多肽表达减少[14]。目前对胶质瘤患者IDH突变的检查方法多为手术或活检后的基因及DNA检测,均属于有创检查。尽管有学者[15]通过改良2D-MRS参数及波谱解析技术,实现了因IDH基因突变积累的产物2-羟基戊二酸的在体评估,以了解其突变状态,但2-羟基戊二酸体浓度很低,需制作专用体模及专用的MRS分析软件,所得结果的可靠性尚需探索,使得MRS评估IDH基因状态的临床应用受限。近年来,随着影像组学的发展,Zhang等[16]从常规序列中提取2 970个影像特征与临床数据整合产生的模型在实验组和验证组中判断IDH基因状态准确率分别为86%和89%;但由于样本量及不同仪器影像特征一致性等问题,还需进行更广泛的多中心研究。本研究发现高级别胶质瘤IDH野生型组APTw信号明显高于IDH突变型组,与胶质瘤的分子学水平相关研究结果[1,12]相符。Jiang等[17]对27例WHO Ⅱ级胶质瘤患者进行APTw分子影像学研究,发现基于多个ROI,IDH野生型组的最大和最小APT值以及平均APT值均明显高于IDH突变型;Paech等[18]采用7.0T MR扫描仪对31例胶质瘤(低级别胶质瘤6例,高级别胶质瘤25例)患者行CEST成像,同样发现IDH野生型组APT值明显高于IDH突变型组。
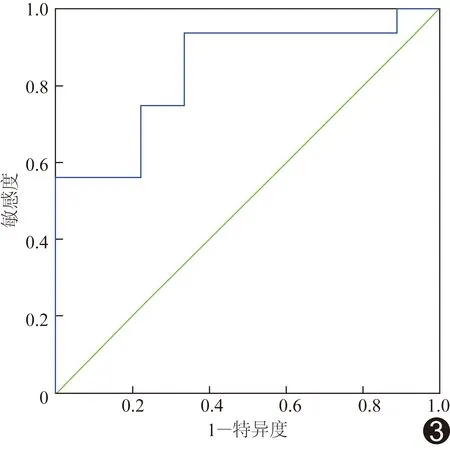
图3 APT值鉴别IDH突变型和IDH野生型的ROC曲线
高级别胶质瘤MRI表现多样,增强扫描多呈不规则环形或花环样强化,但有1/3高级别胶质瘤表现为不强化肿块[19]。Togao等[9-10]在肿瘤强化区选取ROI,若无强化时选取T2WI高信号区,因ROI选择标准不一致,结果准确性受到影响。本研究以全肿瘤T2WI-FLAIR图像肿瘤稍高信号实性成分区域为标准,于APTw图像中对应肿瘤实性成分为ROI获得APT值,包括肿瘤大部分实性区域及少许水肿,囊括肿瘤所在每一个层面,较既往研究的单层测量,更能体现基因突变后蛋白质及多肽表达的整体情况,发现以APT值=2.12%为阈值,诊断IDH野生型的敏感度达93.8%。本研究结果提示,在后续胶质瘤复查随访中,采用常规序列及APTw成像可提供更多肿瘤治疗后改变的有效信息。但本研究所获结果的特异度仅为66.7%,可能与样本量偏小、且研究对象均为高级别胶质瘤、肿瘤表达蛋白较多有关,后续将继续增加样本量并纳入低级别胶质瘤进一步观察。
总之,作为一种有价值的生物标志物成像方法,APTw成像具有无创、无辐射、无需对比剂且分辨率高等优点,可在术前预测高级别胶质瘤患者IDH突变状态,为临床提供有价值的信息。

