磁共振多模态成像及融合技术在脑胶质瘤术后放疗剂量优化中的应用
王长福 王斌杰△ 王 智 杨 泉 贺 祥 周彦汝 姜澳田 蒋会娟
1)河南大学淮河医院影像科 河南大学医学影像研究所,河南 开封 475000 2)河南大学淮河医院放疗科,河南 开封 475000
一直以来,颅脑胶质瘤术后患者在放疗前进行定位主要采用CT扫描图像。CT图像能够较好地反映软组织及骨组织的情况,但由于CT的软组织分辨率低,对肿瘤的形态、边界及水肿范围等不能精确显示。MR具有良好的软组织分辨率,可清晰分辨残留肿瘤及瘤周水肿,并能很好地判断瘤周水肿范围。近年来国内外部分医院将CT与MR图像的优势相结合,形成CT/MR融合图像对肿瘤靶区进行勾画,取得一定的成果,但方法较为单一。本研究旨在探讨基于磁共振多模态成像与CT图像融合基础上胶质瘤术后靶区勾画后对放射计量优化的价值。
1 资料与方法
1.1一般资料选取河南大学淮河医院2016-09-2018-08收治的脑胶质瘤手术治疗患者23例,术后均经病理证实。男9例,女14例,年龄37~82岁;WHO分级Ⅲ级8例,Ⅳ级15例,均为单发病例;幕上21例,幕下2例;术后残留5例。所有患者均有头痛症状,6例伴视物模糊。
1.2设备与扫描参数CT检查使用德国西门子公司16排螺旋CT扫描仪,取头先进仰卧位,机架零角度,从颅顶扫描至延髓下缘行颅脑横断位扫描,重建层厚3 mm,层间距3 mm。MR检查使用德国西门子公司3.0T Verio B17超导型磁共振仪,取头先进仰卧位,以放疗定位架、头托及头模对患者头部进行固定,表面覆盖腹部相控阵线圈,扫描范围自颅顶上至延髓下缘,前后包括鼻尖及枕部后缘。颅脑横轴位T2WI平扫:横轴位用快速自旋回波序列(TSE),TR 12 693 ms,TE 96 ms,层厚3 mm,层间距3 mm,矩阵320×320,视野(FOV)220 mm×220 mm,层数70层;横轴位T1WI压脂:快速小角度激发序列(Flash 2D),TR 488 ms,TE 2.67 ms,层厚3 mm,层间距0 mm,矩阵320×320,FOV 220 mm×220 mm,层数24层。矢状位T2WI平扫:TSE,TR 4 100 ms,TE 96 ms;MRP及增强扫描:采用高压注射器经肘前静脉注入造影剂钆喷酸葡胺(Gd-DTPA,康臣药业生产),速率4.0 mL/s,剂量0.2 mL/kg,PWI:TR 1 800 ms,TE 30 ms,层厚3 mm,层间距0 mm,矩阵128×128,FOV 230 mm×230 mm,层数24层;横轴位增强扫描T1WI脂肪抑制:TR 488 ms,TE2.67 ms,层厚3 mm,层间距0 mm,矩阵320×320,FOV 230 mm×230 mm,层数70层。
1.3MR多模态图像后处理将PWI原始图像传输至磁共振后处理工作站获得平均通过时间(MTT)、达峰时间(TTP)、脑血流量(rCBF)、脑血容量(rCBV)图像,评估病变及其周围区域血流灌注情况。并将CBV与MR增强T1WI脂肪抑制轴位图像融合,了解胶质瘤术后边界、残留及水肿范围。
1.4图像融合及靶区勾画将横轴位CT平扫、磁共振T2WI平扫、轴位T1WI脂肪抑制增强、PWI-CBV图像传至图像配准工作站(FocalFusion Workstation),将横轴位CT平扫分别与T2WI、T1WI脂肪抑制、PWI-CBV进行图像配准融合(图1A~C)。由放疗科医师、物理师及影像科医师共同评估融合效果,生成CT/T2WI、CT/T1WI-FS及CT/CBV融合图像,用于靶区勾画。先由放疗科医师在CT图像上勾画临床靶区(Clinica Target Volume,CTV)命名为CTVCT组,后由放疗科医师、物理师及影像科医师在融合图像CT/T1WI-FS、CT/T2WI、CT/CBV融合图像上勾画CTV(图1D~F)命名为CTVCT/MRI,对肿瘤残留区域及危险器官(organs at risk,OAR)如海马、视神经走形区、脑干区域做相应修改。
1.5剂量计划将完成靶区勾画的CT文件传至计划系统作治疗计划(图1G~I)。对于术后残留病例,模拟两种类型剂量计划即60 Gy IMRT和64.2 GyIMRT-SIB)。60 Gy IMRT的治疗计划,GTVtb被定义为在T1WI增强图像上可见的瘤床/术后残腔,代表亚临床肿瘤受累的临床靶体积(CTV1)定义为GTVtb +20.0 mm,计划目标体积(PTV1)定义为CTV1 + 3.0 mm范围。剂量计算根据PTV1常规分割2 Gy×30次,总量60 Gy的常规处方进行。64.2 Gy IMRT-SIB治疗计划,GTVP被定义为残存肿瘤T1WI增强同时CBV相对高灌注,PGTVp定义为GTVP + 3.0~5.0 mm范围。剂量处方如下:在PTV1的剂量基础上,PGTVp的64.2 Gy(SIB)以2.14 Gy×30次,总量64.2 Gy的同步加量处方进行。
1.6观察指标按靶区勾画图像基础分为2组,CT定位图像组CTVCT及CT、MRI图像融合组CTVCT/MRI,利用治疗计划系统上靶区勾画体积计算功能分别计算CTVCT体积和CTVCT/MRI体积,观察不同组间勾画靶区体积的差异;评估两种类型剂量计划即60 Gy IMRT和64.2 Gy IMRT-SIB对术后残留病例OAR的剂量差异。

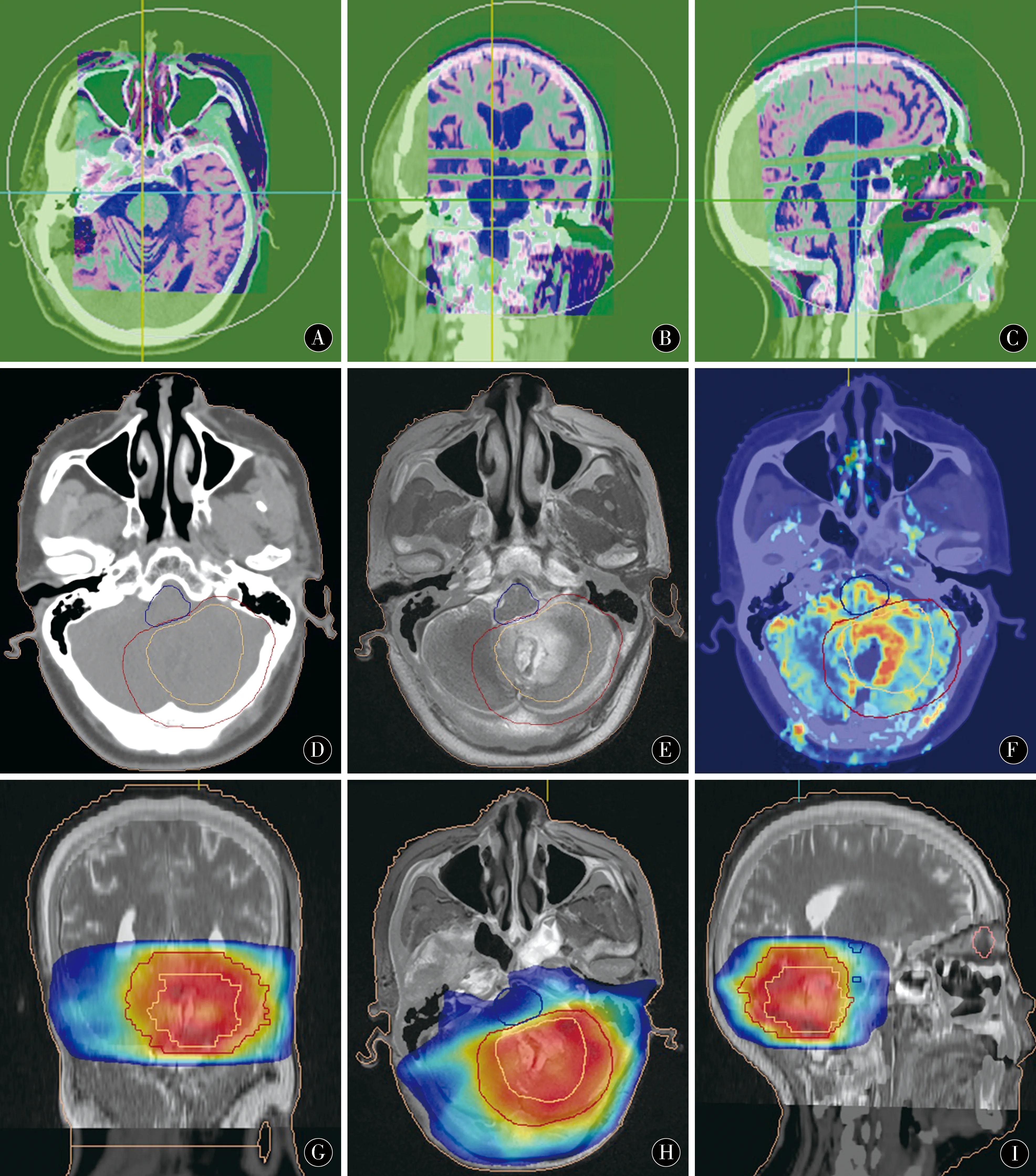
图1 A~C:在FocalFusion Workstation进行CT、MRI图像融合配准;D~F:CT/MRI图像融合用于临床靶区勾画,F为CT图像;G~I:基于CT/MRI融合图像勾画靶区生成的放射治疗计划,G为CT/T2WI融合图像,H为CT/CBV融合图像小脑胶质瘤术后残留,术区边缘CBV为高灌注Figure 1 A-C:FocalFusion workstation for CT and MRI images fusion registration;D-F:CT and MRI fusion images for CTV delineation,figure F is CT image;G-I:Target volume delineation generated radiotherapy plan based on CT/MRI fusion,figure G is CT/T2WI fusion image,figure H is CT/CBV fusion image of postoperative residualcerebellar glioma,the edge of operative area showed high perfusion on CBV map
2 结果
由放疗工作站计算生成两组数据CTVCT和CTVCT/MRI体积[(324.83±68.78)cm3vs (308.51±70.52)cm3]比较,差异有统计学意义(t=2.482,P=0.021)。两种类型剂量计划即60 Gy IMRT和64.2 Gy IMRT-SIB对术后残留病例OAR的剂量比较,视交叉的1%接收的最大剂量IMRT vs IMRT-SIB[(43.26±11.24)Gy vs (43.58±9.52)Gy],差异无统计学意义(P=0.797);脑干的1%接收的最大剂量IMRT vs IMRT-SIB[(44.16±13.00)Gy vs (44.44±13.98)Gy],差异无统计学意义(P=0.700)。
3 讨论
在颅脑胶质瘤的术后放射治疗中,精确的靶点勾画是有效治疗的关键,对疗效评估及减少术后并发症至关重要。很长时间以来,由于受放疗定位装置多为金属性的限制及CT操作的简便性和快捷性,放疗定位大多在CT机上进行[1]。但这种方法也有其局限性,CT的软组织分辨率较低。大多时候颅脑正常结构与肿瘤之间密度相近,不能显示肿瘤真实边界,为最大程度包括肿瘤区域,实际工作中往往在原肿瘤区域的基础上向外扩展一定范围[2],勾画及外扩范围受主观因素影响较大。同时颅脑接近骨质的地方也易出现条纹状伪影而影响肿瘤的观察。治疗过程中目标勾画中的任何错误都有可能导致肿瘤区域的照射剂量过大或对关键部位的不必要照射,这些都是在治疗过程中需要考虑的风险。为减少这种不确定性,寻找新的成像方法用于放疗定位已成为必然。MR成像则有效避免了CT的缺点,由于其软组织分辨率高,可以很好区分肿瘤病变与周围结构的关系[3],还可减少骨质对脑组织的影响,同时也避免辐射对患者带来的危害,而且也可以很好发现颅脑微小转移灶。但受磁共振、放疗设备及磁共振成像技术的限制,使MR图像一般不能直接用于放射治疗计划系统。将CT与MR优势相结合,则可以在放疗定位中起到精确勾画靶区、减少正常组织受量、提高肿瘤局部剂量的作用。因此,CT/MRI图像融合技术近年来在放射治疗术前定位中得到较为广泛的应用[4-9],其靶区勾画的精确性、治疗的高效性及减少并发症已得到证实[10-14]。
但常规的CT/MRI图像融合技术也由其局限性,即不能解决生物靶区的勾画,因常规MR更多的是反映肿瘤的解剖特性,而无法了解靶区内部的生物学信息,如缺氧、增值等与肿瘤的区分[15]。对于胶质瘤颅内转移来讲,在外科手术治疗后再手术的机会是不常见的。对于放射性脑病而言,其风险随着放疗靶区勾画体积的增大而提高,一旦出现也不必要再次放疗干预。对于复发性胶质瘤或颅内转移,精确评估肿瘤的边缘及区分肿瘤与水肿区也至关重要[16]。磁共振多模态成像则可以很好解决这些问题。本课题旨在利用磁共振多模态成像技术对颅脑胶质瘤术后区域及周围结构进行评估,并将其与CT图像融合指导CTV的精确勾画,优化放射治疗计划的制定,达到精准治疗的目的。
磁共振多模态功能成像技术作为一种非创伤性、无辐射性评价肿瘤微血管及颅脑功能的技术,已成为当前肿瘤学及放射学的研究热点并广泛应用于临床[17-18]。本研究采用脑灌注加权成像(PWI)对颅脑胶质瘤术后残留及瘤周水肿进行判定。PWI是在分子水平反映组织微血管分布和脑血流灌注的一种功能性技术,高级别胶质瘤或转移瘤实性部分新生血管丰富、密度大、异型性大、增殖活跃、新生血管结构不成熟,从而致微循环通透性高。我们通过测量肿瘤的rCBF、rCBV、MTT和TTP,可以间接反映肿瘤的血流动力学,进而反映肿瘤内皮细胞的增值和内皮的新生血管化[19-20],从而提供有关肿瘤的功能信息。依靠rCBV图可以更敏感的检测到肿瘤的浸润程度,精确的反映肿瘤真实边界[21-23],更有利于靶区精准勾画,以达到精准治疗的目的[24-25]。同时,利用脑灌注成像也有利于分别放射性坏死与肿瘤复发[26-29],从而有利于放疗计划的制订。
本组研究通过对23例颅脑胶质瘤术后放疗靶区勾画的分析显示,利用CT/MRI多模态图像融合技术明显优于单纯的CT图像。本组病例中CT图像上勾画的CTVCT值(324.83±68.78)cm3,CT/MRI多模态融合图像上勾画的CTVCT/MRI值(308.51±70.52)cm3,两者差异有统计学意义。CT/MRI多模态融合图像上勾画的CTVCT/MRI体积明显精确于单纯CT图像上勾画的CTVCT体积,颅脑内的重要固定解剖结构,如脑动脉、视神经、神经纤维束等在CT/MRI融合图像中也能清晰地分辨显示,靶区勾画时可有意识避开这些重要结构,治疗效果令患者满意。这些都揭示了该项技术的可靠性及有效性,也为颅脑胶质瘤术后患者在进一步放射治疗时提供了很好的放疗前精准定位方法。
图像融合成功的关键是CT图像、MR横断位T2WI图像、T1WI-FS增强图像及MR灌注图像的空间配准。首先,对患者进行常规CT定位扫描,然后利用定位架、头托及头模对头部固定进行MR扫描,相同的定位架、角度、层厚、层间距及利用红外线校准正中定位是保证图像融合的关键。MRI扫描时利用腹部线圈而不是头部线圈覆盖头部,主要是头部线圈较小不能将定位架一同覆盖,而腹部线圈则很好地解决了这个问题。覆盖腹部线圈时要将线圈周围用沙袋固定,使之尽量贴近颅脑,以保证成像图像质量。图像配准在放疗科FocalFusion工作站完成,然后在FocalPro工作站生成CT/MRI-T2WI、CT/MRI-T1WI-FS及CT/MRI-rCBV融合图像,用于靶区勾画。在此过程中,由于肿瘤的异质性致不同可使肿瘤呈现不同的形态及位置,MRI图像分辨率的降低可导致肿瘤边界显示不够清晰,患者的不配合可导致图像化学伪影,CT与MRI图像扫描不规范会导致图像精准融合困难等,这些都会因不确定性增加而影响肿瘤的精准勾画,因此规范操作流程、统一扫描参数、注重细节显得尤为重要。在图像融合前,也要对磁共振rCBV图像、弥散图像(DWI)、T2WI图像及T1WI压脂增强图像进行详细阅读,以精确判断肿瘤的实性部分、囊变坏死、肿瘤边缘、周围浸润、水肿范围及邻近重要神经和血管结构,确保图像勾画的准确性[30-33]。
磁共振多模态功能成像结合CT与MRI图像融合技术在颅脑胶质瘤术后放射治疗计划中准确提供了肿瘤组织分布的细节情况,提高了放疗靶区勾画的精准度,减少了主观因素差异性,从而达到了优化放射治疗剂量、提高放射治疗疗效、减少放射治疗并发症的效果,也大大降低了肿瘤的复发率。同时多模态成像技术也可用于放射肿瘤效果的评估和肿瘤复发的监测,因而具有很好的临床应用意义。

