支气管哮喘小鼠肺组织miR-155的变化及对环氧合酶-2的影响
周好好 黄翠萍
1湖北医药学院临床医学院,十堰442000;2湖北科技学院临床医学院,咸宁437100
支气管哮喘(哮喘)是一种以嗜酸粒细胞、肥大细胞和气道黏膜下层CD4+T 淋巴细胞浸润为主的免疫功能异常的慢性气道炎症性疾病。microRNA-155(miR-155)是位于人类第21号染色体的BIC基因外显子3编码的一种多功能RNA,其与癌症以及先天和获得性免疫疾病相关[1],被证实与哮喘气道炎症关系密切。环氧合酶-2/前列腺素E2(cyclo-oxygen-ase-2/prostaglandin E2,COX-2/PGE2)参与驱动气道重塑的细胞反应,长期以来被认为在哮喘气道炎症的发病中起关键作用,可以快速而强烈地表达以响应各种促炎细胞因子和介质[2],通过这些介质和化学引诱物引起细胞浸润并因此延长炎症反应,有助于哮喘气道炎症环境[3]。研究证实,COX-2 表达的调节与组蛋白翻译后修饰和miRNAs等有关[4-5],但 miR-155-5p 是否能够调控COX-2的表达尚未报道。本研究通过观察哮喘小鼠肺组织中miR-155-5p的变化及其拮抗剂对COX-2表达的影响,以探讨miR-155在哮喘中的作用及可能机制。
1 材料与方法
1.1 动物 SPF级健康雌性BALB/c小鼠(由北京维通利华实验动物技术有限公司提供,许可证号:11400700254656)28只,6~8 周龄,体质量(20±2)g。
1.2 实验试剂及仪器 卵清蛋白(ovalbumin,OVA)(美国sigma,纯度62%~88%),4%氢氧化铝凝胶(中国西安赫特,500 ml),mmu-mir-155-5p antagomir(中 国 GenePharma,2OD),MircroRNA inhibitor NC(中 国 GenePharma,1OD),Mmu-miR-155-5p探针法RT-PCR 试剂盒(中 国 GenePharma),M-COX-2 RT-PCR 试 剂 盒(中国GenePharma),PGE2 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(中国上海酶联生物科技),兔抗COX-2(美国CST)。402A I超声雾化器(中国上海鱼跃医疗设备有限公司),多功能酶标仪(美国Bio-Tek公司),荧光定量PCR 仪(美国Bio-Tek 公司),3-18K高速冷冻离心机(德国Sigma公司)。
1.3 方法
1.3.1 动物分组 适应环境7 d,28只小鼠随机分为正常对照组、哮喘模型组、antagomir阴性对照组、antagomir干预组,每组7只。
1.3.2 模型制备 根据文献分致敏和激发两个阶段[6]。第0、7、15天三次致敏,正常对照组腹腔注射0.2 ml生理盐水,其余各组腹腔注射0.2 ml致敏液(含4 mg OVA+150μl氢氧化铝)。第22~27天为激发阶段,将小鼠置于雾化箱内(20 cm×20 cm×30 cm),每天雾化40 min,正常对照组雾化溶液为生理盐水,其余各组使用10% OVA 生理盐水作为激发液。第23、25、27天激发前6 h,正常对照组和哮喘模型组尾静脉注射0.3 ml生理盐水,antagomir阴性对照组与antagomir干预组分别尾静脉注射0.3 ml MircroRNA inhibitor NC和0.3 ml mmu-miR-155-5p antagomir。
1.3.3 标本采集及处理 各组小鼠末次激发24 h后,腹腔注射10%水合氯醛0.1 ml(400 mg/kg)麻醉,摘眼球取眼球血,4 ℃冰箱血液自然凝固,过夜,4 ℃,3 000 r/min,离心20 min,离心半径15 cm,取血清,保存-20 ℃冰箱,参照试剂盒做ELISA 检测PGE2。小鼠处死后,取右肺门中叶,生理盐水冲洗后,10%多聚甲醛固定24 h,做3μm 切片,用于HE 染色,观察形态学变化,其余肺组织生理盐水冲洗后,液氮速冻,保存于-80 ℃冰箱。
1.3.4 肺组织miR-155-5p和COX-2 m RNA 的检测 采用 RT-PCR 检测 miR-155-5p 及 COX-2 m RNA 的表达。检测试剂盒购自GenePharma,按说明书进行操作。
Trizol法提取RNA:取-80 ℃冰箱中保存的新鲜冰冻肺组织,质量约为100 mg,加入1 ml Trizol试剂,研磨成浆,移至无RNase EP 管中,裂解10 min;加入200μl氯仿,颠倒混匀数次,室温放置5 min;4 ℃,12 000 r/min,离心15 min,离心半径15 cm,可见分成上层、中层、下层三相;转移上层水相(约400μl)于1.5 ml新EP管中,加入400μl异丙醇,混匀后室温静置10 min;4 ℃,12 000 r/min,离心10 min,离心半径15 cm;弃上清,加入无RNase的75%乙醇1 ml,涡旋混匀后,4 ℃,10 000 r/min,离心5 min,离心半径15 cm;弃上清,加入无RNase的75%乙醇1 ml,涡旋混匀后,4℃,10 000 r/min,离心5 min,离心半径15 cm;弃上清,空气中干燥RNA 沉淀5~10 min,将沉淀溶于20μl DEPC水中;取溶解后的RNA 2μl测定OD260、OD280以及 OD260/OD280 值,计算 RNA 的纯度和浓度。
逆转录:按反应体系[RNA 2μl+Random N6(100μmol/L)5μl]加热70 ℃5 min后,马上放于冰盒上,反应物按20μl体系进行,反应条件:37 ℃60 min,85 ℃5 min。
聚合酶链反应:miR-155-5p和COX-2 m RNA引物序列购自吉玛基因。M-COX-2引物序列(上游: 5'-CAAGCACAATAGATGCACAAGAAG-3',下游:5'-ATATAGAATGCGTAGAGAGGGGAG-3'),GAPDH 引物序列(上游:5'-ATGGGTGTGAACCACGAGA-3',下 游:5'-CAGGGATGATGTTCTGGGCA-3'),COX-2和GAPDH扩增产物分别为98 bp和229 bp。miR-155-5p按20μl体系进行,反应条件:95 ℃3 min;95 ℃12 s,62 ℃ 40 s,40 个 循 环。COX-2 mRNA 按20μl体系进行,反应条件:95 ℃3 min;95 ℃12 s,62 ℃40 s,40个循环。绘制溶解曲线,最终数据以2-△△Ct进行分析。
1.3.5 肺组织COX-2蛋白的检测 取冻存的肺组织50 mg,放入匀浆器中进行冰上碾压,然后加入400μl裂解液(RIPA 1 ml+10μl PMSF+10μl磷酸酶抑制剂)冰上裂解30 min,用移液器将裂解液移至1.5 ml 离心管中,然后在4 ℃下12 000 r/min离心5 min,离心半径15 cm,取上清即为总蛋白,-20 ℃保存备用,BCA 法测蛋白浓度。将提取的蛋白加入蛋白上样缓冲液,放入沸水中进行沸水浴10 min,变性完后冷却至室温再放入-20 ℃保存。上样蛋白量40μg,5%浓缩胶,12%分离胶进行十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,转膜(PVDF膜),用含5%脱脂奶粉的TBST 浸泡PVDF膜,室温摇床封闭2 h。敷一抗COX-2(1∶1 000),于4℃摇床孵育过夜,次日室温下洗膜,敷HRP标记羊抗兔二抗(1∶50 000),37 ℃摇床孵育2 h。TBST洗膜,DAB显色。用图象分析仪测定各条带的吸光度值定量分析。
1.3.6 血清PGE2的测定 取出-20 ℃冻存的血清,参照ELISA 试剂盒说明书,平行重复试验并记录结果。
1.3.7 肺组织病理学观察 HE 染色观察支气管壁及血管壁周围有无炎症细胞浸润。
1.4 统计学分析 采用SPSS 22.0软件及GraphPadPrism 5.0软件进行分析。进行单因素方差分析(oneway-ANOVA),全部数据以表示,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠的活动表现 致敏阶段,各组小鼠表现均正常,各组间无差异;激发阶段,哮喘模型组和antagomir阴性对照组小鼠出现打喷嚏、搔鼻、安静少动、点头样喘息等典型的哮喘症状,而antagomir干预组小鼠的哮喘症状不典型,正常对照组小鼠表现正常。
2.2 各组小鼠肺组织miR-155-5p 和COX-2 mRNA表达变化 哮喘模型组miR-155-5p、COX-2 m RNA 的表达均较正常对照组显著升高(t=-21.420、-15.270、-9.613,P值均<0.01);antagomir干预组miR-155、COX-2较哮喘模型组显著降低(t=-15.273、-12.421,P值均<0.01)。miR-155-5p和COX-2 mRNA 的表达呈显著正相关(r=0.977,P<0.01)。见图1,表1。

图1 各组小鼠肺组织 miR-155-5p 和COX-2 mRNA 的表达
表1 各组小鼠肺组织miR-155-5p和COX-2 m RNA 的表达()

表1 各组小鼠肺组织miR-155-5p和COX-2 m RNA 的表达()
注:COX-2为环氧合酶2;与正常对照组相比,a P <0.01;与哮喘模型组相比,b P <0.01
组别 鼠数 miR-155-5p COX-2 mRNA正常对照组 7 1.07±0.07 1.01±0.08哮喘模型组 7 1.99±0.03a 2.04±0.09a antagomir阴性对照组 7 2.09±0.07a 2.10±0.06a antagomir干预组 7 1.40±0.02b 1.40±0.02b
各组目的基因miR-155-5p、COX-2 m RNA 和内参基因U6、GAPDH 扩增曲线图和融解曲线图。见图2~9。

图2 各组目的基因miR-155-5p扩增曲线图
图3 各组内参基因U6扩增曲线图
图4 各组目的基因COX-2 m RNA 扩增曲线图

图5 各组内参基因GAPDH 扩增曲线图
从以上各组目的基因和内参基因扩增曲线图和融解曲线图可以看出(图2~9),各标本均有扩增,且扩增效率高。各标本融解曲线无二聚体及非特异性扩增,相同目的基因各峰值基本一致,说明引物设计合理,特异性高。Ct值采用2-△△Ct进行相对定量。

图6 各组目的基因miR-155-5p融解曲线图
图7 各组内参基因U6融解曲线图
图8 各组目的基因COX-2 m RNA 融解曲线图

图9 各组内参基因GAPDH 融解曲线图
2.3 各组小鼠肺组织COX-2蛋白的变化 哮喘模型组和antagomir阴性对照组COX-2 蛋白的表达较正常对照组和antagomir干预组显著升高(P<0.01)。见图10,表2。
2.4 各组小鼠血清PGE2 的表达 哮喘模型组PGE2的表达较antagomir干预组显著升高(t=6.025,P<0.01)。COX-2蛋白和血清PGE2的表达呈显著正相关(r=0.931,P<0.01)。见图10,表2。
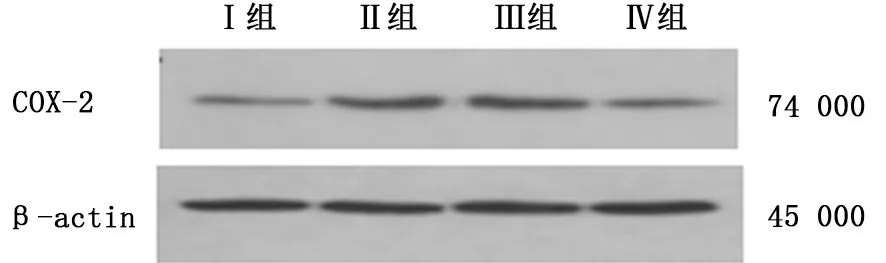
图10 各组小鼠肺组织COX-2蛋白变化
表2 各组小鼠肺组织COX-2表达和血清PGE2的表达的变化()
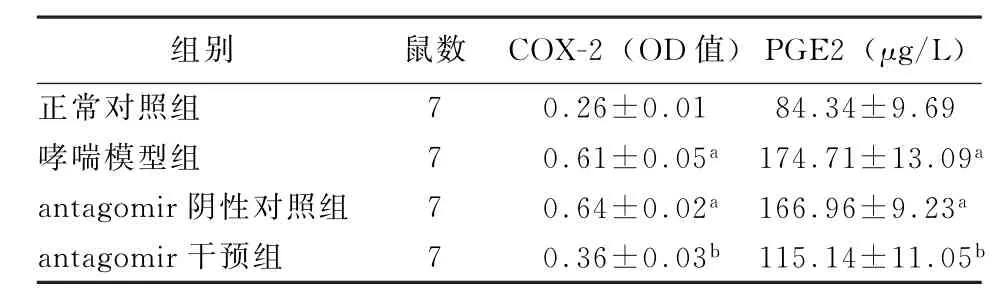
表2 各组小鼠肺组织COX-2表达和血清PGE2的表达的变化()
注:COX-2为环氧合酶2;PGE2为前列腺素E2;与正常对照组相比,a P <0.01;与哮喘模型组相比,b P <0.01
组别 鼠数 COX-2(OD值)PGE2(μg/L)正常对照组 7 0.26±0.01 84.34±9.69哮喘模型组 7 0.61±0.05a 174.71±13.09a antagomir阴性对照组 7 0.64±0.02a 166.96±9.23a antagomir干预组 7 0.36±0.03b 115.14±11.05b
2.5 肺组织病理学变化 哮喘模型组小鼠较正常对照组炎症细胞浸润明显;antagomir干预组与哮喘模型组相比,炎症细胞浸润减轻;antagomir阴性对照组与哮喘模型组相当。见图11。
3 讨论
微小RNA(microRNA,miRNA)是一类长度为19~24个核苷酸的内源性非编码RNA 分子,主要存在于真核生物中,具有高度保守性、时序性和组织特异性。miRNA 最早在1993 年由Lee等在秀丽新小杆线虫中发现,随后对其研究越来越广泛,并确定了上千种miRNAs。miRNA 通过与靶基因的3'UTR 区完全或不完全配对结合,诱导靶m RNA 降解或翻译抑制,实现对靶基因转录和表达的调控,在各种生物过程中发挥重要作用,包括细胞凋亡、癌症的发生和炎症的形成。一个单独的miRNA 可以作用于多个靶位基因,同样一个靶位基因也可以由多个miRNAs来调控,对疾病具有网络调节的作用[7],是免疫系统中基因表达的重要调节因子。miRNA 表达失调与人类疾病密切相关,最近的研究证实了miRNA 在过敏性气道炎症中发挥重要作用[8-9]。最近的一份报告证明HLA-G(一种哮喘易感基因)的3'-UTR 上的单核苷酸多态性影响三种miRNA 与该基因的结合[10]。由于哮喘肺组织中基因和蛋白表达显著变化的特征,过敏性气道炎症可能对miRNA 的调节特别敏感。在过敏性气道炎症模型中:miR-21通过IL-12p35的负调控在Th2 细胞的极化中起作用;miR-126 与变应性气道炎症的房尘螨小鼠模型中的天然和适应性免疫应答相关,其拮抗作用显著抑制Th2细胞的效应功能和嗜酸粒细胞气道炎症的发生;miR-145的拮抗作用表现出对嗜酸性气道炎症、Th2细胞因子产生、黏液分泌过多和气道高反应性的抑制作用。已有研究推测[11],miRNA-126下调可能通过调节Th平衡,造成Th2优势应答,使B淋巴细胞增殖分泌IgE,导致嗜酸粒细胞及炎症介质IL-6增高。有文献报道,过表达miRNA-26a能使气道平滑肌细胞增生肥厚,导致气道重塑增加[12]。Kumar等[13]证实Let-7缓解过敏性哮喘气道炎症,降低气道高反应性,防止黏膜上皮细胞化生及上皮细胞纤维化的作用。上述研究突出了miRNA 对过敏性疾病发病机制的调控作用及其作为抗炎靶标在治疗过敏性疾病中的潜在作用,由此,为针对miR-155的进一步研究奠定了基础。
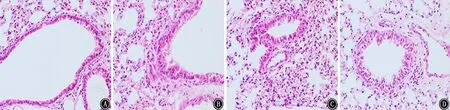
图11 肺组织病理学变化 HE ×400 A:正常对照组;B:哮喘模型组;C:antagomir阴性对照组;D:antagomir干预组
miR-155在活化的B细胞、T 细胞、巨噬细胞和树突状细胞中的表达均显著增加,这与免疫细胞的活化、增殖、分化和免疫应答密切相关,被认为在维持人类免疫系统功能中发挥重要作用[14]。Calame[15]认为,在免疫应答的效应阶段,miR-155是清除病原体和凋亡细胞免疫效应阶段的关键调节剂,为B 细胞抗原特异性抗体的产生和生发中心反应所必需,参与B 细胞成熟、分化和感染反应期间的抗体类转换。miRNA-155具有数百个可调节的潜在靶向基因,在T 辅助细胞分化和生化中心反应的调解中具有重要作用,可导致最优的T 细胞依赖的抗体反应,部分是由于细胞因子产物的调节[16],其表达与前炎症转录程序密切相关,数小时内即可对合适的刺激做出反应[17]。Malmhäll等[18]研究表明,缺乏miR-155的表达导致抗原刺激的小鼠肺内嗜酸粒细胞炎症、黏液分泌、Th2 细胞数及其细胞因子明显减少,提示miR-155在Th2介导的过敏性嗜酸粒细胞炎症发生发展过程中必不可少。据报道,糖皮质激素通过下调miR-155的表达来减弱脂多糖诱导的炎症反应和败血症。实际上,糖皮质激素的抗炎作用可以通过抑制miR-155 的表达来逆转,因此miR-155的类固醇抑制可能是免疫反应中的一种新功能途径[8],为miR-155参与哮喘发病机制的进一步研究提供新的依据。
COX 又称前列腺素内氧化酶还原酶,是一种具有环氧化酶和过氧化氢酶活性的双功能酶,通过调节花生四烯酸转化为前列腺素的代谢过程直接参与哮喘气道炎症。OVA 刺激 COX-2 缺陷(COX-2-/-)小鼠的肺、淋巴结和支气管肺泡灌洗液中 Th17 细胞分化明显下降,提示COX-2 是Th17细胞分化的关键调节子,参与过敏性肺部炎症[19]。炎症介质刺激人气道平滑肌细胞COX-2表达上调,PGE2 分泌增多,激活环磷酸腺苷/激酶A 途径,破坏β2肾上腺素能受体G 蛋白α亚单位的结合,降低β2 肾上腺素能受体激动剂反应性,是导致哮喘患者症状不能有效控制的重要原因[20]。
COX-2表达的调节与组蛋白翻译后修饰和miRNAs等有关,本研究通过real-time PCR 和western-blot方法检测各组小鼠肺组织中miR-155-5p、COX-2 m RNA 及 COX-2 蛋白的表达,通过ELISA 方法检测各组小鼠血清PGE2 的水平,结果发现,哮喘模型组小鼠肺组织miR-155-5p 和COX-2/PGE2的表达均较正常对照组显著升高;antagomir 干预组小 鼠 肺组织 miR-155-5p 和COX-2/PGE2的表达明显低于哮喘模型组;此外,miR-155-5p和COX-2的表达呈正相关,COX-2和血清 PGE2 的表达呈正相关。 结果提示,miR-155-5p很可能在哮喘发病机制中发挥重要作用,可能是通过COX-2/PGE2途径调控哮喘。本实验研究证实,miR-155-5p在哮喘小鼠肺组织中表达上调,可能参与哮喘发病机制,可能通过COX-2/PGE2途径调控哮喘。抑制miR-155-5p表达有助于改善哮喘症状,减轻炎症因子表达,有望成为哮喘治疗的新策略。
利益冲突所有作者均声明不存在利益冲突

