非线性动力学方法可预警直立倾斜试验中血管迷走性晕厥的发生
李 凡,王汉斌,彭 清,孙云闯,张 冉,庞 博,方 竞,张 珏△,黄一宁△
(1. 北京大学第一医院神经内科,北京 100034; 2.北京大学前沿交叉学科研究院,北京 100871)
晕厥是一类由于一过性全脑血流下降导致的短暂意识丧失性疾病的统称,临床上具有发作性、短暂性和自限性的特点[1]。晕厥的主要危害在于具有一定的致残性和致死性,据报道,约有6%的晕厥患者会造成外伤骨折和引发交通事故,约29%的晕厥患者会伴有轻微的皮肤淤青或挫伤,约12%反复发作的晕厥会造成骨折和软组织挫伤[2]。最常见的晕厥是神经反射介导性晕厥,通常也被称为血管迷走性晕厥、血管减压性晕厥或反射性晕厥[3]。
导致晕厥发生的主要机制在于患者一过性全脑血流下降,导致维持意识水平的脑干网状结构上行激活系统的血供减少引起短暂性功能抑制[4]。脑血流的自动调节功能在此过程中处于失代偿状态,为了有效评价脑血流的自动调节功能,哈佛医学院2004年提出了多模态血压和脑血流分析(multimodal pressure-flow,MMPF)的方法,通过希尔伯特-黄变换(Hilbert-Huang transform,HHT)将血压和血流相位关系量化,用于评估脑血流的动态调节功能[5-8].
当心输出量下降时,相应于心动周期中的舒张期的脑血流速度也会下降,此时脑部小血管会由于收缩而使得舒张早期血流速度下降后再次出现轻度上升,表现为脑血流速度在舒张早期出现重搏切迹。对于血管迷走性晕厥患者,当晕厥发生时,血压或心率的迅速下降可以引起脑小血管张力丧失,引起脑血流舒张早期重搏切迹的加深[9-10]。Albina等[11]的研究证实了在血管迷走性晕厥患者中,直立倾斜试验过程中的大脑中动脉在舒张期出现明显的血流速度下降,还描述了直立倾斜试验阳性患者典型的脑血流速度波形改变,包括重搏切迹的一过性加深,这些改变是全身血流动力学改变引起的脑血流自动调节功能改变的结果,可用于预测后期血管迷走性晕厥的发生。
基于现有的临床研究,本课题组认为对于血管迷走性晕厥患者而言,在发作间期,其脑血流自动调节功能与常人无异,只有在晕厥即将发生时,其脑血流动态调节的规律才被打破,出现脑血流失代偿,而舒张早期重搏切迹的加深就是脑血流失代偿的早期表现。因此,本研究旨在设计新的参数晕厥指数(syncope index,SI)将重搏切迹加深程度量化评估,并通过与晕厥发生前不同时间段内血流动力学参数的比较,尝试评价其用于预测晕厥事件发生的可能价值。
1 资料与方法
1.1 研究对象
血管迷走性晕厥患者20人,其中男性8人,女性12人,平均年龄(41±12)岁。入选条件包括在过去3年里有1次晕厥发作。完善Holter及超声心动图检查除外器质性心脏疾病(如心率失常、心脏瓣膜病及心肌病等),完善颈部血管彩超、经颅多普勒超声(transcranial Doppler ultrasonography,TCD)、头颅MRI及脑电图等相关检查,排除脑血管疾病及癫痫。20名健康志愿者作为对照组,包括15名男性,5名女性,平均年龄(37±19)岁。对照组被试无晕厥发作史且直立倾斜试验全部为阴性结果。试验组与对照组的基线信息详见表1。
本研究开始前已经北京大学第一医院伦理委员会审查批准(2009S01831), 所有参与研究的患者与健康志愿者均签署知情同意书。

表1 试验组与对照组的基线特征比较Table 1 Baseline characteristics of patients group and control group
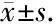
1.2 试验方法
所有被试在直立倾斜试验前都要平卧30 min,同时使用TCD 2 MHz Doppler监测探头(德利凯监测系统EMS-9A)监测双侧大脑中动脉血流速度,心电监护监测心率,使用Finometer® PRO (FMS, Finapres Medical Systems, Amsterdam, The Netherlands)连续每搏血压监测指端无创连续血压。在进行10 min基线数据采集后,被试继续进行70°直立倾斜试验,每位被试至少直立30 min,在30 min内出现晕厥发作或晕厥前兆时或当被试的血压出现突发血压下降≥20 mmHg时终止检查。晕厥发生的时间点被认为是收缩压下降到最低的时间点。为减少由于卧立位体位改变引起的探头移位,试验中使用自动探头检索系统(PW2M, Aaslid copyright)和固定头架系统(DTT01)保证体位改变后探头仍然能够追踪监测到信号强度最大的脑血流信号。所有连续每搏血压及脑血流速度数据通过125 Hz的采样频率进行数据采集,并转化成50 Hz的频率进行数据分析。所有的数字数据都是由同一台装有模拟到数字采集卡的计算机同步获取的。
对于血管迷走性晕厥患者,在晕厥发生前出现了舒张期脑血流重搏切迹加深的现象(图1),Vs代表收缩期脑血流速度峰值,Vd代表舒张晚期脑血流速度。本研究首先定义3个血流动力学参数,包括Vp=Vs-Vd,Vin代表在舒张期出现重搏切迹拐点处的脑血流速度,Vdn代表重搏切迹处的脑血流速度Vdn=Vin-Vd,然后,定义晕厥指数的计算方法如下:
SI=Vdn/Vp
(1)

A, supine rest; B, immediate after tilt; C, before syncope point; D, in different stage: supine rest, black line; third last minute before return to supine, red line; second last minute before return to supine, green line; first last minute before return to supine, blue line. A, also showed systolic blood flow velocity(BFV), diastolic BFV and inflexion BFV, definition of pulse velocity and Dicrotic velocity.图1 典型血管迷走性晕厥不同时相脑血流速度的重搏切迹Figure 1 Dicrotic notch of a typical vasovagal syncope patient during different stage
为了计算晕厥指数(SI),需要找到舒张期脑血流速度信号中出现重搏切迹的拐点,然而,在很多病例中会出现类似图1B的情况,由于不可避免的信号干扰,准确寻找到用于测量重搏切迹的拐点非常困难。本研究使用整体经验模式分解(ensemble empirical mode decomposition,EEMD)方法来检测拐点(图2),这包括主要的4个步骤: (1) 用集合经验模态分解法将BFV信号分解为多个经验模态; (2) 选择相应受试者心率的经验模式(0.5~1.2 Hz);(3)检测到所选模式中拐点的位置;(4)计算出晕厥指数(SI)。
传统的脑血流动力学参数搏动指数(PI)与阻力指数(RI)可以通过脑血流速度测量计算出来,具体方法如下:
PI=(Vs-Vd)/Vm
(2)
RI=(Vs-Vd)/Vs
(3)
1.3 血压-血流分析
基于希尔伯特-黄变换的多模态血压血流分析是一种非线性动力学的分析方法,它主要是通过量化血压与脑血流速度二者之间的同步化程度来评估脑血流自动调节功能,就是通过计算血压-脑血流速度相位差(BP-BFV phase shift)来量化评价脑血流自动调节功能。平卧位的血压-脑血流速度相位差可被用于评价静态自动调节,而直立倾斜试验中测量的血压-脑血流速度相位差则被用于评价动态调节。
1.4 统计学分析
使用SPSS 19.0软件进行分析,采用独立样本t检验来评价组间生理参数之间差异的显著性。采用配对t检验评价病例组和对照组在直立倾斜试验中不同时间段中搏动指数、阻力指数及晕厥指数的差异性,P<0.05认为差异有统计学意义。
2 结果
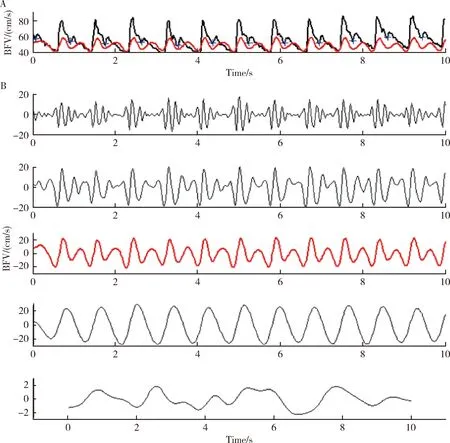
在有晕厥病史的20名患者的直立倾斜试验过程中出现了晕厥或晕厥前兆,其中有10名被试出现了短暂性意识丧失。血管迷走性晕厥组与正常对照组从平卧位到直立倾斜试验开始后2 min这段时间内的所有生理学参数相比差异均无差异学意义。与直立倾斜试验开始后的2 min相比,血管迷走性晕厥组的被试在从晕厥事件发生前3 min开始到晕厥发生前1 min的平均脑血流速度出现明显下降。从晕厥事件发生前3 min到晕厥发生前1 min的时间段内,血压-脑血流速度的相位差也出现了明显减小。
A, raw blood flow signal, (+) indicates the detected inflection point; B, intrinsic modes for each component frequencies. The intrinsic mode in red were selected to detect inflexion point, and the inflexion point in the selected mode corresponded to the inflexion point in the raw blood flow velocity signal.图2 利用集合经验模态分解的方法确定测得重搏切迹的拐点Figure 2 Detection of dicrotic notch inflexion point using ensemble empirical mode decomposition
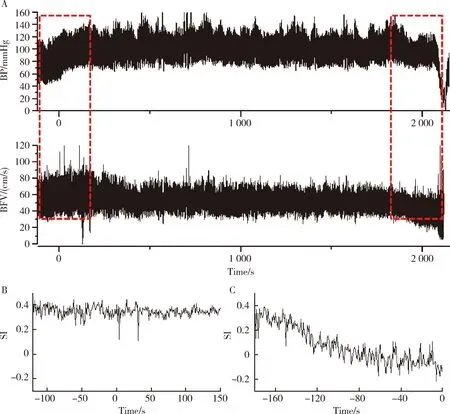
晕厥发生前,血管迷走性晕厥组被试的晕厥指数(SI)明显下降。图3显示了一位典型的血管迷走性晕厥患者在直立倾斜试验过程中不同的时间点血压、脑血流速度与晕厥指数等生理学参数的波动趋势。在血管迷走性晕厥组被试中,在晕厥发生前1 min内,晕厥指数与基线相比下降达 50.3%±30.9%。然而,在正常对照组,在倾斜试验前的平卧期的晕厥指数为0.31±0.07,在倾斜试验开始1 min后晕厥指数为0.30±0.07,在倾斜试验开始2 min后晕厥指数为0.28±0.07,在倾斜试验结束时晕厥指数为0.27±0.10,总而言之,晕厥指数在对照组被试的倾斜试验的整个过程中未见明显改变(P>0.05)。图4显示了晕厥指数在倾斜试验不同时期数值的比较。
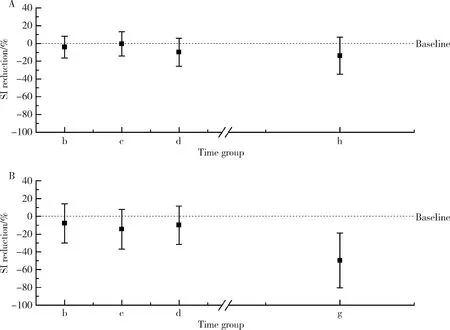
在对照组中,被试的PI、RI、BP-BFV相位差和SI在直立倾斜试验过程中的变化不明显。在血管迷走性晕厥组中,如图5所示,与直立倾斜开始后2 min相比,PI和RI数值在晕厥事件发生前1 min才出现明显增加(P<0.05), 而SI数值却在晕厥发生前3 min即出现明显下降(P<0.01)。
在晕厥事件发生前的3 min内,SI已经有了明显下降,而同期PI、RI变化却不明显(P>0.05)。有趣的是,本研究关注的新参数晕厥指数SI和BP-CBF相移差在晕厥事件发生前3 min都已出现先于临床症状的显著下降(P<0.01,表2和图5)。
A, BP and BFV fluctuation, dashed box are time interval from supine rest to second minute after tilt and from 3 minutes before syncope point to syncope point; B, SI during the process from supine rest to second minute after tilt; C, SI during the process from 3 minutes before syncope point to syncope point.图3 1名典型的血管迷走性晕厥患者的血压(BP)、脑血流速度(BFV)及晕厥指数(SI) 在直立倾斜试验不同时期的波动趋势Figure 3 A typical patient fluctuation of blood pressure (BP), blood flow velocity (BFV) and syncope index (SI) during different stage of tilt
A, syncope index reduction relative to baseline in control group; B, syncope index reduction relative to baseline in patients group. b, indicates duration of tilt; c, first minute after tilt; d, second minute after tilt; g, last minute before return to supine (vasovagal syncope group); h, Last minutes before the end of the tilt test (control group).图4 晕厥指数在直立倾斜试验过程不同时间段相对于基线的降低幅度Figure 4 Syncope index reduction relative to baseline in different time periods
表2 比较不同生理学参数在血管迷走性晕厥组倾斜试验中不同时间段的差别Table 2 Comparison of physiological parameters between different time periods

Patients Different time points in tilt testdefgBP-BFV phase shift degree59.6±20.620. 9±17.4#21.0±12.3# 12.9±9.9#Syncope index0.29±0.070.23±0.07∗0.19±0.09#0.16±0.10#Pulse index0.81±0.140.85±0.130.84±0.110.89±0.13∗Resistance index0.52±0.050.54±0.050.54±0.040.55±0.05∗
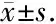
A, syncope index; B, phase shift; C, pulse index; D, resistance index.a, indicates last minute before tilt (baseline); b, duration of tilt; c, first minute after tilt; d, indicates second minute after tilt; e, third last minute before return to supine; f, second last minute before return to supine; g, last minute before return to supine; Significant level:*P<0.05,# P<0.01.图5 血管迷走性晕厥组被试的直立倾斜试验不同时间段的生理参数Figure 5 Syncope index, BP-BFV phase shift, pulse index, resistance index in different time period in VVS group
3 讨论
反射性晕厥一直以来被认为是一组异质性疾病,通常是在特定的诱发因素下诱发的一种心血管系统病态反射,会导致一过性系统循环失代偿,表现为外周血管扩张或心动过缓,从而引发血压迅速下降和全脑血流灌注减少[12]。由于短暂性升压反射失代偿,晕厥通常起病急骤,往往患者猝不及防,及早诊断及预测血管迷走性晕厥的发生对于减少由于晕厥引发的不必要的事故和外伤意义重大。头高位直立倾斜试验被用于诊断原因不明的晕厥始于上世纪80年代,有学者最早在1986年开始将直立倾斜试验用于临床[11],其原理是利用长时间站立作为诱因,在实验室里再现血管迷走性晕厥的发生过程,用于寻找晕厥发生时的血压、心率等血流动力学参数的改变。通过直立倾斜试验的方法,人们可以研究在此过程中脑小血管自动调节功能,并把它作为揭示晕厥发生主要机制的一把钥匙,从而寻找可以预测晕厥发生的生理参数,起到提前防范晕厥发生、减少意外伤害的目的。
在生理状态下,脑部小血管具有一种潜在能力,即当血压维持在特定范围内时,使脑血流量可以保持相对稳定,以维持脑灌注压不会因为血压的生理波动而产生大的波动。人们把脑小血管的这种功能称为脑血流自动调节[3]。通过实时监测和同步分析某一时刻的血压和与之相应的脑血流速度,可以用于量化评价脑血流自动调节功能[6-8]。脑血流自动调节功能分为静态调节与动态调节两类,前者通常指生理状态下血压变化时的脑血流维持相对稳定状态的能力,后者通常指超过生理状态的血压大幅度改变时,脑血流维持相对稳定的能力。目前,对于脑血流自动调节功能中的动态调节评价,尚缺乏公认的金标准。传统的评价动态调节的方法包括传递函数法和Tiecks模型, 被广泛应用于研究血压与脑血流速度之间的关系[13-16]。在上述这些方法中,假定的前提是测量所得的生理信号是稳定的并且是具有线性关系的,但是,在真实世界中,血压与脑血流速度的信号既不稳定又并非线性信号。为了克服传统线性模型带来的局限,有学者提出了利用希尔伯特-黄变换的方法建模,采用多模态血压脑血流分析的方法评价脑血流自动调节功能,基于希尔伯特-黄变换的方法,通过集合经验模态分解,可以提前分析连续采集的血压及脑血流速度的信号以量化分析二者之间的相位差[8,17]。
通过MMPF方法得到的结果提示,血管迷走性晕厥患者在出现低血压之前,血压与脑血流速度之间的相位差与健康对照相比没有明显差别,因此可以认为,对于血管迷走性晕厥患者而言,在晕厥发作间期,脑血流自动调节功能是正常的。对于血管迷走性晕厥患者,在晕厥发生前3 min,血压与脑血流速度之间的相位差出现明显下降,这说明脑血流自动调节功能出现失代偿。当血压突然下降至脑血流自动调节阈值以下时,会造成脑小血管的一过性自动调节功能障碍,这时脑小血管张力的下降导致了小血管管壁不能有效扩张维持稳定的血流灌注,管壁发生不规则收缩乃至出现管壁塌陷,脑血流中断,最终导致一过性意识丧失。因此,在血管迷走性晕厥发生时,脑血流自动调节功能障碍的原因是因为血压的迅速下降低于了脑小血管自动调节的压力阈值。
在既往研究中,Bondar等[18]曾经描述过在血管迷走性晕厥发生时可以出现舒张期脑血流重搏切迹加深的现象,并且利用TCD技术监测血压下降时重搏切迹的改变,同时也证明了交感神经系统是脑血流自动调节中的一个重要因素。当循环容量锐减时会激活交感神经系统,引起脑血管收缩,随后引起代谢性血管舒张,全脑灌注下降导致晕厥。Schondorf 等[19]证实了在血管迷走性晕厥患者中脑血流改变以舒张期脑血流速度下降最为明显,而选择性舒张期血流的降低主要是由于远端小血管张力的丧失造成。与既往研究相比,本研究提出的晕厥指数的概念旨在将前人描述的“重搏切迹”加深的现象加以量化。SI在晕厥发生前3 min即已出现明显下降,而此时传统意义的评价脑血管阻力的生理参数PI和RI与此前相比尚未出现明显改变,这说明晕厥指数在预测晕厥前兆和晕厥发生上与PI和RI相比可能更加敏感。
在既往研究中[3,20-21],关于脑血流自动调节的机制主要有肌源性学说、代谢学说、神经源性学说和内皮学说4种。肌源性学说的主要理论是指血管壁平滑肌细胞在血压升高产生可产生收缩反应用以保持脑血流的相对稳定[3]。本研究 SI的改变早于血压下降,很难用经典的肌源性学说解释,部分患者在血管迷走性晕厥发生前心率显著增快,心率过度增快会使得心动周期中舒张期所占的比例明显减少,造成心脏的每搏输出量锐减,这些会引起舒张早期的脑血流速度下降,造成重搏切迹加深。既往研究表明[22],脑实质内的小穿通动脉是受皮层下神经元支配的,而皮层下的神经纤维可以投射到更远端的被星形胶质细胞包绕的皮层小血管。因此,本课题组认为,在晕厥先兆期,交感神经的激活可以引起其支配的脑小血管短暂收缩后反射性舒张,用以维持脑灌注,在此过程中,某些代谢性化学产物及神经递质如CO2及儿茶酚胺等也会参与其中,本课题组今后将继续研究它们的作用。
为了计算晕厥指数,在舒张期脑血流信号中准确找到重搏切迹所在的拐点至关重要。通常情况下,由于脑血流速度的信号属于非线性及非稳态信号,同时也会受到TCD探头所带噪声的干扰,使用常规方法准确测量重搏切迹所在拐点非常困难。集合经验模态分解方法可用于分析非线性及非稳态信号系统,其分解算法是将脑血流速度信号分解为多个经验模态,亦称本征模态函数,每种模态代表一个与特定生理过程相关的窄带信号,通过这种信号转换可以更精确地确定重搏切迹所在拐点的位置。
通过改进TCD实时监测,相信在今后可以使用SI作为预测晕厥发生的一个相对敏感的生理指标,基于此可以为频繁发作的血管迷走性晕厥患者设计一种新的可穿戴式医用设备。当患者穿戴该设备时,可以在晕厥发生前3 min提前监测到脑血流频谱的SI早期改变,发出预警提醒患者,及早停止站立或走动,让患者有足够的时间迅速采取安全的体位避免出现进一步的跌倒伤害,将外伤和不必要的事故的发生可能性降到最小。
本研究尚存在局限:首先是样本量较小;其次,未采用CO2监测装置,在晕厥发生前,有些患者会出现过度换气,CO2浓度会影响脑血流的自动调节功能,在进一步的研究中本课题组会将CO2监测加入其中;第三,某些重要神经递质,特别是血清去甲肾上腺素水平,可以反映交感神经功能,也可能与晕厥发生前的外周血管收缩有关,需要在进一步的研究中加以重视。
综上所述,血管迷走性晕厥发生时脑血流的动态调节功能出现失代偿,脑小血管的张力丧失与脑血流自动调节功能障碍密切相关。通过非线性动力学方法测量计算的新的血流动力学参数晕厥指数可以作为在晕厥事件发生前3 min提前预警晕厥事件的一个敏感指标。

