为化学元素制定表格
2019年被联合国定为“国际化学元素周期表年”。150年前,俄国化学家门捷列夫发现了化学元素周期律并制作了第一张较为全面的元素周期表。这一科学史上著名的发现之一刻画的不仅是化学的本质,也是物理学和生物学的本质。
然而,正如中国科学院大学人文学院历史系教授袁江洋所说:“必须承认门捷列夫在元素系统性质与分类研究上是一位集大成者,但更应该看到,门捷列夫所做的工作也是在前人研究基础之上进行的,其他人对元素周期律的贡献也不应被忽视。”

早在门捷列夫之前,元素具有周期性規律的思想已频繁出现在化学家们的论述中。在1789年出版的《化学大纲》中,法国化学家拉瓦锡发表了一张元素表,在这张表中,当时已知的33种元素被分为4类。此后,多位化学家对元素的性质和分类开展了研究。
1865年,英国化学家约翰·纽兰兹在研究中发现,当元素按原子量递增的顺序排列时,每隔8个元素,元素的物理性质和化学性质就会重复出现,他称这一规律为“八音律”。
与其他人不同,门捷列夫意识到某些特定元素可能是缺失的,还有待人们进一步发现,因此他在已知元素表的基础上创造性地为未知的元素留出了空间。更令人佩服的是,他还准确地预测了缺失元素的性质。
比如,他在表中的铝(Al)旁边为一种未知金属留了一个空间,并预言该金属的原子质量为68,密度为6g/cm3,熔点很低。6年后,该预测在法国化学家保罗·埃米尔·勒科克·德布瓦博德兰分离出的镓(Ga)元素中得到验证。镓的原子质量为69.7,密度为5.9g/cm3,熔点很低,一旦碰到人的手就会熔化成液体。对于钪(Sc)、锗(Ge)和锝(Tc),门捷列夫也做了同样的留白与预测。但直到1937年,人们才发现元素锝。
如果把门捷列夫制作的表格顺时针旋转90度就会发现,它与现代版的元素周期表有很多相似之处。例如,卤族元素氟(F)、氯(Cl)、溴(Br)和碘(I,门捷列夫制作的表格中的符号J)相继出现。如今,它们被排列在元素周期表的第17列中,化学家们更喜欢称其为第17族。
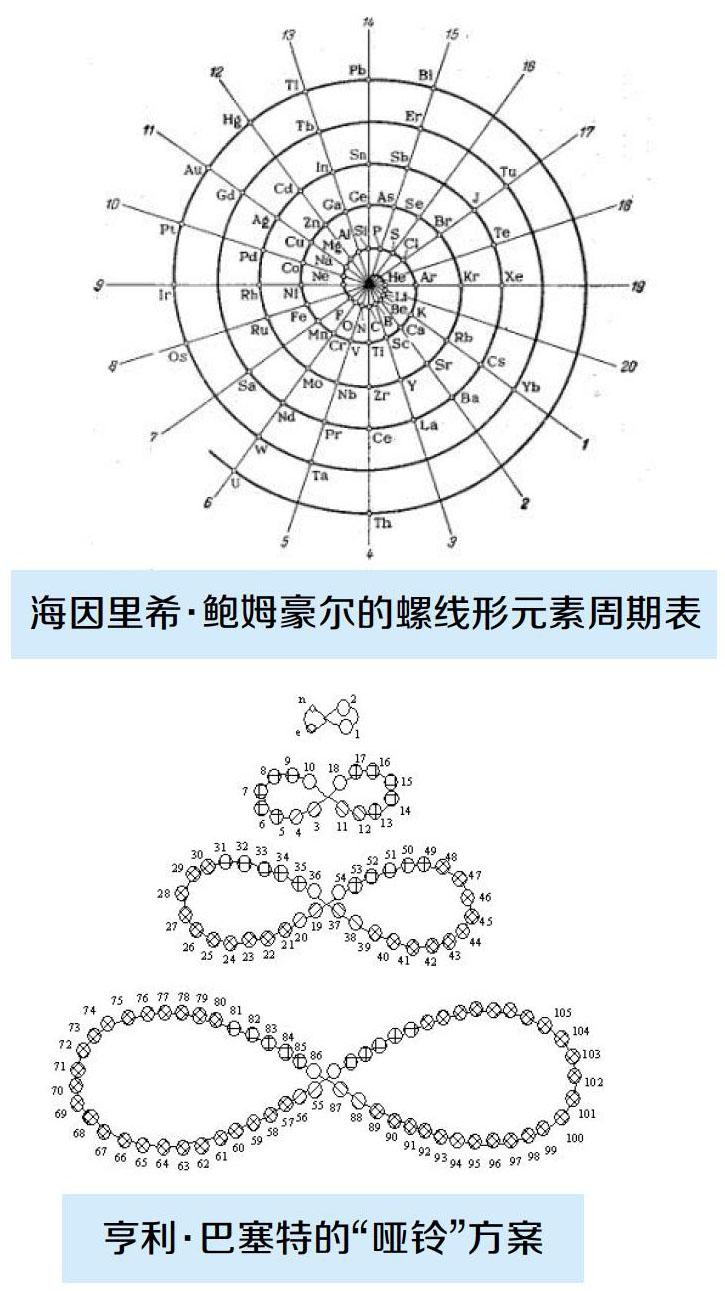
门捷列夫的论文发表后,人们对化学元素的其他排列方式也进行了大量实验。如海因里希·鲍姆豪尔在1870年发表的螺旋结构以氢元素为中心,元素随着原子质量增加呈螺旋式上升。每个从中心到外围的直线辐射上的元素具有相同的属性,和现代版的元素周期表中同一族的元素一样。另外,亨利·巴塞特在1892年也提出了创意十足的“哑铃”方案。
特别有影响力的是法国工程师查尔斯·詹内特设计的版本。他采用新发现的量子理论,建立了一个基于电子构型的布局,由此产生的“阶梯”表格受到许多物理学家的青睐。尽管当时已知的元素只有92种,但詹内特为直到120号的元素都提供了位置。
现代版的元素周期表实际上是在詹内特版本的基础上演变而来。比如碱金属(以锂为首的第一主族元素)和碱土金属(以铍为首的第二主族元素)被从最右边移到最左边,形成一个非常宽的元素周期表。这种布局也存在问题:它不能很好地书面呈现。后来为了方便,镧系和锕系元素通常被剪切下来,放到主表的下面,元素周期表就演变成我们今天所熟悉的样子。(据搜狐科技)