二氧化硫预处理对大鼠心肌缺血再灌注心律失常的作用
王新宝,崔 红
(首都医科大学附属北京友谊医院儿科,北京 100050)
目前随着导管技术、动脉旁路移植术、断指再植和器官移植等新技术的开展,缺血组织在重新恢复血液循环再灌注后常有再灌注心律失常的发生,影响病情的发展及预后。其发病机制与再灌注后自由基生成增多有关,缺血再灌注后,黄嘌呤氧化酶形成增多、中性粒细胞呼吸爆发及儿茶酚胺自氧化增强等均可引起氧自由基生成增加,可以与细胞中的多种成分发生反应,如膜磷脂、蛋白质和核酸等,造成了细胞自身的结构破坏和功能紊乱,导致细胞损伤,与此同时非自由基的过氧化氢和单线态氧可激发放出一个光子,引起细胞损伤。钙超载、中性粒细胞的聚集活化、无复流现象和能量代谢障碍均促使缺血再灌注损伤的发生[1-2]。
近年来,研究表明气体信号分子如一氧化氮、一氧化碳、硫化氢等在机体中发挥重要的生物学作用,另外一种气体小分子二氧化硫(sulfur dioxide,SO2)是公认的全球性大气污染物,但在机体中SO2也可以内源性产生,是L-半胱氨酸在不同酶作用下的代谢产物,SO2在体内与水结合,以其衍生物——亚硫酸盐和亚硫酸氢盐(SO32-/HSO3-)的形式存在[3-4]。SO2预处理对大鼠心肌缺血再灌注心律失常的作用尚不清楚,本研究通过给予SO2预处理,观察SO2对大鼠心肌缺血再灌注后心律失常的作用及可能机制。
1 材料与方法
1.1材料 清洁级雄性Wistar大鼠60只(动物合格证号:SCXK京2016-0011),由北京友谊医院实验动物中心提供,体重200~250 g,Na2SO3、NaHSO3均购自美国Sigma公司,使用前以0.9% NaCl注射液为溶剂,3∶1摩尔比新鲜配制成混合液,为SO2供体;其他试剂均为分析纯,超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛、还原型谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒购自南京建成生物科技有限公司。
1.2缺血再灌注心律失常模型制作方法及分组 使用20%乌拉坦(1 g/kg)腹腔注射,麻醉后背位固定,气管插管,小动物呼吸机(Kent Scientific,USA)辅助呼吸,潮气量2 mL/100 g,呼吸频率60次/min,吸气时间/呼气时间比为1.5∶1,在大鼠胸骨左缘第4肋间剪开肋间肌,暴露心脏,在左心耳下缘约2 mm处,结扎左侧冠状动脉(left coronary artery,LCA),结扎时采用一塑料胶管垫于结扎线下,缺血30 min后松开结扎线,再灌注60 min[5]。
采用随机数字法将大鼠分为4组:假手术组(Con组,n=15),在冠状动脉只穿线但不结扎血管;缺血再灌注组(I/R组,n=15),结扎LCA 30 min后再松开结扎线(结扎线下垫橡皮垫),使再灌注60 min;5 μmol/kg SO2组(I/R+S5组,n=15),50 μmol/kg SO2组(I/R+S50组,n=15)分别用5 μmol/kg、50 μmol/kg SO2(Na2SO3/NaHSO3,用前以0.9% NaCl注射液为溶剂,3∶1摩尔比新鲜配制成混合液)在缺血前10 min从颈外静脉注射(0.9% NaCl注射液溶解为1 mL),然后结扎LCA 30 min,再灌注60 min。动物模型成功的标准:实验过程中记录 Ⅱ 导联心电图,结扎LCA时,心电图ST段明显抬高,结扎线下心肌组织颜色变白、缺血,松开结扎线后,心电图ST段较结扎时降低,心肌组织颜色好转。
1.3心电监测 大鼠背位固定后,连接四肢电极,采用BL-420生物机能实验系统连续心电监测,以肢体Ⅱ导联作为标准,分析各心电参数,记录结扎前、缺血和再灌注时Ⅰ、Ⅱ、Ⅲ导联心电图,观察P波、QRS波ST段和T波变化,以及心律失常的发生情况,同时采用BL-420生物机能实验系统动态观察大鼠心律以及平均动脉压。
1.4氧化应激指标的检测 在实验结束时留取外周静脉血,肝素抗凝,以离心半径10 cm,3 000 r/min离心10 min后,留取上层血浆置于-80 ℃冰箱保存,进行血浆中氧化应激指标的检测,采用试剂盒(均购自南京建成生物工程研究所)测定血浆中SOD、丙二醛、GSH、GSH-Px水平。
SOD的测定通过黄嘌呤及其氧化酶反应系统产生超氧阴离子,其可还原氮蓝四唑生成蓝色甲臜,测定560 nm处的吸光值,制定标准曲线计算SOD的活性。丙二醛的测定根据试剂盒说明采用硫代巴比妥酸反应法,采用比色法同时测定532 nm和600 nm吸光值,利用两者吸光度的差值计算丙二醛的含量。GSH的测定通过与2-硝基苯甲酸反应产生2-硝基-5巯基苯甲酸,在412 nm处测定吸光度,利用分光光度计计算GSH的含量。GSH-Px的测定以过氧化氢为底物,通过比色法测定422 nm处吸光度值测定。
2 结 果
2.1大鼠一般情况和缺血再灌注过程中的心电图表现 实验中各组大鼠体重比较差异无统计学意义(P>0.05)。Con组和I/R+S5组无大鼠死亡,I/R组大鼠造模过程中死亡3只,I/R+S50组死亡2只,其余均造模成功。大鼠正常的心电图表现见图1a,结扎LCA后,可见Ⅱ导联心电图ST段明显抬高(图1b),再灌注后发生明显室性心律失常(图1c),再灌注室性心律失常转复后,抬高的ST段降低(图1d)。
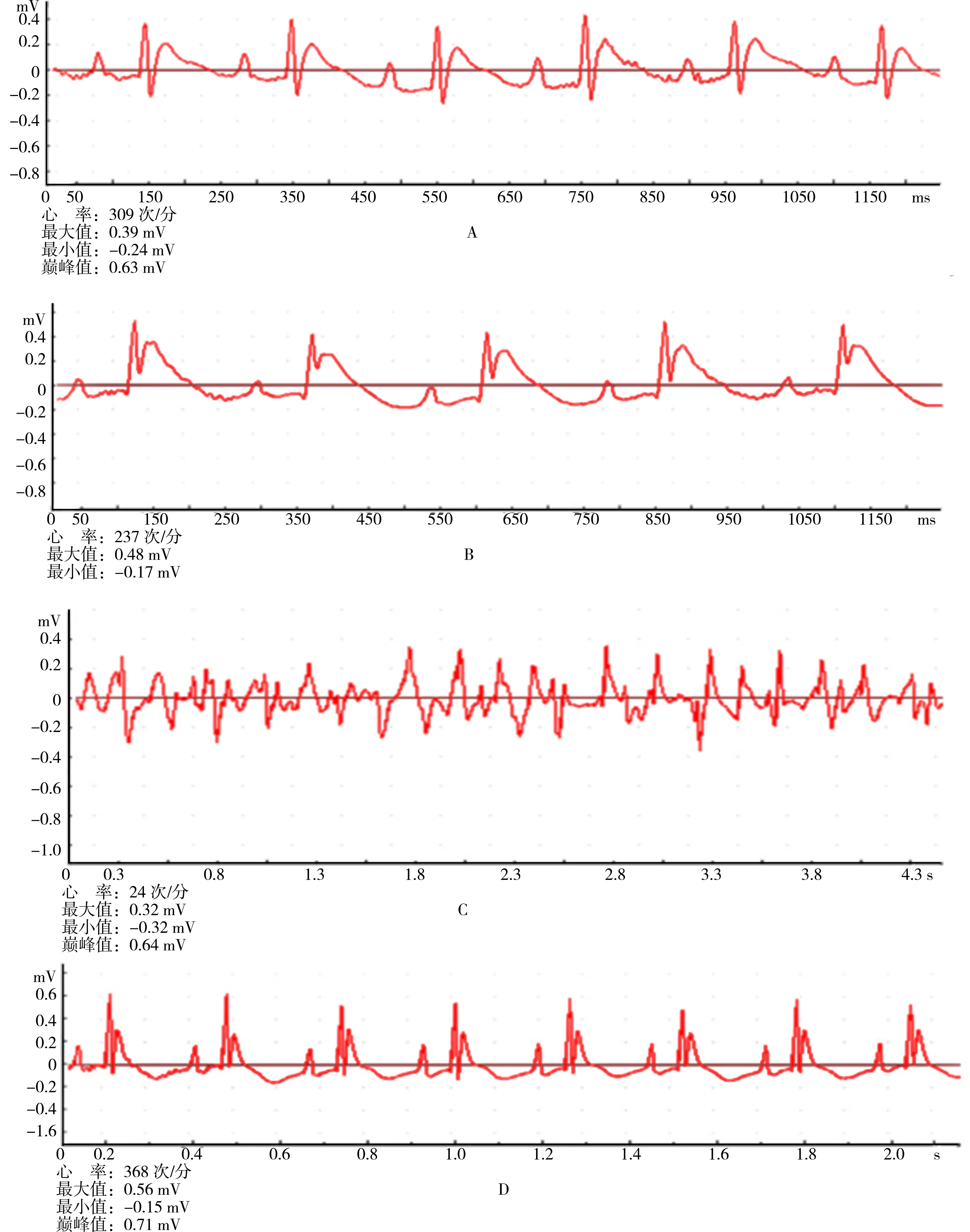
A:大鼠正常心电图;B:心肌缺血后心电图ST段明显抬高;C:再灌注后发生心室纤颤的心电图表现;D:心室纤颤转复后的心电图表现,ST段恢复正常
图1 大鼠缺血再灌注心律失常的心电图表现
2.2SO2对大鼠缺血再灌注心律失常的作用 Con组实验过程中没有心律失常的发生,与I/R组相比,I/R+S5组再灌注过程中室性心律失常的出现时间显著推迟,持续时间明显缩短(P<0.01),室性心律失常发生率明显降低(P<0.01),而I/R+S50组与I/R组比较差异无统计学意义(P>0.05)。见表1。

表1 SO2对大鼠缺血再灌注心律失常的作用
I/R组:缺血再灌注组;I/R+S5组:I/R+SO2(5 μmol/kg)组;I/R+S50组:I/R+SO2(50 μmol/kg)组;a与I/R组比较,P<0.01
2.3SO2对大鼠氧化应激的作用 与Con组相比,I/R组血浆抗氧化指标SOD、GSH和GSH-Px水平均降低(P<0.01),氧化产物丙二醛水平增高(P<0.01)。而I/R+S5组与I/R组相比,血浆中SOD、GSH和GSH-Px均明显增高(P<0.01或P<0.05),氧化产物丙二醛水平明显降低(P<0.05);I/R+S50组与I/R组各指标比较差异无统计学意义(P>0.05)。见表2。


SOD(U/mL)(nmol/mL)GSH(mg/L)GSH-Px(U/mL)Con15138.4±8.56.5±0.710.2±2.3823.3±31.1I/R1288.5±10.8a11.4±1.3a4.3±0.7a442.3±36.2aI/R+S515149.6±16.9b7.2±1.3c9.6±1.0b786.6±50.0bI/R+S501388.5±8.112.1±1.411.3±1.4513.2±41.2F101.61214.485 8.01320.414P<0.001<0.001<0.001<0.001
SOD:超氧化物歧化酶;GSH:还原型谷胱甘肽;GSH-Px:谷胱甘肽过氧化物酶;Con组:假手术组;I/R组:缺血再灌注组;I/R+S5组:I/R+SO2(5 μmol/kg)组;I/R+S50组:I/R+SO2(50 μmol/kg)组;a与Con组比较P<0.01;b与I/R组比较,P<0.01,c与I/R组比较,P<0.05
3 讨 论
近年来,研究发现另外一种小分子气体SO2也可以内源性产生,并且具有舒张血管、降低血压、调节心脏功能的重要作用,可以减轻肺动脉高压,通过抑制肺动脉血管内壁平滑肌细胞增殖、减轻血管内皮细胞的炎症反应、调节细胞外基质的降解改善血管重构[3,6-10];同时SO2可抑制脂多糖诱导的肺损伤,以及减轻异丙肾上腺素诱导的心肌损伤[11];SO2同时具有改善大鼠动脉粥样硬化的作用,减少动脉粥样硬化斑块的形成[12]。在大鼠心肌缺血再灌注损伤模型中发现,SO2预处理具有减少心肌梗死面积的作用,其机制可能与减轻氧化应激损伤和过度的内质网应激有关[5],上述结果表明SO2在机体中具有重要的生物学作用。
缺血再灌注损伤在临床中较为常见,再灌注后的心律失常是常见的并发症之一,发生率高达80%,包括室性心动过速和心室纤颤等严重的心律失常,是导致死亡的主要原因。其发病机制目前认为与氧自由基的大量释放、心肌细胞内钙超载、心肌电偶联、ATP敏感性钾通道的激活等有关,通过缺血预处理和后处理、抗氧自由基、钙通道阻滞剂和β2肾上腺素受体阻滞剂可部分减少心律失常的发生,但仍缺乏有效的治疗方法[13-14]。
本研究结果显示,缺血再灌注后心律失常的发生率高达83.3%,给予5 μmol/kg SO2预处理后室性心律失常的发生率明显降低,同时室性心律失常的发生延迟,持续时间降低,而50 μmol/kg SO2预处理后无上述作用,上述结果表明小剂量SO2具有改善再灌注心律失常的作用。Wang等[5]前期研究表明5 μmol/kg SO2预处理具有减轻心肌缺血再灌注损伤的作用,可以减少心肌梗死面积,离体实验研究中表明SO2具有改善心脏功能的作用,其作用机制可能与内质网应激途径有关,缺血前SO2可诱导适度的内质网应激,减轻缺血后的再灌注损伤。但外源性的SO2暴露可使心率增快,特别是副交感神经的心脏保护活动[15]。
自由基生成增多是缺血再灌注损伤的重要机制之一,氧自由基作用于膜上的不饱和脂肪酸,而且可进一步产生脂质自由基、脂质过氧化物,破坏细胞的结构和功能,造成细胞损伤[16-17]。本研究对再灌注后血浆中的氧化指标进行检测发现,缺血再灌注大鼠血浆中抗氧化指标SOD、GSH和GSH-Px水平明显降低,氧化产物丙二醛水平明显增高,给予5 μmol/kg SO2预处理后,血浆中SOD、GSH和GSH-Px水平明显增高,氧化产物丙二醛水平明显降低,而50 μmol/kg SO2预处理不具有上述作用。SO2改善心律失常的作用可能与减少氧自由基形成、抗氧化作用有关。但有研究表明吸入SO2(56和112 mg/m3)可使心肌组织中SOD活性降低,GSH-Px水平在雄性小鼠中降低,上述研究表明吸入SO2具有氧化损伤的作用,但该研究基于高浓度的SO2水平[18]。在油酸诱导的急性肺损伤模型中,SO2可降低肺组织中氧自由基的生成,减少OH-和过氧化氢的生成,降低丙二醛的水平,增加GSH的水平,同时使SOD活性增高,上调肺组织中SOD1和SOD2的蛋白表达[19],上述研究表明SO2在油酸诱导的急性肺损伤中具有抗氧化损伤的作用。在大鼠心肌缺血再灌注损伤模型中,SO2预处理可减轻缺血再灌注心肌梗死面积,上调心肌组织中SOD1和SOD2的蛋白表达,使组织中抗氧化酶的活性增高,同时可使心肌组织中H2S水平和胱硫醚-γ裂解酶活性增高,但降低一氧化氮水平和诱导性一氧化氮合酶活性[20],表明SO2减轻大鼠心肌缺血再灌注损伤可能与其抗氧化作用有关,同时上调H2S/胱硫醚-γ裂解酶途径和抑制一氧化氮/诱导型一氧化氮合酶途径。钙超载也是再灌注心律失常的发病机制之一,心肌细胞内钙离子浓度增加可诱导心肌细胞早期后除极,心肌细胞自律性改变,引起心律失常的发生,Zhang等[21]利用膜片钳技术研究表明,SO2(50、100、500、1 000 μmol/L)可以通过抑制L型钙通道减少细胞内钙离子内流,该机制可能与SO2抑制再灌注后心律失常有关。
总之,SO2预处理可减轻大鼠心肌缺血再灌注后引起的心律失常,其机制可能与减少氧自由基的形成有关,SO2对心律失常的作用值得进一步深入研究。

