大鼠尿液与血液中海洛因4种代谢物的检测时限研究
王璐莹,倪春芳,姜凤丽,徐智儒,汪 蓉,张玉荣
(1.中国医药工业研究总院 上海医药工业研究院 创新药物与制药工艺国家重点实验室,上海 201203;
2.上海市公安局物证鉴定中心 上海市现场物证重点实验室,上海200083;3.上海市徐汇区中心医院,上海200031)
海洛因(Heroin),是一种以吗啡生物碱为合成起点的半合成毒品。从20世纪开始,海洛因滥用就已经成为危害人类健康,影响社会稳定的一个重要问题[1]。海洛因主要作用于中枢神经系统,产生先兴奋后抑制的作用,具有很强的成瘾性,吸食者一旦停止吸食,会出现强烈的戒断症状,严重危害人体健康。
海洛因的代谢极为迅速(图1),半衰期只有2~5min[2],在体内迅速去乙酰化成O6-单乙酰吗啡(6-MAM),进而水解转变为吗啡(MOR),代谢产物吗啡与β-D-葡萄糖醛酸发生结合反应,分别生成3-β-D-葡萄糖醛酸吗啡(M3G)、6-β-D-葡萄糖醛酸吗啡(M6G)[3]。
目前国内外已有一些研究海洛因代谢物检测时限的报道[4-7],但尚未同时系统地比较尿液、血液中4种海洛因代谢物的检测时限。本研究通过测定海洛因给药后大鼠尿液与血液中近两周内不同时间点的代谢物的含量,并且同时比较4种代谢物的检测时限,筛选出尿液与血液中检测时限最长的代谢物,为海洛因吸食者体内代谢物检测时限的研究提供参考。
1 材料与方法
1.1 仪器与试剂
Spark 1240液相系统(荷兰Spark公司);API 4000 QTRAP质谱仪(美国AB SCIEX公司)。
6-MAM和MOR(中国药品生物制品检定所),M3G、M6G,吗啡-d3(MOR-d3)、3-β-D-葡萄糖醛酸吗啡-d3(M3G-d3)和 6-β-D-葡萄糖醛酸吗啡-d3(M6G-d3)(美国 Cerilliant公司)。 超纯水由 ELGA纯水仪制备,甲醇、乙腈和异丙醇(德国Merck公司)。其他试剂均为分析纯。
1.2 溶液配制
混合工作液:取6-MAM、MOR、M3G和M6G标准储备液,浓度分别为500、1 000、100、100 μg/mL,用超纯水稀释为混合浓度分别为10、5、20、20μg/mL的混合工作液和混合浓度分别为40、20、20、20μg/mL的混合工作液。
混合内标工作液:取MOR-d3、M3G-d3和M6G-d3标准储备液,浓度都为100μg/mL,用超纯水稀释为混合浓度分别为2、4、4μg/mL的混合内标工作液。
上述溶液保存于4℃冰箱备用。
1.3 色谱与质谱条件
色谱条件:色谱柱为WatersXBridgeⓇC18(3.0mm×150 mm,3.5 μm);保护柱为Waters XBridgeⓇC18(3.0 mm×20 mm,3.5 μm);柱温为 40℃;进样量为100μL,流速为0.4mL/min;流动相为1%氨水(A相)和乙腈(B相),梯度洗脱程序见表1:

表1 梯度洗脱程序

图1 海洛因的代谢过程
质谱条件:电离模式为ESI+,扫描方式为MRM,离子喷雾电压为5500V,离子喷雾温度为600℃,气帘气(CurtainGas)为 30psi,碰撞气(CAD)为 Medium,雾化气(GS1)为 50psi,辅助气(GS2)为 60psi。各分析物的MRM优化参数及内标应用见表2。

表2 各分析物的MRM优化参数
1.4 实验动物、给药方法及样本制备与采集
1.4.1 实验动物
种属品系:SD大鼠(上海杰思捷实验动物有限公司),生产许可证号:SCXK(沪)2013-0006;性别:雄性;体重:200~220 g;动物合格证号:NO.201000 2608556;饲养条件:SPF清洁级小动物屏障系统,室温23±1℃,湿度50%~70%,人工照明模拟昼夜变化,自由进食与饮水。动物使用许可证号:SYXK(沪)2014-0018。
1.4.2 药液配制及给药方法
药液配制:称量海洛因样品适量,加生理盐水溶解并稀释至1mg/mL浓度的溶液。
给药方法:SD大鼠,雄性16只,随机分为两组,每组8只,10mg/kg尾静脉注射给药。一组用于收集尿液,另一组取血液。
1.4.3 样本采集
尿液样本:给药后分别收集0~8 h、8~11 h、11~24h、24~48h、48~72h、72~96h、96~120h、120~144h、144~168 h、168~180 h、180~192 h、192~216 h、216~264 h、264~312 h、312~336 h 的大鼠尿液样品,编号,并于-40℃冰箱冷冻保存。
血液样本:给药后于 0.5、1、2、8、24、48、72、96、120、144、168、192、216、240、264、288、312 h,眼眶静脉丛取全血约200 μL,编号,并于-40℃冰箱冷冻保存。
1.5 样品前处理
1.5.1 预处理方法
尿液:取100 μL尿液样品,置于离心管中,加入10 μL混合内标工作液和100 μL磷酸盐缓冲溶液(pH=4),涡旋混匀,18 407×g 离心 10 min,取上清液100μL进样。
血液:取100 μL血液样品,置于离心管中,加入10 μL混合内标工作液和200 μL磷酸盐缓冲溶液(pH=4),涡旋混匀,18 407×g 离心 10 min,取上清液100μL进样。
1.5.2 在线固相萃取方法
采用全自动的Spark online SPE-LC系统(荷兰Spark公司),在线固相萃取小柱是OASISⓇOn-Line SPE,MCX (10mm,96/pkg)柱。以 1mL/min 的流速依次用5%氨水甲醇1mL、甲醇1mL和超纯水1mL活化固相萃取柱;以1mL/min的流速用磷酸盐缓冲液(pH=4)1mL平衡固相萃取柱;以0.8mL/min的流速用磷酸盐缓冲液(pH=4)0.5 mL辅助上样;再以1 mL/min的流速用0.1mol/L盐酸溶液0.5mL、超纯水0.5 mL和0.15 mol/L碳酸铵溶液0.5 mL淋洗杂质;最后用流动相(1%氨水和乙腈)洗脱供LC-MS/MS分析。
2 结果与讨论
2.1 方法学验证
2.1.1 检测限、定量限和线性范围
取适量混合工作液逐级稀释并加入空白基质(尿液和血液)中,分别配制标准曲线尿液样品(MOR浓度为 2.5~500 ng/mL,6-MAM 浓度为 5~1 000 ng/mL,M3G和M6G浓度都为10~2000ng/mL)和标准曲线血液样品(MOR 浓度为 2.5~1 000 ng/mL,6-MAM浓度为10~2000ng/mL,M3G和M6G浓度都为2.5~1 000 ng/mL),进行预处理,再进样分析,以分析物的浓度为横坐标,分析物面积与对应内标物面积的比值为纵坐标,绘制标准曲线。结果显示,尿液和血液中4种代谢物标准曲线的相关系数r均大于0.99,线性关系良好。以信噪比(S/N)大于等于3确定检测限(LOD),大于等于10确定定量限(LOQ)。尿液和血液中4种代谢物的检测限、定量限、线性范围及相关系数见表3。
2.1.2 精密度、准确度和方法回收率
将低、中、高浓度的质控样品(尿液、血液的质控样品浓度分别见表4和表5)以及标准曲线样品进行预处理,再进样分析,根据标准曲线分别计算质控样品的测定浓度。每个浓度5份样品,并连续测定3 d,分别考察日内精密度和准确度及日间精密度和准确度。精密度用RSD(%)来表示,准确度=测定浓度/理论浓度×100%。尿液中各分析物日内精密度、准确度和日间精密度、准确度见表4。尿液中4种代谢物的日内精密度介于0.4%~6.7%之间,日内准确度介于92.9%~101.7%之间,日间精密度介于1.8%~7.3%之间,日间准确度介于94.4%~101.5%之间。血液中各分析物日内精密度、准确度和日间精密度、准确度见表5。血液中4种代谢物的日内精密度介于1.0%~8.6%之间,日内准确度介于90.8%~103.7%之间,日间精密度介于2.4%~7.5%之间,日间准确度介于94.3%~104.4%之间。
参照已报道文献[8],将低、中、高的质控样品3份进行预处理,再进样分析;取相应浓度的质控溶液,添加相同体积的超纯水代替空白基质,其余步骤不变,从而进行方法回收率的验证。方法回收率用各分析物在质控样品中的峰面积与其在超纯水中的峰面积的比值来表示,综合反映分析方法的基质效应和提取回收率。尿液结果见表4,4种代谢物的方法回收率介于33.9%~90.3%之间。血液结果见表5,4种代谢物的方法回收率介于19.3%~89.5%之间。

表3 尿液和血液中4种代谢物的检测限、定量限和线性范围

表4 尿液中4种代谢物在不同浓度下日内和日间的精密度、准确度及方法回收率

表5 血液中4种代谢物在不同浓度下日内和日间的精密度、准确度及方法回收率
2.2 大鼠尿液中海洛因代谢物检测时限
海洛因在体内的代谢极为迅速,吸食海洛因后很难检测到原体,本文主要测定海洛因的4种代谢物(6-MAM、MOR、M3G和M6G)。 采用上述在线固相萃取结合LC-MS/MS分析方法,测定给药后不同时间段的大鼠尿液中4种代谢物的含量。图2是1~8号大鼠尿液中4种代谢物的含量随时间变化的曲线图,表6是1~8号大鼠尿液中4种代谢物的最长检测时限。
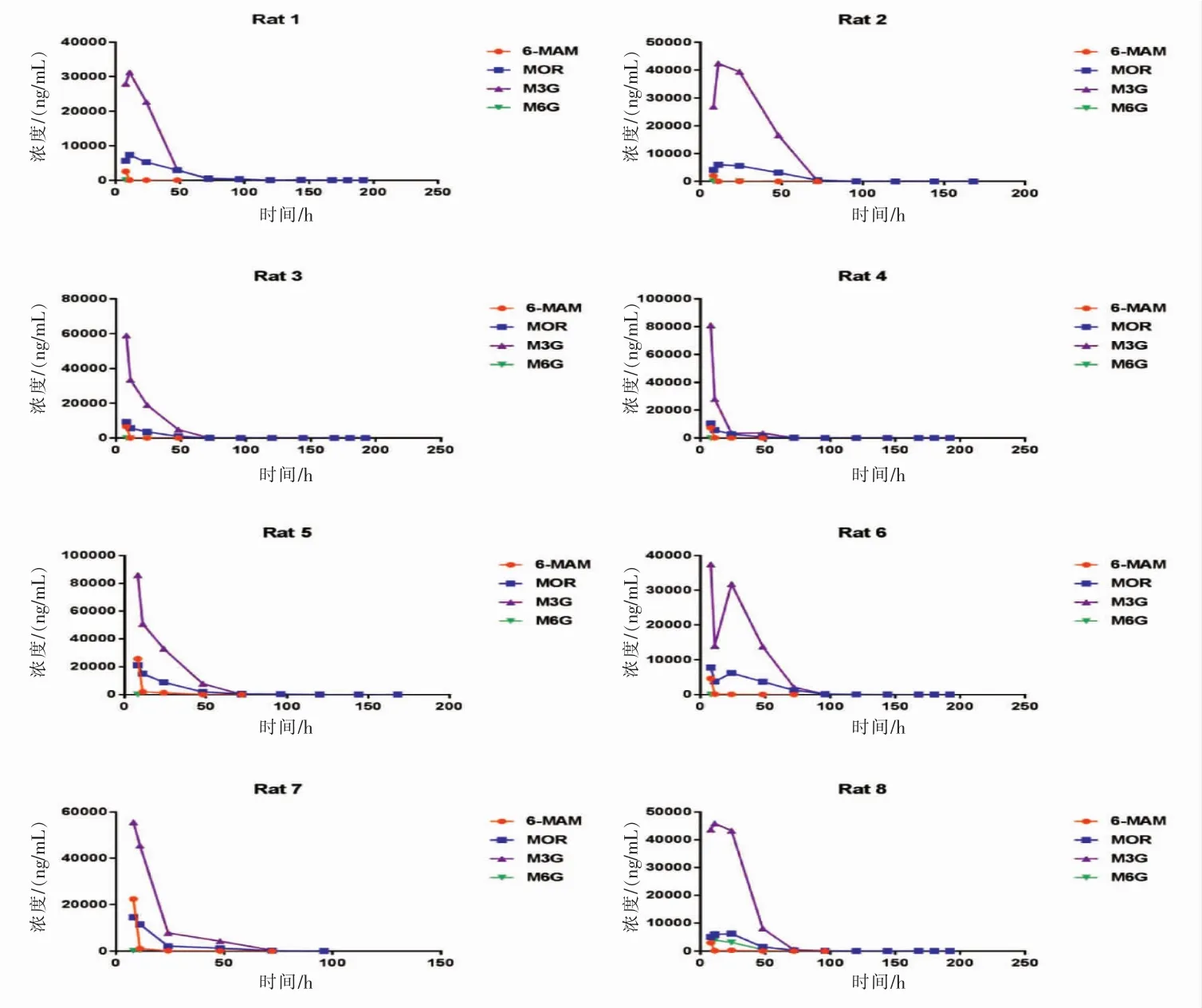
图2 大鼠尿液中4种海洛因代谢物浓度-时间曲线图

表6 大鼠尿液中4种海洛因代谢物的最长检测时限及对应浓度
2.3 大鼠血液中海洛因代谢物检测时限
采用上述在线固相萃取结合LC-MS/MS分析方法,测定给药后不同时间点的大鼠血液中4种代谢物的含量。图3是A号-H号大鼠血液中4种代谢物的含量随时间变化的曲线图,表7是A号~H号大鼠血液中4种代谢物的最长检测时限。

图3 大鼠血液中4种海洛因代谢物浓度-时间曲线图

表7 大鼠血液中4种海洛因代谢物的最长检测时限及对应浓度
2.4 分析讨论
海洛因在体内先去乙酰化生成6-MAM,再生成MOR,最后与葡萄糖醛酸形成两个结合物排出体内。研究表明[9],两个葡萄糖醛酸结合物M3G和M6G在体内的含量不同,M6G的含量为M3G含量的15%左右。从本研究中也可看出,无论是在尿液还是血液中,都是以M3G存在形式为主。
图2显示,8只大鼠尿液中6-MAM的起始含量不高,且在短时间内快速降低直至检测不到;MOR的起始含量也不高,但其呈缓慢下降的趋势,检测时限最长;M3G的起始含量远远高于其他3种代谢物,前48 h的含量水平较高;M6G的含量整体较低,且检测时限非常短。由表6可见,大鼠尿液中检测时限最长的海洛因代谢物是MOR,检测时限可达到 180-192h (7.5~8d)。 已有文献报道[10],人尿液中6-MAM含量很少且存在一般不会超过8h,最多也不会超过24h。在本实验中,6-MAM在大鼠尿液中存在时间最长可到72~96 h,比文献中报道的时间长,可能原因是动物实验直接静脉给药,浓度较高,且大鼠的代谢与人体存在差异。
图3显示,8只大鼠血液中4种代谢物含量的变化与尿液中的变化有部分差别。大鼠血液中6-MAM的起始含量较高,在较短时间内快速降低直至检测不到;MOR在整个过程中缓慢下降,检测时限较长;M3G在血液中的含量较低,在部分大鼠血液中的检测时限较长;M6G在代谢过程中未检测到。由表7可见,大鼠血液中检测时限较长的是MOR,检测时限可达到 288 h(12 d),A、B 和 C 号大鼠血液中M3G检测时限达到312 h(13 d),与其他大鼠差别较大,考虑可能是大鼠之间代谢的差别。
本研究结果表明,大鼠尿液和血液样品中存在稳定且检测时限较长的代谢物都是MOR,最长检测时限超过1周,且在血液中的检测时限明显比尿液中的更久,最长检测时限近2周。与陈跃等[7]关于家兔唾液与血液中海洛因代谢物的检测时限研究相比,本研究同时比较了海洛因4种代谢物的检测时限。通过本实验,可以了解海洛因代谢物在大鼠尿液和血液中最长检测时限的情况,为海洛因吸食者体内代谢物检测时限的研究提供参考,但由于种属差异,以及实际案例中海洛因吸食量的变化,人体内海洛因代谢物的检测时限还有待进一步研究。
3结论
本研究采用在线固相萃取结合液质联用的方法,测定了海洛因给药后大鼠尿液与血液中4种代谢物在不同时间的含量,同时比较了尿液与血液中4种代谢物的检测时限,筛选出在大鼠体内存在稳定且检测时限较长的代谢物,大鼠尿液中检测时限最长的代谢物是MOR,检测时限可达到180~192 h(7.5~8 d);大鼠血液中检测时限较长的是MOR,检测时限可达到288h(12d),此结果为海洛因吸食者体内代谢物检测时限的研究提供了参考。

