菊花“红粉”ד延红”杂交种组培快繁技术
岳圆圆, 陈 慧, 全英杰, 龚 晨, 李 鑫, 高 日*
(1.延边大学农学院,吉林 延吉 133002;2.吉林广播电视大学,吉林 长春 130000)
菊花(Chrysanthemummorifolium(Ramat.) Tzvel.)属于菊科菊属多年生宿根草本花卉。原产于我国,是我国传统的名花,也是世界4大切花之一,深受各国人民的喜爱[1]。菊花品种繁多,花色丰富,姿态各异,鲜切小菊可以用来插制花篮、花束等,园林布景也可以用地被菊设计花坛和花台等,具有很高的观赏价值[2]。菊花大部分品种具有耐寒性,但也有部分品种耐寒性较弱[3],生产中通常采用传统杂交技术培育耐寒新品种,杂交后收获得种子数量较少,土壤播种繁殖成活率较低,严重影响杂种后代的选育[4]。然而,采用组织培养技术培养菊花成活率较高,而且繁殖系数大。李晓亮等[5]以地被菊花“香草水晶”茎尖为材料,研究瓶内快繁技术发现,试管苗增殖最佳培养基为MS+6-BA 0.5 mg/L+NAA 0.01 mg/L+白砂糖20 g/L,增殖系数为17.95;施敏等[6]以地被菊花“千代姬”的叶片为外植体,发现适合丛生芽增殖培养基为MS+6-BA 2.0 mg/L+NAA 0.2 mg/L,试管苗在培养基1/2 MS+0.1 mg/L NAA中生根较多,由此可见,菊花不同品种组织培养所用的培养基成份有差异。本试验以“红粉” × “延红”杂交种子为材料,研究外植体消毒时间、生长调节剂浓度以及基本培养基浓度对其增殖和生根的影响,旨在建立再生体系,为菊花的杂交品种选育和快繁提供理论依据。
1 材料与方法
1.1 材料
以抗寒品种“延红”(父本)和莲座花型“红粉”(母本)进行杂交,霜后收获的种子为试验材料。
1.2 方法
1.2.1 外植体消毒
用洗衣粉清洗杂交种子后置于烧杯中,流水冲洗1~2 h,在超净工作台内,用70%酒精表面消毒30~40 s后,生汞(HgCl2)溶液浸泡消毒。每个处理10个杂交种子,浸泡时间分别为5、8、11和14 min,无菌水冲洗后接种到MS+蔗糖30 g/L+琼脂粉7.0 g/L(pH值5.8)培养基中,培养温度(25±2) ℃,相对湿度70%,光照强度1 600 lx,每天光照16 h。15 d后调查发芽率。
1.2.2 BA和NAA对试管苗增殖生长的影响
将无菌苗切成1 cm长的茎段,接种于MS附加
不同浓度BA和NAA的培养基中,BA浓度设为0.5,1.0,1.5和2.0 mg/L,NAA浓度设为0.1,0.2,0.3和0.4 mg/L,分别进行组合,共16个组合,蔗糖30 g/L,琼脂粉7.0 g/L,pH值5.8,每个处理重复3次。光照强度1 600 lx,培养温度(25±2) ℃,相对湿度70%,培养30 d后,调查株高,节数,地上部干物重和不定芽数。
1.2.3 IBA浓度对试管苗生根的影响
将1 cm左右长的茎段接种在含有不同浓度IBA的MS培养基中,蔗糖30 g/L,琼脂粉7.0 g/L,IBA浓度设为0.25,1.0,1.5,2.0 mg/L。每个处理重复3次,培养条件同1.2.1,30 d后,调查株高,地上部干重,根长,根数和地下部干重。
1.2.4 MS培养基浓度对生根的影响
将试管苗分别接种于不同浓度的MS(1/4 MS,2/4 MS,3/4 MS和4/4 MS)培养基中,培养基其他成分为IBA 1.0 mg/L,蔗糖30 g/L,琼脂7.0 mg/L,MS基本培养基设为培养条件同1.2.1,30 d后观察并统计株高,地上部干重,根长,根数和地下部干重。
1.2.5 炼苗与移栽
清洗幼苗根系中的培养基,放入培养瓶中并加入水,覆盖塑料薄膜保湿炼苗,7 d后,移栽到腐殖土和珍珠岩(3∶1)混合的基质中,30 d后调查成活率。
1.3 数据分析
试验数据用SPSS 11.0软件进行统计分析,采用邓肯氏新复极差法作显著性差异分析,显著水平为0.05。
2 结果与分析
2.1 外植体消毒时间对种子发芽的影响
试验利用升汞对种子进行消毒,发现消毒时间对种子发芽率影响很大。由图1可知,消毒时间从5 min增加至8 min时,种子发芽率逐渐增加,最高达到78.3%,但消毒时间继续增加时,种子因种皮受到破坏,消毒液进入种子内使种子发芽率降低,在消毒14 min时,种子发芽率只达到7.5%。因此,为获得无菌苗,“红粉” × “延红”杂交种子消毒时间以8 min为宜。

图1 消毒时间对“红粉” × “延红”杂交种子发芽率的影响
2.2 BA和NAA浓度对试管苗增殖生长的影响
将1 cm高的无菌苗接种在含BA和NAA不同浓度组合的培养基中,30 d后调查试管苗增殖生长情况。BA和NAA不同浓度配比组间,节数有很大差异(表1)。
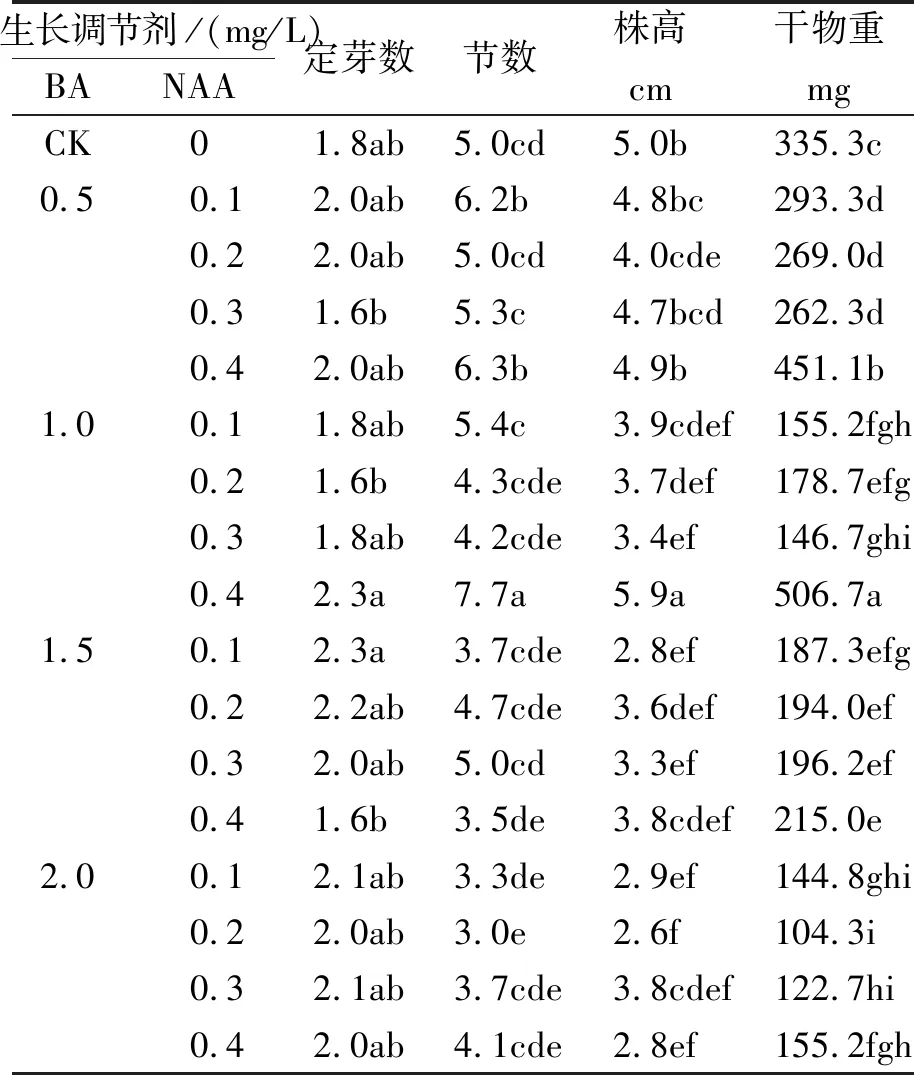
表1 BA和NAA浓度对试管苗增殖生长的影响
注:表中数据为0.05显著水平的多重比较结果。
由表1可知,组合BA 0.5 mg/L+NAA 0.4 mg/L的试管苗节数最多(7.7),显著高于其他组合,为对照的1.5倍。各组合中,试管苗不定芽数无显著差异。对试管苗株高和干重进行调查发现,同样在BA 1.0 mg/L+NAA 0.4 mg/L组合中,试管苗生长最佳,株高为5.9 cm,干重为506.7 mg,都显著优于对照(CK)和其他处理。因试管苗节数、株高及干重在BA 1.0 mg/L+NAA 0.4 mg/L组合中最佳,可选择此培养基作为“红粉” × “延红”杂交种试管苗进行增殖培养。
2.3 IBA浓度对试管苗生根的影响
在试管苗生根培养过程中,为了促进试管苗根和茎叶的生长,本试验在MS培养基中加入不同浓度的IBA进行生根培养。结果表明,在所用培养基中试管苗均可生根。培养基中加入适宜浓度的IBA可促进试管苗地上部和地下部的生长,在IBA 1.0 mg/L时,根长、根数、根干重、株高和茎叶干重均达到最高值,高于此浓度时,根及茎叶生长反而低于对照。在IBA为1.0 mg/mL处理中,株高、茎叶干重、根长、根数和根干重分别达到3.6 cm,394.8 mg,2.7 cm,13.8个和24.3 mg(表2),尤其是根长和根数,为对照的1.9和1.8倍。因此,在进行试管苗生根培养时,培养基中加入IBA1.0 mg/L较为适宜。

表2 IBA浓度对试管苗生根影响
2.4 MS基本培养基浓度对试管苗生根的影响
由表3可知,MS基本培养基浓度对试管苗根和茎叶的生长影响很大。当MS基本培养基浓度降至3/4时,利于试管苗根生长,但MS浓度继续下降时,试管苗生长受到抑制。在3/4MS时,试管苗根长、根数和根干重显著高于MS培养基,但株高和茎叶干重与MS培养基无显著性差异。因此,试管苗生根培养时可将MS培养基浓度降低至3/4。
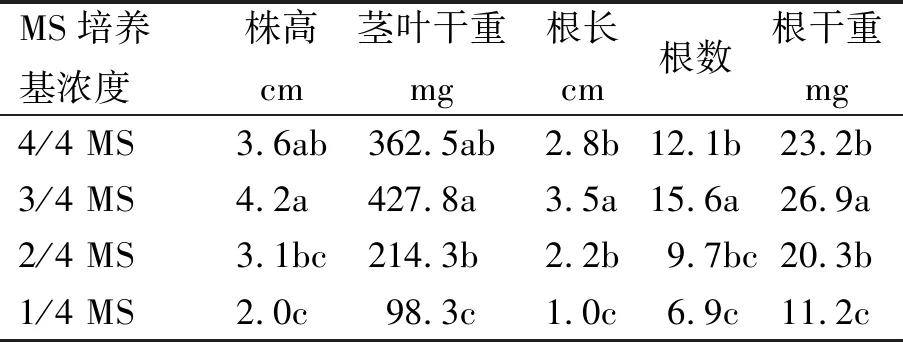
表3 MS培养基浓度对试管苗根和茎叶生长的影响
2.5 驯化移栽
增殖培养的试管苗(图2a)经生根后,选择健壮的生根苗(图2b)进行驯化移栽。用清水冲洗试管苗根部的琼脂后,将其放入装有水的培养瓶中,用塑料薄膜覆盖保湿,1周后,移栽到经灭菌的栽培基质中(腐殖土∶珍珠岩=3∶1)。移栽30 d后调查幼苗成活情况,其成活率高达95%以上(图2c)。
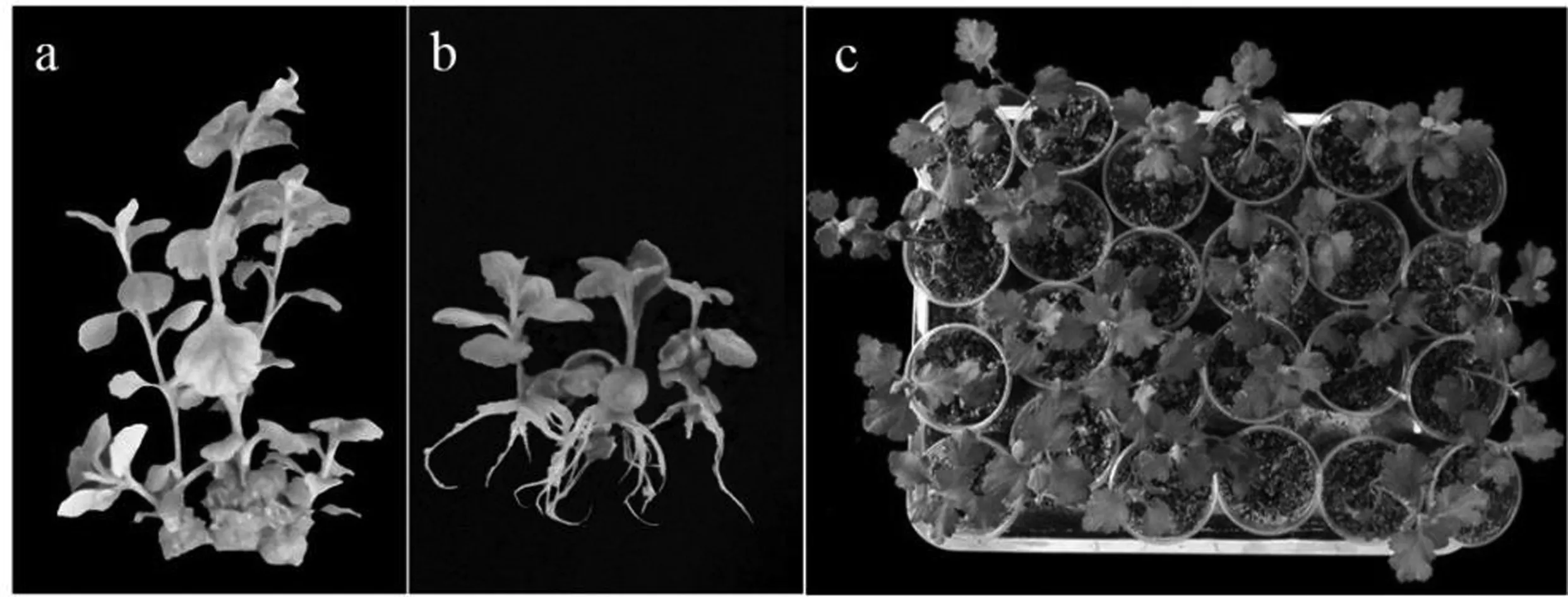
图2 “红粉” × “延红”杂交种的增殖(a)和生根试管苗(b)和移栽苗(c)
3 讨论与结论
植物生长调节剂对植物形态发育具有重要作用,细胞分裂素和细胞生长素合理的比例会促进细胞的分裂,诱导植株的增殖[7]。植物组织培养过程中,常用的细胞分裂素为BA,ZT和KT等,生长素为NAA和IBA等。目前,关于菊花组培方面的研究较多,但结果不尽相同,小黄菊不定芽诱导的最佳培养基为MS+BA 2 mg/L+NAA 1.0 mg/L[8],而菊花脑为MS+BA 1.0 mg/L+NAA 0.1 mg/L[9]。本研究发现,MS+BA 1.0 mg/L+NAA 0.4 mg/L最利于“红粉” × “延红”杂交种试管苗增殖培养(表1)。这些研究表明,即便都是菊科植物,不同种或品种的组培所需培养基不同。因此,针对特定种或品种筛选适宜的培养基是提高培养效率的重要手段。另外,本研究发现BA和NAA对“红粉” × “延红”杂交种不定芽增殖无促进作用,但可显著增加株高和节数,因此,对于此杂交种进行增殖培养时可以茎段作为主要的外植体。生根研究发现,3/4 MS培养基中,根生长显著好于MS培养基(表3),但在2/4 MS或1/4 MS培养基中,试管苗地上和地下部生长较弱,可能是培养基中无机盐浓度减少引起[10]。

