遗传性耳聋易感基因及新生儿听力联合筛查的结果分析
谢文光 关建宏 司徒尤发 梁伟敏
广东省阳江市妇幼保健院,广东阳江 529500
耳聋是由环境和遗传因素引起的常见疾病之一[1],我国新生儿听力损害的发生率较高,其中由遗传因素导致的耳聋患者达到60%以上[2]。新生儿早期听力的丧失会影响到听觉神经系统的发育,因此早期发现和预警是获得最佳治疗和康复的关键。尽管听力筛查已得到普及,但由于迟发性耳聋患者和一些症状较轻的听力损失者在出生数月或数年才表现为耳聋,往往会出现漏诊现象[3]。遗传性耳聋易感基因检测可弥补听力筛查的不足,在一定程度上可以降低耳聋高危患儿的出生率。本院对新生儿进行听力筛查,同时对常见的耳聋易感基因进行检测,并对结果进行汇总和分析,以了解本院新生儿遗传性耳聋易感基因携带情况及致病基因,并对患儿家属进行遗传指导,预防或减少听障患儿的出生。
1 资料与方法
1.1 一般资料
选取2017年6月~2018年6月在本院出生的3068例新生儿作为研究对象。纳入标准:(1)新生儿家属同意参加本次研究;(2)均为在我院出生新生儿;(3)无先天性疾病的新生儿。其中男婴1610例,女婴1458例,男女比例为1.1∶1,胎龄1~3d,平均(2.0±0.3)d。
1.2 方法
1.2.1 听力筛查 采用GSI耳声发射仪对出生2~3d的新生儿进行听力初筛。听力初筛未通过者,在出生42d后采用筛查型DPOAE或自动听性脑干反应复筛;复筛仍未通过者,应用声导抗、听性脑干反应、多频稳态反应进行听力学评估。
1.2.2 基因筛查的血样收集 家属签订知情同意书并填写了新生儿基本信息表后,采集新生儿出生72h之后的足跟血。斜针法进针,先要按摩或热敷婴儿足跟,使其充血,酒精消毒后用一次性采血针穿刺,弃去第一滴血后将挤出的血液滴在特定的滤纸上,使其充分渗透至滤纸背面。要求每个婴儿采集3个血斑,每个血斑的直径应≥10mm。待血片晾干后,和新生儿基本信息卡片一起装入封口袋中,由专人送至本院检验科进行检测,全程采取冷链转运及保存,以免血片因为高温而发生变质。
1.2.3 基因筛查方法 本实验采用凯普生物公司自主研发的耳聋易感基因检测试剂盒(PCR+导流杂交法)来检测遗传性耳聋相关基因GJB2、GJB3、SLC26A4和线粒体12S rRNA这4个基因中的13个突变位点。
1.2.3.1 低密度基因芯片检测 (1)PCR扩增。在模板加样区内,向对应的A、B系列试剂中分别加入2μL同一样本核酸溶液,反应体系均为20μL;将离心管或八联管置于PCR扩增仪中,按照试剂盒标准操作流程进行PCR扩增反应,时间为2h。(2)导流杂交与结果判读。将上述PCR反应液中的模板DNA加热解链,然后按照试剂盒标准操作流程进行导流杂交与判读,总反应时间约为1h。
1.2.3.2 测序验证 对较为严重的纯合突变或均质突变样本寄送至广州凯普医学检验所进行测序验证。共扩增8个片段以覆盖耳聋易感基因的13个突变位点。PCR反应体系及反应条件如下:在20μL的反应体系(所有引物的扩增体系均相同)中加入40ng的基因组DNA,10×Buffer(含MgCl225mmol/L) 缓冲液 2μL,10×dNTP(4 mmol/L)2μL,引物(2μmol/L)各 1μL,加 Taq酶(罗氏,2.5U/μL)0.5μL。PCR反应在 2700热循环仪上完成。反应条件为:94℃预变性5min,94℃变性30s,55℃复性 30s,72℃延伸 30s(反应 30 个循环),反应终止后72℃再延伸7min,4℃保存。PCR扩增产物经纯化后进行Sanger测序,然后在ABI3500 AvantGenetic Analyzer测序仪(ABI,美国)上完成序列分析,测序结果通过BioEdit软件与参考序列进行比对。
1.3 观察指标
(1)分析3068例新生儿听力筛查结果;(2)分析3068例新生儿遗传性耳聋易感基因筛查结果;(3)对3068例新生儿听力筛查与基因检测的结果进行比较;(4)分析3068例新生儿基因突变的分布情况。
1.4 统计学处理
应用SPSS19.0软件统计分析,计数资料以百分数表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 听力筛查及听力学评估结果
3068例新生儿中,听力初筛未通过317例,初筛未通过率10.33%,其中男婴174例,初筛未通过率10.81%;女婴143例,占未通过总数的9.81%。经听力复筛、听力学评估最终确诊听力损失15例,其中男婴8例,女婴7例。男女婴之间听力初筛未通过率差异无统计学意义(χ2=0.825,P>0.05)。见表1。

表1 3068例新生儿听力筛查结果(例)
2.2 遗传性耳聋易感基因筛查结果
3068例新生儿中,检出耳聋基因突变132例,阳性率4.30%,其中男婴76例,阳性率为4.72%,女婴56例,阳性率为3.70%,男女婴之间阳性率差异无统计学意义(χ2=1.437,P>0.05)。见表2。
2.3 听力初筛及易感基因联合筛查结果分析
3068例新生儿通过听力筛查和聋病易感基因检测,共筛出突变/听力损失445例,总阳性率为14.50%,明显高于单纯通过听力筛查发现的听力损失发生率10.33%,差异有统计学意义(χ2=7.938,P< 0.05)。见表3。

表2 3068例新生儿遗传性耳聋易感基因筛查结果
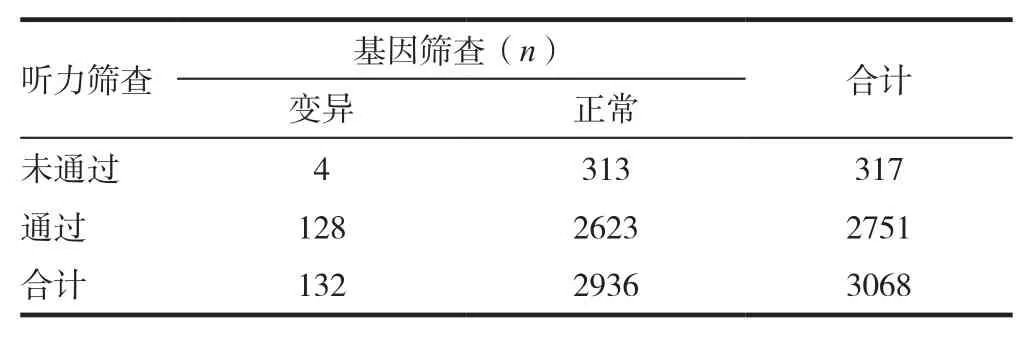
表3 3068例新生儿听力筛查与基因检测结果比较
2.4 耳聋基因突变的分布
3068例新生儿中,耳聋易感基因变异132例,阳性率43.02‰,其中GJB2突变79例,阳性率25.75‰;GJB3突变12例,阳性率3.91‰;SLC26A4突变38例,阳性率12.39‰,线粒体12SrRNA突变3例,阳性率1.10‰。见表4。
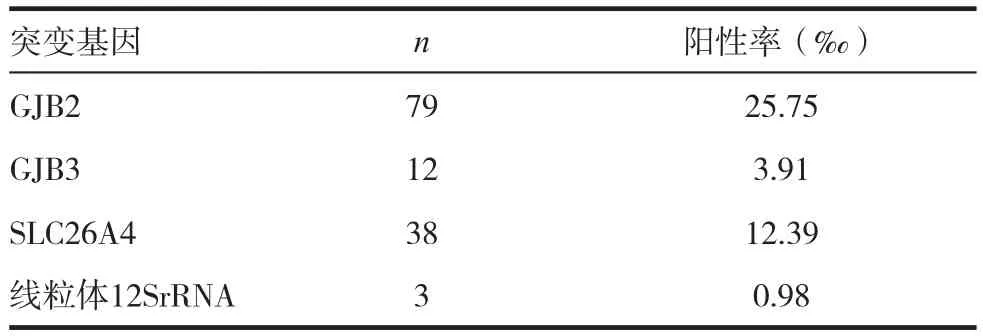
表4 3068例新生儿基因突变的分布
3 讨论
耳聋是由遗传和多种环境因素导致的常见感觉性疾病,其中由遗传因素所致耳聋约占50%~60%[1,4]。尽管新生儿听力筛查已经普及,并在先天性耳聋患者的早期诊断、发现与干预过程中发挥着重要作用,但单纯的听力筛查并不能及时发现迟发型耳聋等出生时未出现听力下降的新生儿[5]。遗传性耳聋易感基因检测有助于发现遗传性耳聋高危人群,从而实施有效的干预和预防。在本研究中,通过对3068例新生儿进行听力筛查和聋病易感基因检测,筛查出听力初筛不通过和基因突变者445例,总阳性率为14.44%,较单纯听力筛查的检出率高,说明听力筛查和基因检测的联合使用能够提高耳聋疾病的检出率。
目前,已克隆的与耳聋相关的基因有很多,包括常染色体隐性基因、常染色体显性基因和线粒体基因[6]。很大部分的遗传性耳聋是由单一基因突变引起[7],且耳聋易感基因的变异具有地域差异[8]。GJB2[9]、SLC26A4[10]和线粒体12S rRNA基因[11]是最常见的遗传性耳聋易感基因。GJB2是导致遗传性非综合征型耳聋最常见的基因,约有20%的先天性耳聋患者与该基因相关[12]。GJB2基因中235位点C碱基纯合性缺失,会导致移码突变,造成感音神经性耳聋[13]。SLC26A4基因编码的Pendrin蛋白能够介导氯离子的转运,与大前庭水管综合症有关。Pendrin蛋白的异常可引起前庭水管及耳蜗结构改变。线粒体DNA(mtDNA)12S rRNA基因与氨基糖甙类药物导致的药物性聋有关[14]。mtDNA12S rRNA基因的突变使得患者对此类药物的敏感性增加。本研究3068例新生儿中,遗传性耳聋易感基因变异132例,阳性率达到43.02‰,其中GJB2和SLC26A4的阳性率分别为25.75‰和12.39‰,提示正常新生儿中GJB2基因、SLC26A4基因突变占有一定的比率。因此,在新生儿听力筛查的基础上,开展耳聋基因筛查,明确遗传性耳聋高危人群,对降低耳聋发病率有着重要意义。
尽管基因筛查技术得到快速发展,但听力筛查在早期发现新生儿听力损失中仍具有不可替代的作用[15]。因此,结合新生儿听力筛查与遗传性耳聋易感基因检测的结果进行联合筛查,对于早期发现与遗传相关的迟发性耳聋患者和药物性聋高危患者有着非常重要的意义[16]。

