27-羟基胆固醇在乳腺癌、前列腺癌和子宫内膜癌发生发展中的作用
(1.南华大学药物药理研究所,湖南 衡阳 421000;2.新型抗体药物及其智能运输系统湖南省重点实验室,湖南 怀化 418000)
2007年,Umetani等[1]发现了一种天然存在的选择性雌激素受体调节剂(Selective Estrogen Receptor Modulator,SERM),即27-羟基胆固醇(27-Hydroxycholesterol,27HC或27-OHC)。27HC是一种具有雌激素样作用的胆固醇初级代谢物,能促进肿瘤的生长和侵袭。27HC在癌症中的作用主要取决于其内源性SERMs和肝X受体(Liver X Receptor,LXR)调节剂的功能,可以通过调节ER和LXR的转录活性在肿瘤的发生发展中发挥重要的生物学作用。
细胞内胆固醇水平会调节癌症中许多固有激活或失调的信号转导途径,反之亦然。流行病学研究证实了肥胖和血浆循环胆固醇水平升高是乳腺癌、前列腺癌和子宫内膜癌复发的危险因素并与患病风险呈正相关[2];而长期使用他汀类降胆固醇药物会导致乳腺癌患者的无复发生存时间显著延长,还与乳腺癌、子宫内膜癌、结直肠癌和霍奇金淋巴瘤等数十种恶性肿瘤的患病风险呈负相关[3]。简而言之,27HC在很多肿瘤的发病机制中起重要作用,特别是发病率高且存在性别特异性的恶性肿瘤。本文就27HC在乳腺癌、前列腺癌和子宫内膜癌等恶性肿瘤中的研究进展进行综述,介绍了27HC在有关癌症中的重要作用及未来研究的潜在方向。
1 27HC的生物合成和分解代谢
参与调控27HC含量的关键酶是细胞色素P450氧化酶系胆固醇27α羟化酶(CYP27A1)和25α7羟化酶(CYP7B1),它们分别起催化合成和分解代谢作用,两者具有显著的同源性。CYP27A1主要在肝脏、乳腺癌细胞和肿瘤相关性巨噬细胞中高表达,CYP7B1则在体内广泛分布[4]。将CYP27A1导入细胞可刺激胆固醇外流,催化胆固醇羟基化为27HC并调节胆固醇稳态。CYP7B1则催化肝外组织中胆固醇分解代谢途径的第一步反应。已知细胞内胆固醇跨膜转运及其进入线粒体的通量均受类固醇合成急性调节蛋白1(Steroidogenic acute regulatory protein,StAR 或STARD1)和StAR相关脂质转移结构域蛋白3(StAR related lipid transfer domain containing 3,STARD3)的严格调节;而StAR可直接将胆固醇递送至线粒体内膜中,经CYP27A1催化作用后在酸性途径中合成27HC。因此,胆固醇进入线粒体的转运过程以及CYP27A1的表达和活性是内源性合成27HC的两个限速步骤,27HC会被驻留在内质网上的CYP7B1进一步羟基化,所得的7a-羟化代谢物也最终被代谢为胆汁酸[5]。27HC的生物合成和分解代谢过程见图1。

图1 27HC的生物合成和分解代谢
1.1 CYP27A1在肿瘤中的作用
CYP27A1是一种可以组织特异性地调节雌激素和LXR的多功能氧固醇,也是人体内唯一一种能将胆固醇催化为27HC的细胞色素P450氧化酶。有报道称他汀类药物可有效降低血清中的27HC水平,并使肿瘤中的CYP27A1表达失调。CYP27A1与乳腺癌生理病理学和预后之间的关系密切。CYP27A1的表达是影响乳腺癌患者总体生存率和无复发生存率等预后指标的独立危险因素。CYP27A1在原发性乳腺癌中的表达存在异质性,CYP27A1高水平表达与高肿瘤分级,ER阴性和基底样亚型显著相关[6]。与正常人相比,分化良好的早期乳腺癌患者,其血浆CYP27A1水平偏低而CYP7B1水平偏高。当CYP27A1高表达时或CYP7B1表达缺失时,27HC的水平也随之升高,并通过介导ER或LXR在乳腺癌中发挥重要作用。
在前列腺肿瘤中CYP27A1基因的表达明显低于正常,而侵袭性癌症患者该基因的表达更低。CYP27A1的表达活性是27HC在前列腺癌中发挥作用的重要影响因素之一。Alfaqih等[7]提出,CYP27A1的表达与前列腺癌的进展呈负相关;较低的CYP27A1转录水平与较短的无病生存期和较高的肿瘤分级有关。此外,低CYP27A1表达和高胆固醇合成会增加致死性前列腺癌的患病风险。研究表明,27HC可以上调人前列腺癌细胞(PC3)中CYP27A1表达,而过表达的CYP27A1会抑制前列腺癌细胞(LNCaP和22RV1)异种移植物的细胞增殖。CYP27A1是调控胆固醇的关键基因,CYP27A1/27HC信号轴失调在前列腺癌发病机制中发挥重要作用。
CYP27A1和CYP7B1在子宫内膜癌中均有表达且表达量与癌症分化程度有关。子宫内膜癌组织中CYP27A1的表达明显高于正常组织,CYP7B1则与之相反。虽然低分化子宫内膜癌中CYP7B1的表达显著低于中分化癌症,但CYP27A1在低分化子宫内膜癌中的表达水平则更高。因此CYP27A1可能是乳腺癌等恶性肿瘤的潜在治疗靶点。
1.2 CYP7B1在肿瘤中的作用
CYP7B1在不同组织中通过作用于不同底物产生多种生理功能,可以催化类固醇和氧固醇羟基化、促进胆固醇生成胆汁酸和调节雌激素和雄激素的信号传导,而27HC的异常增加与CYP7B1的缺失有关。
乳腺癌组织中CYP7B1的表达水平与正常乳腺组织相比减少了50%,血清总胆固醇升高的乳腺癌患者血浆中的CYP7B1表达明显低于总胆固醇正常的患者[4]。CYP7B1的表达减少会降低乳腺癌患者的生存率。此外,与ER阴性乳腺癌相比,ER阳性乳腺癌中CYP7B1基因的表达出现特异性失调,并与患者的临床分期密切相关。
CYP7B1参与了包括雄激素代谢在内的许多代谢过程。CYP7B1启动子区域的局部甲基化能显著促进其基因转录,其表达还会伴随着前列腺癌的发展而增加。CYP7B1在高级别前列腺上皮内瘤(PIN)和前列腺癌组织中的表达均高于正常前列腺组织。在啮齿动物中发现CYP7B1可对前列腺癌细胞激素水平起调节作用。雄激素可以通过调节CYP7B1介导的代谢来控制雌激素在前列腺内的水平,而CYP7B1介导的催化作用也可以减少一些雄激素反应。另外,雄激素和雌激素对LNCaP细胞中CYP7B1转录也有一定的影响。
2 27HC与肿瘤
27HC与恶性肿瘤的关系非常密切。27HC可以通过介导细胞内信号传导途径在肿瘤的病理生理过程中发挥重要作用,27HC可以激活ERK 1/2和Akt信号通路来促进肿瘤细胞存活。 在乳腺癌和前列腺癌中发现,27HC不仅在血管内皮中诱导PI3K/Akt活化,还能介导JAK/STAT信号传导失调,进而发挥致癌作用。其次,27HC对LXR依赖性和LXR非依赖性调节能增加JAK/STAT信号传导途径的活化,且27HC诱导的肿瘤细胞增殖可以通过激活LXR来进行抑制。
27HC通过各种机制在不同的永生化细胞系中诱导细胞凋亡。27HC经外源性凋亡途径,诱导相关死亡受体与肿瘤坏死因子α(Tumour necrosis factor-α,TNF-α)和Fas配体(Fas ligand,FasL)等促炎或促凋亡细胞因子结合,使死亡受体结构域寡聚化,形成死亡诱导信号复合物激活效应器半胱天冬酶(Caspase3/6/7)后启动信号级联促进细胞凋亡[8]。此外,27HC还可以引发线粒体功能障碍和氧化应激,降低线粒体膜电位,诱导胞内Ca2+失调,随后激活Caspase级联反应,通过内在凋亡途径来诱导细胞凋亡。
在不同的疾病模型中发现了27HC可以诱导促炎性细胞因子、趋化因子等的表达,并引起全身性或组织范围的局部炎症。27HC通过直接激活TLR4/NF-κB、ERK1/2和JNK等信号通路[9],上调TNF-α、白细胞介素8(Interleukin- 8,IL-8)、白细胞介素1β(Interleukin- 1β,IL-1β)、单核细胞趋化蛋白1(Monocyte Chemotactic Protein-1,MCP-1)和巨噬细胞炎性蛋白-1β(Macrophage inflammatory protein-1β,MIP-1β)等的表达,进而参与肿瘤发生、肿瘤基质的调节、血管生成、肿瘤细胞侵袭和迁移,以此来构成肿瘤转移的机制基础。
2.1 27HC在乳腺癌中的作用
乳腺癌是全球女性中发病率极高的恶性肿瘤。27HC作为胆固醇和乳腺癌发病机制的关键调节因子,可以直接参与乳腺癌的发生发展。ER阳性乳腺癌患者与无癌对照组相比,正常乳腺组织中的27HC含量增加,癌组织的27HC含量则进一步升高。其次,绝经后妇女27HC的循环浓度增加,并伴随着乳腺癌患病风险的增加。另外,服用他汀类药物的患者乳腺癌发病率和复发率均降低[3],而经饮食改良降低总胆固醇、抗雌激素治疗或直接停止补充27HC,不仅抑制了肿瘤的侵袭性还能减少肥胖和代谢综合征对乳腺癌发病率的影响。
2.1.1 27HC与ER信号通路 27HC可以通过介导ER和LXR的转录活性来参与乳腺癌的发生发展。27HC可由MCF7细胞产生,并刺激细胞自主性、ER依赖性和GDNF-RET依赖性增殖。27HC对ER的调节作用主要取决于ER的转录活性[1]。Nelson等[4]通过敲除CYP7B1来增加血浆和肿瘤内27HC的水平,建立了MMTV-PyMT小鼠模型,首次揭示了27HC促进肿瘤生长和减少肿瘤发展潜伏期的作用取决于ER转录活性。
2.1.2 27HC与LXR信号通路 然而,27HC还是 LXR的配体激动剂,LXR作为胆固醇代谢的感受器和脂质代谢的关键调节因子,同样影响着乳腺癌的发生发展。在ER阳性乳腺癌细胞(MCF7和T47D)中激活LXR会抑制肿瘤细胞增殖并促进其侵袭和迁移,但ER阴性乳腺癌细胞(MDA-MB231)和HER2阳性乳腺癌细胞(SK-BR3)的增殖能力则不受影响;另一方面,激活LXR还会下调ERα和多种参与细胞周期调控的关键蛋白的表达,如细胞S期激酶相关蛋白2(S-phase kinase-associated protein 2,SKP2),细胞周期蛋白A2(Cyclin A2),细胞周期蛋白D1(Cyclin D1)[10]。此外,LXR激活会抑制PI3K/Akt活化进而减少MCF7细胞的增殖。这种LXR诱导的PI3K/Akt信号传导抑制作用和随后的细胞增殖减弱均归因于LXR-靶基因,即磷酸酶和张力蛋白同源基因(Gene of phosphate and tension homology deleted on chromsome ten,PTEN)以及PH结构域富含亮氨酸重复蛋白磷酸酶(PH domain and leucine rich repeat protein phosphatase-like,PHLPPL)表达的增加。
2.1.3 27HC与其他信号通路 27HC还能以不依赖ER和LXR的方式促进乳腺癌细胞增殖、侵袭和迁移。一方面,在MCF7细胞中,27HC可以通过调节p53和E3泛素连接酶小鼠双微体2(Murine double minute2,MDM2)的活性来促进细胞增殖[11]。另一方面,27HC可以抑制Myc稳定性负调节因子:蛋白磷酸酶2A(Protein phosphatase 2A,PP2A),小C-末端结构域磷酸酶1(Small C-terminal domain phosphatase 1,SCP-1)和泛素化蛋白酶(F-box/WD repeat-containing protein 7,FBW7)的表达,增加Myc在MCF7细胞中的稳定性和转录活性,进而促进Myc靶蛋白Ki67和SKP2的表达及细胞增殖[12];还会上调SET蛋白和PP2A的癌性抑制因子(Cancerous inhibitor of PP2A,CIP2A)的表达水平[13]。此外,27HC和LXR合成激动剂GW3965均能诱导锌指蛋白(Snail1),波形蛋白(Vimentin)和成纤维细胞激活蛋白(Fibroblast activation protein,FAPα)的表达,使乳腺癌细胞(E0771和Met1)呈现EMT样形态学变化。再者,27HC对乳腺癌细胞的血管生成、迁移和侵袭能力的促进作用与STAT3的磷酸化程度以及转录活性关系密切。27HC激活STAT3会诱导E盒锌指蛋白1(Zinc finger E-box-binding homeobox 1,ZEB1),基质金属肽酶9(Matrix metallopeptidase 9,MMP9)和Vimentin表达增加并伴随E-钙粘蛋白(E-cadherin)表达的减少[14]。27HC在乳腺癌发病机制中的作用总结见图2。
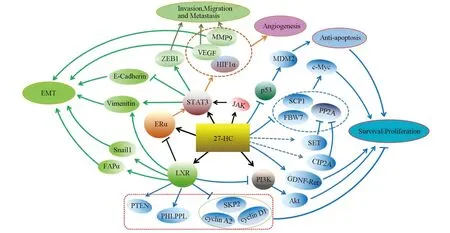
图2 27HC在乳腺癌发病机制中的作用
2.2 27HC在前列腺癌中的作用
高血浆胆固醇水平是发展前列腺癌的重要危险因素,与高度特异性前列腺癌的发病率呈正相关,降胆固醇药物可以降低患晚期前列腺癌的风险。研究证实,膳食胆固醇能直接影响高风险前列腺癌的发病机制,比如高胆固醇饮食可以促进TRAMP小鼠模型中前列腺癌血管生成和肿瘤转移;而他汀类药物并却不能改善前列腺癌患者的预后[3],这提示了胆固醇本身可能并不是前列腺癌的关键病因学因素。因此,人们开始将研究氧固醇(胆固醇氧化产物和代谢物)并进一步发现血浆中含量最丰富的氧固醇27HC的水平在前列腺癌组织中显著升高,提示27HC才是关系前列腺癌发生发展的真正风险因素。27HC可以诱导前列腺癌细胞增殖,还可以减弱多西紫杉醇(Docetaxel)对非致瘤性前列腺上皮细胞(RWPE-1)的促凋亡作用。
2.2.1 27HC与ER信号通路 27HC可以调控ER和LXR介导的基因转录及其在前列腺癌中的作用和机制,且在去势抵抗性前列腺癌(Castration-resistant prostate cancer,CRPC)中的作用尤为突出。正常的前列腺上皮细胞以及前列腺癌细胞能同时表达ERα和ERβ。尽管人们已经形成将ERα作为促增殖和致癌因子的共识,但ERβ在前列腺癌的发展和EMT等过程中却有着异常复杂的作用,如ERβ的促凋亡和抗增殖作用等。然而,Raza等[15]发现27HC促进LNCaP和PC3细胞的增殖必须激活ERβ。27HC在LNCaP和PC3细胞中上调ERβ表达而ERα无明显变化,ERβ特异性抑制剂可以减弱27HC诱导的细胞增殖作用。另外,27HC对LNCaP和PC3细胞侵袭的抑制作用同样取决于ERβ的活性[15]。虽然ERβ是前列腺癌细胞侵袭和转移的抑制因子,但不同的ERβ亚型对EMT和肿瘤转移可能会存在不同的影响。
2.2.2 27HC与LXR信号通路 研究发现,27HC可以通过降低Akt的Thr308和Ser473残基处的磷酸化水平,进一步抑制Akt的活化,发挥抑增殖作用。而Akt在信号通路中的下调、胆固醇从头合成和促炎细胞因子表达的降低均与LXR的活化有关。LXR激动剂T0901317可以通过增加细胞周期蛋白激酶抑制因子(Cyclin-dependent kinase inhibitor 1B,CDKN1B)p27Kip-1表达,减少S期细胞数目,最终抑制LNCaP细胞增殖;相反,LXRα/β双敲除会导致小鼠前列腺上皮内瘤的形成并促进肿瘤细胞的恶性增殖。此外,在LNCaP和PC3细胞中,增强雄激素受体(Androgen receptor,AR)的转录活性会下调LXR靶基因的表达;同时,激活LXR也会减弱前列腺癌细胞(DU145和LNCaP)中AR的转录活性及AR靶基因的表达。还有较多的证据表明在前列腺癌中LXR-AR与AR之间存在信号串扰,而这对于胆固醇和脂质代谢都至关重要[15]。LXR或可以作为有效的治疗靶点来抑制前列腺癌的发生发展。
2.2.3 27HC与其他信号通路 除此之外,27HC还可以介导其它信号传导途径在前列腺癌中发挥作用。27HC可以在RWPE-1细胞中提高AR转录活性,上调AR-靶基因和前列腺特异性抗原的表达水平并增强AR与雄激素应答元件的结合,而敲低AR则可显著减弱27HC诱导的增殖作用。27HC通过抑制胆固醇调节元件结合蛋白2(Sterol-regulatory element binding protein 2,SREBP2)的活化,下调低密度脂蛋白受体(Low-Density Lipoprotein Receptor,LDL-R)的表达,进而降低前列腺癌细胞中胆固醇的含量;还可以促进PC3细胞中两种异染色质蛋白1(Heterochromatin protein 1,HP1)即HP1α和HP1β的表达来抑制了LNCaP和PC3细胞的侵袭和迁移[15]。 跨膜蛋白受体(Patched,Ptc)与肿瘤干细胞(Cancer stem cells,CSCs)增殖高度相关,是Sonic hedgehog(Shh)/Smoothened(Smo)信号通路的重要组分和调节因子。27HC不仅能上调Ptc的表达水平来发挥促增殖作用,还能上调锌指蛋白2(GLI family zinc finger 2,GLI2)和锌指蛋白3(GLI family zinc finger 3,GLI3)的表达,而GLI2和GLI3能直接与Shh/Smo信号通路偶联,进一步介导前列腺癌的发展和转移。27HC在前列腺癌发病机制中的作用总结见图3。
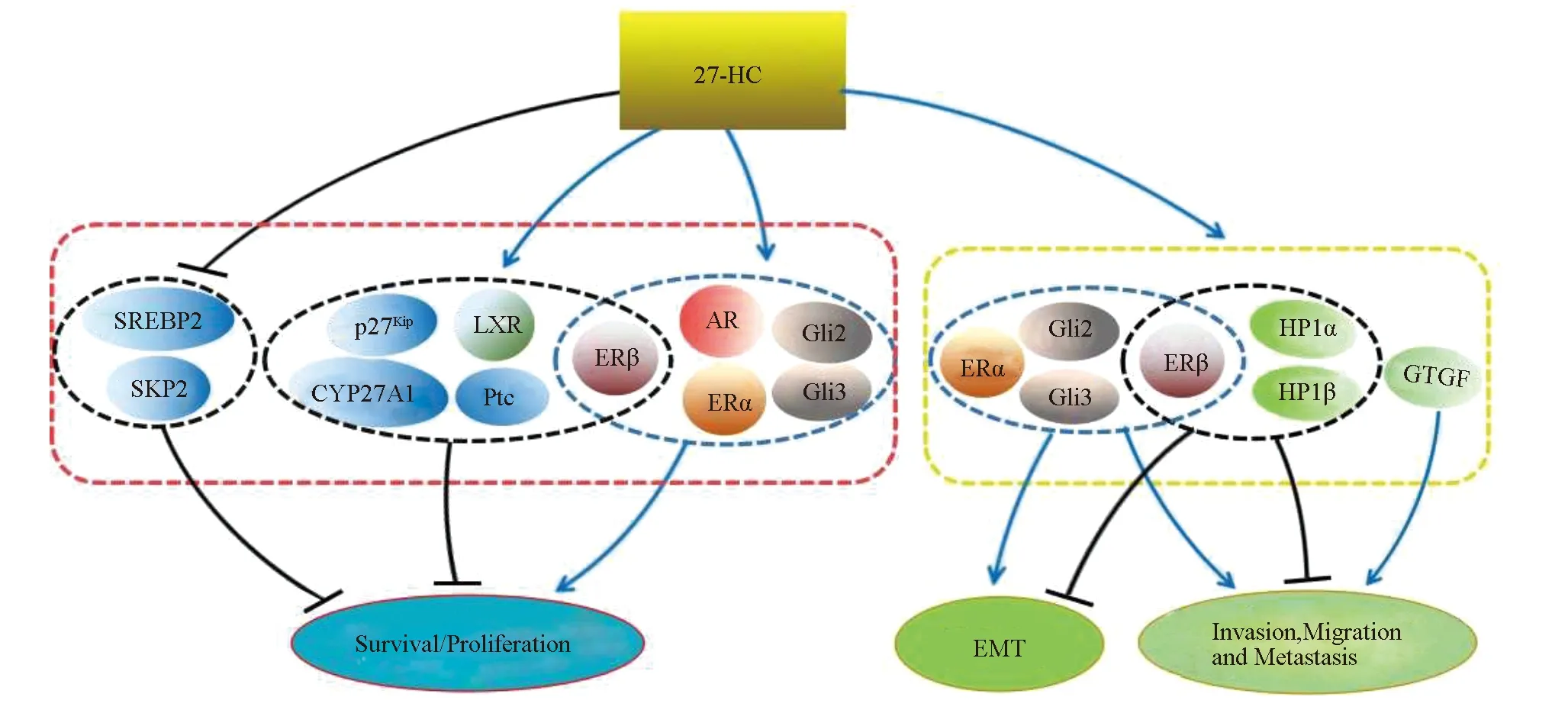
图3 27HC在前列腺癌发病机制中的作用
2.3 27HC在子宫内膜癌中的作用
子宫内膜癌是最常见的妇科恶性肿瘤之一,近年来发病率呈上升趋势。研究证实,肥胖和代谢综合征以及饮食中胆固醇的消耗与子宫内膜癌的患病风险成正相关,肥胖被认为是子宫内膜癌主要且可改变的独立危险因素[16]。子宫内膜癌常见于围绝经期和绝经后妇女[2]。如果体内雌激素水平过多会增加患Ⅰ型子宫内膜癌的风险。雌激素及其代谢物可以诱导乳腺和子宫内膜细胞过度增殖及DNA损伤进而促成了恶性肿瘤转化。研究发现,相较于正常女性,子宫内膜癌患者体内27HC水平异常升高,而27HC水平的升高同样会增加子宫内膜癌的患病风险。
ER和LXR不同亚型在子宫内膜癌中的表达水平与癌症的分化等级有关。与正常绝经后女性相比,在高分化子宫内膜癌患者的上皮细胞和间质细胞中能检测到ERα的表达,但其在低分化癌症中的表达则显著降低。相反,在高、中、低分化的Ⅰ期子宫内膜癌中都容易检测到ERβ剪接变体(ERβ 1,2,5)的表达。体外研究表明,与低分化子宫内膜癌细胞(MFE 280)相比,中度分化子宫内膜癌细胞(RL95)LXRα mRNA水平显著降低,LXRβ mRNA水平无明显差异。所以,27HC对子宫内膜癌的作用可能与ER和LXR亚型在疾病不同阶段的生物利用度有关。
Gibson等[2]发现在子宫内膜癌细胞(Ishikawa和RL95)中,27HC可以选择性激活ER并促进细胞增殖,而其对MFE280细胞增殖无明显作用;另外,用GW3965靶向激活LXR可以显著减弱27HC对Ishikawa和RL95细胞的增殖作用。因此27HC可以通过促进子宫内膜癌上皮细胞的增殖来增加子宫内膜癌的恶性程度。总之,胆固醇代谢异常和27HC水平升高都可以激活ER依赖性途径,促进上皮细胞增殖,进而影响子宫内膜癌的发展进程[2],而其是否还具有除促细胞增殖以外的作用仍需进行更多更深入地研究。
2.4 27HC在其它恶性肿瘤中的作用
文献报道,27HC在肺癌、胃癌、膀胱癌和结肠癌等恶性肿瘤的发生发展中产生重要作用。肺癌组织内含有丰富的27HC,其合成酶CYP27A1在肺癌细胞中的表达也高于正常肺细胞。27HC对ER的激动或拮抗作用具有细胞或组织类型特异性。研究表明27HC通过激活ERβ来促进ERβ阳性肺癌细胞增殖,但不影响ER阴性或ERα阳性肺癌细胞的增殖;27HC上调LXR的表达,减少ER阴性肺癌细胞(A549)胆固醇的摄入和从头合成并抑制了细胞活力和增殖[17]。其它方面,27HC通过激活PI3K/Akt信号通路促进肺癌的发生发展;27HC可以通过抑制mir-139的表达和激活stat3/c-fos/nfatc1途径促进肺腺癌微环境中破骨细胞的形成进一步加快肿瘤的骨转移。此外,文献报道了,27-HC可以抑制结肠癌细胞增殖、降低细胞的活力,且其对细胞增殖的抑制作用与细胞毒性或细胞凋亡无关。体外研究证实,经27-HC处理的结肠癌细胞(Caco2)中总AKT水平增加而p-AKT水平却显著降低[18]。27-HC可能通过下调p-AKT水平来抑制Caco2细胞增殖,而不是通过作用于LXR和ER。CYP27A1/ 27HC还可以通过LXR途径上调ATP结合盒转运蛋白G1(ATP-binding cassette sub-family G member 1,ABCG1)和ATP结合盒转运蛋白A1(ATP-binding cassette sub-family A member 1,ABCA1),下调LDLR的表达,进而降低膀胱癌细胞(T24和UM-UC-3)中的胆固醇水平并抑制细胞增殖[19]。Guo等[20]研究发现,与健康受试者的邻近正常粘膜组织和胃液相比,人胃癌组织和癌胃液中27HC的水平显著升高;27HC可能通过激活LXR来抑制胃癌细胞(HGC-27)的增殖和迁移。
3 总结与展望
胆固醇代谢物27HC是内源性SERM和LXR调节剂的发现为医学研究开辟了新的前沿,特别是在恶性肿瘤领域。然而,27HC在恶性肿瘤中的生物学功能及其对相关信号通路的调控作用与肿瘤类型、临床分期及分化程度密切相关。尽管不少研究已经证实了27HC在肿瘤细胞增殖、血管生成、EMT、侵袭和迁移等方面所产生的影响,但其与乳腺癌、前列腺癌和子宫内膜癌等疾病发生发展的关系及其具体作用机制还尚未完全明确。本综述介绍了27HC对ER、LXR和其它信号通路及其合成代谢关键酶的调节作用在相关肿瘤发展进程中产生的重要影响,为研究人员提供了新的研究思路和方向,同时对肿瘤内分泌治疗等方面的临床用药临床用药也具有一定的指导意义。调控胆固醇水平或是生活方式干预和药理干预治疗的潜在目标。CYP27A1和CYP7B1可作为乳腺癌、前列腺癌等疾病预后复发的预测及监测生物标志物,而CYP27A1和LXR或是治疗这几种癌症的潜在关键靶点。合理使用降脂药物或CYP27A1靶向抑制剂可有效抑制恶性肿瘤的发展进程。本综述重点介绍了27HC在乳腺癌、前列腺癌和子宫内膜癌中的作用,但其在肺癌、胃癌、膀胱癌和结肠癌等其他癌症中的作用还需要研究人员进行更深入更系统的研究。

