肿瘤-间质比例对胃癌患者预后的预测价值
罗欣,李继昌,马那琦
宝鸡市中心医院消化内科,陕西 宝鸡 721008
胃癌是全球第四大常见的恶性肿瘤,也是导致肿瘤相关死亡的第二大原因[1]。肿瘤直径、临床分期、淋巴结和神经浸润是影响胃癌患者预后的重要因素[2-3]。尽管目前临床上可通过上述指标评估胃癌患者的预后并指导辅助治疗,但胃癌患者的总生存情况仍较差,其5年生存率低于30%[4]。为改善胃癌患者的预后,仍需寻找新的预后相关指标。近年来的研究指出肿瘤微环境中的间质成分对肿瘤的发生、发展和转移具有重要意义[5-6]。肿瘤-间质比例(tumor-stroma ratio,TSR)能够有效预测恶性肿瘤患者的预后,间质成分的增加与实体瘤患者的不良预后密切相关[7-8],但目前尚无研究报道TSR对胃癌患者预后的预测价值。本研究收集216例接受D2根治术的胃癌患者的临床资料,旨在评估TSR对胃癌患者预后的预测价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2009年1月至2012年12月于宝鸡市中心医院接受D2根治术的胃癌患者的临床资料。纳入标准:①经病理检查确诊为胃癌;②无远处转移;③术后随访资料完整。排除标准:①合并肝脏转移或其他部位远处转移者;②术后30天内死亡者;③无随访资料者;④无石蜡组织标本者。根据纳入和排除标准,本研究共纳入216例胃癌患者,其中,男143例,女73例;平均年龄为(58.2±13.5)岁;102例患者接受全胃切除术,96例患者接受远端胃大部切除术,18例患者因肿瘤局部浸润而接受联合切除术[15例患者接受联合脾脏切除术,3例患者接受联合右半结肠切除术]。根据第7版美国癌症联合委员会(American Joint Comm ittee on Cancer,AJCC)指南[9]对患者进行TNM分期,Ⅰb期51例,Ⅱ期88例,Ⅲ期77例。术后病理检查结果显示,平均肿瘤直径为(23±11)mm,切缘阴性,达R0切除。129例患者在术后接受辅助化疗,其中43例患者采取卡培他滨联合奥沙利铂(XELOX)方案化疗,每3周1次;67例患者采取氟尿嘧啶、甲酰四氢叶酸联合奥沙利铂(FOLFOX)方案化疗,每2周1次;19例患者口服替吉奥(S1)化疗。
1.2 组织病理学评估
从患者的手术切除标本中获得单个或多个2.5 cm×3.3 cm组织块,经福尔马林固定、石蜡包埋后制成4 mm厚度切片,并进行苏木素-伊红(hematoxylin-eosin,HE)染色。根据HE染色结果,判断肿瘤细胞与间质的比例。在显微镜(×40)下对组织切片进行观察,找到阳性肿瘤细胞,随后在×100的放大倍数下,观察视野内肿瘤细胞与间质所占的面积,以肿瘤细胞面积除以间质面积作为TSR。以TSR=1作为临界值,TSR≤1(即间质面积所占比例≥50%)为多间质,而TSR>1(即间质面积所占比例<50%)为少间质[10]。当在内皮连接的血管样结构内可见单个肿瘤细胞或肿瘤细胞团块时,诊断为淋巴微管浸润阳性。而神经浸润阳性定义为沿着神经和(或)在神经鞘的外膜、周膜和神经鞘内可见肿瘤细胞存在。阳性淋巴结比例(lymphnode ratio,LNR)为转移淋巴结与淋巴结总数的比值[11]。
1.3 术后随访
术后定期对患者进行门诊随访。术后1年内,每3个月随访1次,术后1年后,每半年随访1次,随访截止时间为2017年12月。观察并比较两组患者的5年生存率及无进展生存率。
1.4 统计学分析
采用SPSS 23.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验;采用Cox比例风险模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 少间质和多间质胃癌患者临床特征的比较
组织病理学结果显示,少间质患者81例(37.5%),多间质患者135例(62.5%)。少间质和多间质患者的年龄、性别、肿瘤直径、手术方式、TNM分期和术后化疗情况比较,差异均无统计学意义(P>0.05)。少间质和多间质患者的T分期、N分期、淋巴结转移个数、LNR、神经浸润情况和淋巴微管浸润情况比较,差异均有统计学意义(P<0.01)。与少间质患者相比,多间质患者T3~T4期的比例较高,N2~N3期的比例较高,淋巴结转移个数较多,LNR值较高,神经浸润和淋巴微管浸润的比例较高。(表1)
2.2 生存情况的比较
所有患者的随访时间为3~76个月,中位随访时间为38个月,随访结束时,115例患者死亡,101例患者生存。术后1、3、5年总生存率分别为96.4%、53.0%和46.8%。R0切除后131例患者复发。多间质患者的5年总生存率为25.9%,明显低于少间质患者的81.5%,差异有统计学意义(χ2=54.872,P<0.01);多间质患者的5年无进展生存率为19.2%,明显低于少间质患者的72.8%,差异有统计学意义(χ2=62.150,P<0.01)(图1、图2)。

表1 少间质和多间质胃癌患者临床特征的比较
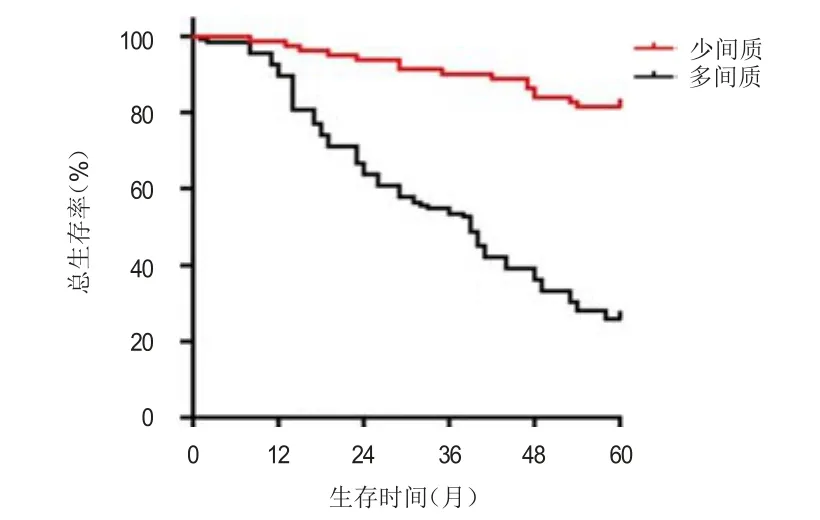
图1 少间质(n =81)和多间质(n =135)胃癌患者的总生存曲线
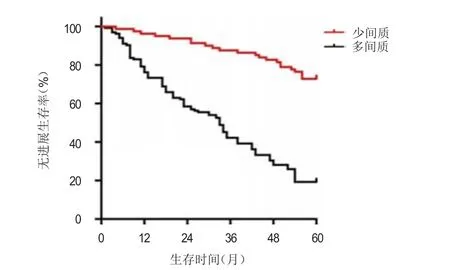
图2 少间质(n =81)和多间质(n=135)胃癌患者的无进展生存曲线
2.3 胃癌患者总生存率影响因素的分析
单因素分析结果显示,T分期、TNM分期、淋巴微管浸润、神经浸润、术后化疗、间质比例与胃癌患者的总生存率有关。多因素分析结果显示,T分期为T3~T4期(OR=1.96,P<0.01)和多间质(OR=5.38,P<0.01)是影响胃癌患者总生存率的危险因素。(表2)
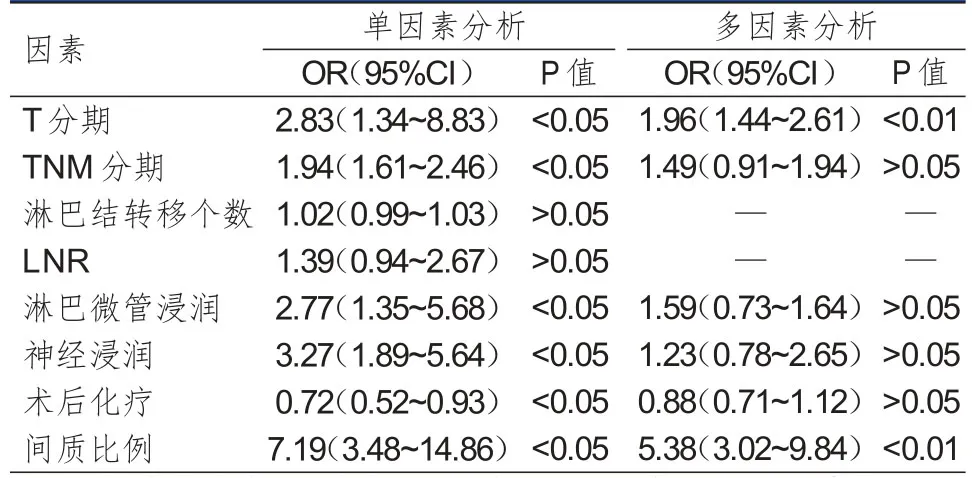
表2 胃癌患者总生存率影响因素的分析(n =216)
2.4 胃癌患者无进展生存率影响因素的分析
单因素分析结果显示,T分期、TNM分期、淋巴结转移个数、LNR、淋巴微管浸润、神经浸润、术后化疗、间质比例与胃癌患者的无进展生存率有关。多因素分析结果显示,T分期为T3~T4期(OR=1.23,P<0.05)和多间质(OR=10.24,P<0.01)是影响胃癌患者无进展生存率的危险因素。(表3)
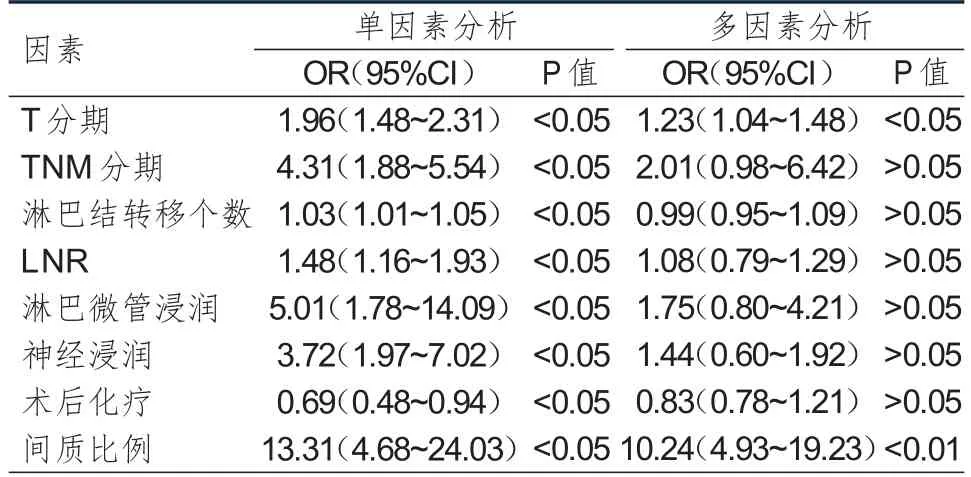
表3 胃癌患者无进展生存率影响因素的分析(n= 216)
3 讨论
Wu等[12]对转录组测序结果进行荟萃分析,证实了胃癌组织间质相关基因的高表达与胃癌患者的病理学恶化征象和TNM分期有关,并且间质比例较低患者的总生存率优于间质比例较高的患者,但该研究未阐述间质比例对胃癌患者无进展生存率的影响,且未对相关危险因素进行探讨。Mesker等[13]研究提示,多间质(TSR≤1)结肠癌患者的预后较差。越来越多的研究关注TSR是否能作为预测不同恶性肿瘤患者预后的有效指标。本研究以TSR=1为截点,将TSR≤1的胃癌患者归为多间质患者,而TSR>1的胃癌患者归为少间质患者。亚组分析结果显示,少间质和多间质患者的年龄、性别、肿瘤直径、手术方式、TNM分期和术后化疗情况比较,差异均无统计学意义(P>0.05)。与少间质患者相比,多间质患者T3~T4期的比例较高,N2~N3期的比例较高,淋巴结转移个数较多,LNR值较高,神经浸润和淋巴微管浸润的比例较高。生存分析结果显示,多间质患者的5年总生存率为25.9%,明显低于少间质患者的81.5%,差异有统计学意义(P<0.01);多间质患者的5年无进展生存率为19.2%,明显低于少间质患者的72.8%,差异有统计学意义(P<0.01)。多因素分析结果显示,T分期为T3~T4期和多间质是影响胃癌患者生存率和无进展生存率的危险因素(P<0.05)。以上研究结果初步证实了TSR对胃癌患者远期预后的预测价值。
肿瘤组织由肿瘤细胞和从正常组织中募集的间质细胞及间质成分等组成。正常组织的微环境能够作为一种屏障而限制肿瘤细胞的早期增殖和侵袭。但在恶性肿瘤的微环境中,间质可促进肿瘤的恶性进展[14]。但肿瘤微环境中的间质对肿瘤进展促进作用的病理机制尚未完全清楚,可能与产生细胞外基质的成纤维细胞的增多、微血管的增加、炎性细胞和淋巴微管系统的浸润有关[15]。有研究提出,肿瘤相关成纤维细胞(cancer-associated fi broblast,CAF)通过旁分泌在肿瘤细胞的增殖和侵袭中发挥了主要作用[16]。CAF可分泌多种生长因子,如转化生长因子-β(transforming grow th factor-β,TGF-β)、间质细胞衍生因子1和血管内皮生长因子(vascular endothelial grow th factor,VEGF)等,还能够分泌细胞因子,促进血管生成,从而加速肿瘤增殖[17]。CAF还能够调节抗肿瘤免疫反应,在肿瘤的发生、发展和耐药性方面发挥重要作用,成为肿瘤高度恶性潜能和不良预后的重要影响因素[18-19]。
研究表明,大多数胃癌患者即使接受根治性切除术,其局部复发率仍高达60%,而局部复发患者的中位生存时间仅为10.4个月[20]。本研究探讨了TSR与胃癌患者无进展生存率的关系,结果显示,多间质是影响胃癌患者无进展生存率的独立危险因素(P<0.01)。采用TSR评估恶性肿瘤患者预后的优势在于其具有高度可重复性和便捷性,临床医师无需在专业组织病理学软件的辅助下即可对患者的肿瘤-间质成分进行评估[21]。因此认为TSR可有效地应用于胃癌根治术后的预后分层评估中,有助于指导临床医师制订术后辅助治疗方案。此外,由于肿瘤微环境中的间质成分具有促进肿瘤血管生成的作用,因此认为TSR可作为评估胃癌患者抗血管生成治疗效果的有效标志物[22]。
综上所述,TSR是胃癌患者根治性切除术后远期预后的独立影响因素,可为术后辅助治疗方案的制订提供重要依据。

