黄芩甙对慢性脑低灌注大鼠认知功能及其对海马内LC-3Ⅱ和Beclin-1表达的影响
陈玉静 陈文强 张建新 刘 妍 吴犀翎 王建东 黄小波*
(1.首都医科大学宣武医院中医科,北京市中西医结合老年疾病研究所,北京 100053; 2.山东省夏津县人民医院内科,山东德州 253200 )
阿尔茨海默病(Alzheimer’s disease,AD)与血管性痴呆(vascular dementia,VD)是老年期认知功能损害的两个主要临床类型。慢性脑低灌注是AD与VD共有的重要病理学基础[1],近年研究[2]表明,自噬作为细胞受到刺激后,通过溶酶体途径完成自身代谢和细胞器更新的重要方式,与β-淀粉样蛋白 (amyloid β-protein, Aβ)的聚集和AD的发病密切相关。中药黄芩为唇形科植物黄芩的根,味苦,性寒,具有清热燥湿、泻火解毒、止血安胎的功效。黄芩甙是从黄芩的根茎中分离纯化得到的一种黄酮类单体化合物,也是黄芩的主要有效成分,黄芩甙具有多种生物活性和功效,如抗炎、抗氧化、镇静、神经保护、抗凋亡、增强机体免疫力以及抑菌作用等[3-4]。本研究通过观察黄芩甙对慢性脑低灌注(chronic cerebral hypoperfusion,CCH)大鼠模型认知障碍的改善作用及其对自噬通路的影响,为开发治疗血管性认知功能损害的有效中药提供研究基础。
1 材料与方法
1.1 材料
1.1.1 动物
清洁级健康雄性Sprague-Dawley(SD)大鼠50只,体质量(250±20)g,购自北京维通利华实验动物中心(合格证号:SCXK京2007-0001)。
1.1.2 药品及主要试剂
黄芩甙(浓度>95%)购自美国Sigma公司,LC-3Ⅱ和Beclin-1抗体购自美国Millipore公司。
1.2 实验方法
1.2.1 动物模型制备、分组及给药
SD大鼠按照随机数字表法分为对照组、模型组和黄芩甙低、中、高3个剂量组,每组各10只。
慢性脑低灌注大鼠模型的建立:参考文献方法[5],SD大鼠自购回后适应性饲养1周,术前禁食,以1.5%(质量分数)戊巴比妥钠腹腔注射麻醉,颈部备皮,常规碘伏消毒,颈部正中纵向切口,暴露气管及胸锁乳突肌,小心轻柔分离一侧颈总动脉与周围组织、迷走神经等,避免拉扯,手术缝线进行血管上下端结扎后离断血管,缝合肌肉、筋膜及皮肤后肌注青霉素抗感染。7 d后,结扎对侧。对照组仅分离双侧颈总动脉,不进行结扎与离断,保证其他操作相同。术后l周起给予对照组、模型组大鼠腹腔注射等渗0.9%(质量分数)氯化钠注射液,治疗组使用黄芩甙分别按照60、120、240 mg·kg-1·d-1的剂量进行腹腔注射,共4周。
1.2.2 Morris水迷宫行为学测试
参照Morris水迷宫法进行定向航行实验和空间探索实验[6],历时6 d。定向航行实验评估空间学习能力,空间探索实验评估空间记忆能力。在1~5 d进行定向航行实验,即每日将大鼠在同一象限入水点靠池壁放入水中,记录120 s内大鼠从入水到爬上对角线象限的站台所需时间和路线,即逃避潜伏期以及搜索距离,每只大鼠训练2次/d。第6天进行空间探索实验,即撤去站台,将大鼠从原入水点放入水池,记录120 s内大鼠在原站台象限游泳的时间。
1.2.3 Western blotting检测LC-3Ⅱ和Beclin-1表达
大鼠断头后于冰上取脑,用冷PBS漂洗残余血后,分离海马,提取蛋白质,定量,用蛋白酶抑制剂将各样品调整成等体积含相同蛋白浓度的样品,配制15%(质量分数)分离胶,4%(质量分数)的浓缩胶, 30 μg蛋白的样品上样,100 V电压电泳75 min,97 V电压PVDF膜转膜90 min,室温下封闭1 h,LC-3 Ⅱ(1∶1 000)和Beclin-1(1∶1 000)4 ℃ 过夜,TBST洗5 min×3次,二抗(1∶5 000)室温下1 h,TBST洗5 min×3次,进行化学发光反应、曝光、拍照,分析目标带的相对分子质量和吸光度值。
1.3 统计学方法
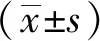
2 结果
2.1 黄芩甙对大鼠学习记忆能力的影响
2.1.1 定位航行实验
记录大鼠搜索并找到逃避平台的逃避潜伏期及搜索距离,结果详见表1和表2。在测试的5 d内所有大鼠的潜伏期都呈现下降趋势。自第2天起,模型组较对照组逃避潜伏期明显延长(P<0.01),搜索距离增加(P<0.01),差异有统计学意义,显示由于慢性脑低灌注而导致学习记忆功能下降。黄芩甙干预组自第3天起,逃避潜伏期和搜索距离均较模型组缩短(P<0.05,P<0.01)差异有统计学意义,其中以中、高剂量组更为显著。
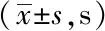
表1 定向航行实验中各组平均逃避潜伏期比较Tab.1 Comparison of the average escape latency in place navigation test
**P<0.01vscontrol group;△P<0.05,△△P<0.01vsmodel group
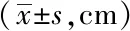
表2 定向航行实验中各组游泳距离比较Tab.2 Comparison of the swimming distance in place navigation test
**P<0.01vscontrol group;△P<0.05,△△P<0.01vsmodel group
2.1.2 空间探索实验
观察撤台后大鼠在原平台所在象限停留时间,结果详见表3。与对照组相比,模型组大鼠在原平台所在象限搜索时间缩短(P<0.01),黄芩甙各剂量组大鼠在原平台所在象限搜索时间均较模型组延长 (P<0.05,P<0.01),差异有统计学意义。空间探索实验的测试结果表明,黄芩甙在一定程度上可以缓解记忆功能损伤。
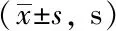
表3 各组空间探索实验比较Tab.3 Results of spatial probe test
**P<0.01vscontrol group;△△P<0.01vsmodel group
2.2 黄芩甙对大鼠海马LC-3Ⅱ、Beclin-1表达的影响
模型组中LC-3Ⅱ和Beclin-1表达较对照组升高,差异有统计学意义(P<0.01)。黄芩甙干预后海马内LC-3Ⅱ和Beclin-1表达低于模型组,差异有统计学意义(P<0.05,P<0.01)。详见图1,表4。
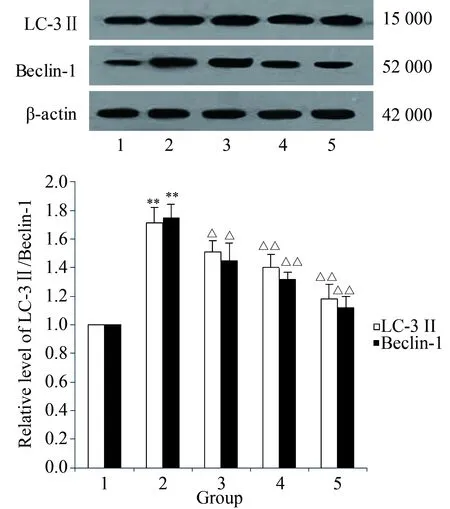
图1 Western blotting检测各组海马LC-3Ⅱ和Beclin-1蛋白表达Fig.1 Western blotting expression of LC-3Ⅱ and Beclin-1
**P<0.01vscontrol group;△P<0.05,△△P<0.01vsmodel group;1:control group;2: model group;3: low-dose baicalin group;4: medium-dose baicalin group;5: high-dose baicalin group.

表4 黄芩甙对大鼠海马LC-3Ⅱ、Beclin-1表达的影响Tab.4 Effects of baicalin on expression of LC-3Ⅱ and Beclin-1 in hippocampal of rats
3 讨论
随着生活水平的提高、生活方式的改变以及老龄人口的增多,痴呆与认知功能损害的发病率有增高的趋势。AD与VD是老年期认知功能损害的两个主要临床类型,近年来大量研究[7-8]显示,AD和VD患者的影像学都表现出脑组织低灌注。慢性脑低灌注是一种常见的临床病理现象,见于多种脑血管疾病的病理发生过程中,实验研究[9-10]也显示慢性脑低灌注可导致多种神经递质的失衡,使脑组织发生神经炎性反应、氧化应激,破坏血脑脊液屏障,造成免疫损伤,并且使脑组织处于隐性能量代谢障碍状况,造成树突形态和密度的变化,进而导致认知功能下降。海马是脑内缺血性损伤的最敏感区域,慢性脑低灌注可能通过多方面来影响海马的学习和记忆过程,导致认知功能障碍的发生和发展。
自噬是细胞利用溶酶体降解自身受损的细胞器和错误折叠的蛋白质等有害大分子物质的重要途径。正常老化伴随着自噬小泡聚集及自噬功能的障碍[11],在此过程中,Beclin-1启动自噬小体[12],LC3B参与了自噬形成及成熟过程[13]。LC3-Ⅰ经剪切、脂化、与磷脂酰乙醇胺结合,形成LC3B-Ⅱ[14]。自噬泡的形成以LC3B-Ⅱ从膜的外表面释放为标志,LC3B-Ⅱ表达增加通常被认为是自噬泡形成增加、自噬活性增加的证据[15]。自噬本身具有两面性,一方面自噬可以清除胞内有害和过剩的细胞器以及病原体,另一方面自噬的过度激活可以导致细胞的程序性凋亡,从而引起一系列疾病过程[16]。有研究[17]显示,自噬参与了慢性脑低灌注的发生,并且在认知功能减退之前脑内自噬系统就已经发生改变。有文献[17-18]显示慢性脑低灌注发生4周时,LC-3Ⅱ和Beclin-1表达增加,并且自噬泡中富含淀粉样前体蛋白、Aβ及γ-分泌酶,诱导自噬可引起Aβ增多,因此自噬泡被认为是Aβ产生的场所。随着低灌注时间的延长,自噬持续激活且降解能力持续下降,即使脑血流部分恢复,慢性脑低灌注导致的海马神经元损伤却持续加重。
本研究显示慢性脑低灌注模型组LC-3Ⅱ和Beclin-1的表达增多,说明慢性脑低灌注激活了体内自噬系统,造成海马神经元损伤;黄芩甙干预组,自噬标志蛋白 LC-3Ⅱ和Beclin-1表达量明显降低,表明黄芩甙可抑制自噬的表达,进而保护了海马神经元。
近年来研究[19]显示黄芩甙可直接作用于中枢神经系统的神经元细胞,对出血性、缺血性脑损伤以及中枢神经系统感染性脑损伤具有广泛的保护作用,此外,黄芩甙能够促进AD模型大鼠内源性神经干细胞的增生和分化[20],在神经免疫方面,黄芩甙通过抑制胶质细胞的激活和促进肿瘤坏死因子-α和重组人白介素-6的表达,缓解Aβ1-42带来的病理损害[21]。本研究应用Morris水迷宫试验进行学习、记忆能力的测试,观察各组大鼠的认知功能状况。结果显示,与对照组相比,模型组大鼠的逃避潜伏期明显延长、跨越平台的次数明显减少(P<0.01),提示慢性脑低灌注大鼠的学习、记忆能力明显降低。而黄芩甙干预组大鼠的逃避潜伏期、穿越平台次数明显多于模型组(P<0.05,P<0.01),提示用黄芩甙干预能明显改善慢性脑低灌注大鼠的学习、记忆能力,猜测也许与其抑制自噬相关蛋白的表达有关。
综上所述,黄芩甙能够缩短慢性脑低灌注模型组大鼠找到平台的游泳路径,降低海马神经元自噬标志蛋白 LC-3Ⅱ和Beclin-1的表达,从而对慢性脑低灌注模型学习记忆起到改善作用,是否有其他因素参与了黄芩甙改善认知障碍的过程,尚需更深层次的研究。

