通过渗透微泵稳定抑制小鼠血浆CD26/DPPIV分子酶活性的研究
薛兴奎 韩新华 蔡思齐 陈晓玲 Melody Y. Zeng
(1.深圳市龙华区人民医院中心实验室,广东深圳 518109;2.深圳市南山区蛇口人民医院内分泌科,广东深圳 518109;3.南方医科大学研究生院检验技术系,广州 501505)
CD26/DPPIV是多功能蛋白分子,在T细胞、上皮细胞等组织细胞上均有表达,在体内有两种存在形式:细胞表面分子和可溶性分子。可溶性分子广泛存在于血清/血浆、关节液等体液中[1]。CD26/DPPIV具有丝氨酸蛋白酶活性,能够特异性切割N-末端的脯氨酸或丙氨酸,不但对于增强细胞对刺激信号的反应起着重要作用,而且在关节炎等疾病中也发挥重要的调控作用。CD26分子作为T细胞的协同刺激因子,参与多种免疫学效应。西他列汀(Sitagliptin)是一种高效CD26/DPPIV抑制剂,能够特异性抑制DPPIV蛋白酶活性。利用西他列汀长久而稳定的抑制DPPIV酶活性,对于研究CD26/DPPIV分子功能,探索其在多种疾病中的发病机制,具有重要的意义。研究[2]显示,小鼠和人体体内DPPIV活性难以得到稳定而持续的抑制,常规给药方法导致CD26/DPPIV酶活性呈波动状态,影响实验的稳定性与重复性。微渗透泵是一种较为理想的持续给药系统,本课题组拟采用渗透泵体内植入给药,研究小鼠体内西他列汀给药效果,探索稳定持久的DPPIV酶活性抑制方式。
1 材料与方法
1.1 实验动物及主要材料
SPF级 BL6/C57 雄性小鼠,8~12周龄,体质量18~22g,由中国科学院广州生物医药与健康研究院实验动物中心提供,实验动物许可证号:SYXK(粤)2015-0063。西他列汀购于美国Selleck Chemical公司。微渗透泵(Model:2001)由美国Alzet公司生产。将实验小鼠分为西他列汀皮下注射200、100、50 mg/kg组和渗透泵植入(内含200 mg/kg西他列汀)组,渗透泵植入[内含0.9%(质量分数)氯化钠注射液]组,每组小鼠数量为6只,实验至少重复2次,各组小鼠分别于给药后1、2、4、8、16、24 h采血。
1.2 渗透泵植入
按照微量渗透泵说明书和参考文献[3]进行手术植入渗透泵,在无菌工作台内腹腔麻醉小鼠后,在小鼠后颈部作一个长约1.5 cm横切口,植入灌注西他列汀(200 mg/kg剂量西他列汀)或0.9%(质量分数)氯化钠注射液(对照组)的Alzet微渗透泵并无菌缝合,渗透泵保留皮下24 h。
1.3 血浆药物浓度与DPPIV蛋白酶活性监测
按照给药后不同时间点,从小鼠尾静脉取血,室温离心后取血浆。西他列汀血药浓度采用高效液相串联质谱仪(美国Thermo Fisher公司)检测,氟西汀作为内标参照。DPPIV 蛋白酶活性监测采用美国ENZO Life Science公司试剂盒方法,用二甲基亚砜(DMSO)及DPPIV 缓冲液溶解底物GlyPro-pNA,取缓冲液、血清样本及底物置于96孔平底培养板中,在37 ℃中反应30 min,在多功能酶标仪(美国Biotek公司)上分别读出A405值。取500 mmol/L的纯pNA倍比稀释后读出相应的A405值作标准曲线,计算DPPIV蛋白酶活性相对于对照组的标准值。
1.4 流式细胞术检测小鼠脾T细胞CD26分子
将给药后24 h的小鼠处死后,采用无菌操作法取脾脏,并制成细胞悬液,采用抗体磁珠法纯化T细胞(德国Miltenyi公司)。用FACS缓冲液洗涤,洗涤后分成每管细胞为1×106个,分别加入同型对照、PE-CD26(美国BD公司)各10 μL抗体,室温避光15 min,缓冲液洗涤2次,采用流式细胞仪(美国BD公司)上机分析,数据应用Flow Jo软件分析。
1.5 小鼠T细胞迁移实验
T细胞迁移实验采用Transwell培养系统的24孔板检测,经注射不同浓度西他列汀的小鼠脾T细胞置于膜上的小室,膜下的小室加入含有基质细胞来源因子1α(storma cell derived factor 1α,SDF-1α)的无血清培养基AIM-V,在37 ℃孵箱孵育4 h后,计数穿越薄膜的细胞。结果采用相对于对照组细胞数目的百分比表示。
1.6 病理切片观察小鼠皮肤
将处死小鼠皮肤组织渗透泵周边皮肤约0.5 cm取下,固定于10%(体积分数)甲醛内,纵向和横向切取,按常规制备石蜡切片,切片厚度为5 μm,苏木精-伊红(HE)染色,用 Olympus显微镜观察并照相。
1.7 统计学方法
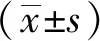
2 结果
2.1 西他列汀血药浓度
为研究不同给药方法对血药浓度的影响,分别给予小鼠西他列汀不同剂量直接皮下注射或皮下微泵组植入小鼠皮下,微泵组西他列汀血药浓度变化趋势与皮下注射组相比,差异有统计学意义(P<0.05),药物剂量比皮下注射稳定。直接皮下注射西他列汀在6~8 h血药浓度明显下降,在给药后24 h无法检测到,而通过渗透泵给药组血药浓度可维持至24 h(图1)。
2.2 西他列汀抑制小鼠体内DPPIV蛋白酶活性
通过DPPIV活性检测,发现给药8 h后,在皮下注射用药组中,小鼠血清中的DPPIV酶活性与基线比较,差异无统计学意义(P>0.05)。经皮下渗透泵给药组(200 mg/kg)中,小鼠血浆中DPPIV酶活性明显降低且能持续24 h,与0.9%(质量分数)氯化钠注射液对照组相比,差异有统计学意义(P<0.05),详见图2。

图1 血药浓度-时间曲线Fig.1 Plasm concentration-time curve in the mice

图2 西他列汀抑制血浆CD26/DPPIV活性Fig.2 CD26/DPPIV enzyme inhibited by Sitagliptin
2.3 西他列汀对小鼠脾T细胞CD26/DPPIV分子表达和T细胞迁移的影响
收集注射西他列汀24 h后的小鼠脾T细胞,采用流式细胞检测CD26/DPPIV分子的表达,与对照组相比,CD26分子的表达无明显变化,西他列汀不影响细胞表面CD26/DPPIV分子的表达(图3A)。为了研究CD26分子在T细胞迁移中的作用,收集注射西他列汀24 h后的小鼠脾细胞,采用抗体磁珠法纯化后,检测T细胞的趋化迁移能力。经渗透泵给药处理的T细胞迁移数量与对照组相比,减少了36.01%(P<0.05,图3B)。
2.4 小鼠耐受性良好
渗透泵经手术植入到小鼠皮下,长约1.5 cm,对小鼠是一种额外的负担。在本实验中,植入渗透泵小鼠的活动度与饮食无明显异常。在小鼠骨髓移植等器官移植模型中,皮肤损害是常见的移植物抗宿主病表现,如果微泵对皮肤造成损伤将影响实验结果。为观察西他列汀通过渗透泵给药能否引起皮肤损伤,处死植入渗透泵24 h的小鼠后取泵旁皮肤制作病理切片,行HE染色,观察小鼠皮肤病理变化。西他列汀药物组小鼠与0.9%(质量分数)氯化钠注射液小鼠相比,大致正常,无明显炎性反应(图4)。
3 讨论
CD26/DPPIV分子是参与T细胞信号传导过程中的一种具有丝氨酸蛋白酶活性的糖蛋白分子,在T细胞活化后表达增高,同时参与多种疾病的发病机制。CD26相对分子质量为110 000,能够特异性切割N-末端的脯氨酸或丙氨酸[4],广泛存在于血清/血浆、脑脊液、关节液中;跨膜蛋白分子在众多组织中都有表达,如骨髓、血管内皮细胞、肺、脾、胰、肝、肠道和多种上皮细胞[5]。数种关键细胞因子和趋化因子都是CD26分子蛋白酶的底物,包括RANTES、CCL11、巨噬细胞来源的趋化因子(CCL22)、CXCL10等[6]。西他列汀是CD26分子的特异性抑制剂,能够抑制CD26分子的蛋白酶活性。鉴于DPPIV在血浆等各种体液中存在,起着多种不同的作用,因此成为免疫、器官移植、内分泌等多学科研究人员的研究靶点[7]。特异性抑制剂西他列汀成为研究CD26/DPPIV分子功能与体内作用的重要工具。在前期体外研究中发现,西他列汀能够在较低剂量情况下抑制血浆中DPPIV酶活性。而在小鼠体内,DPPIV分子酶活性由于受复杂的体内环境影响,很难得到稳定而完全的抑制。Farag等[8]在药代动力学临床试验中发现,人体西他列汀血药浓度与血浆中DPPIV浓度相关,DPPIV酶活性在2 h左右达到最大抑制,随后6~10 h内恢复至接近正常。Waget等[9]报道,每只400 μg西他列汀不能明显的抑制小鼠体内血浆DPPIV活性。这些研究[8-10]结果提示,稳定而持久的血浆浓度是西他列汀有效抑制DPPIV酶活性的前提条件。

图3 小鼠脾T细胞CD26表达与迁移Fig.3 CD26 expression and migration on spleen T cells
A:CD26 expression;B:migrated T cells.*P<0.05vssaline control group; The spleen T cells were harvested 24 hours post treatment and were assayed for migration.
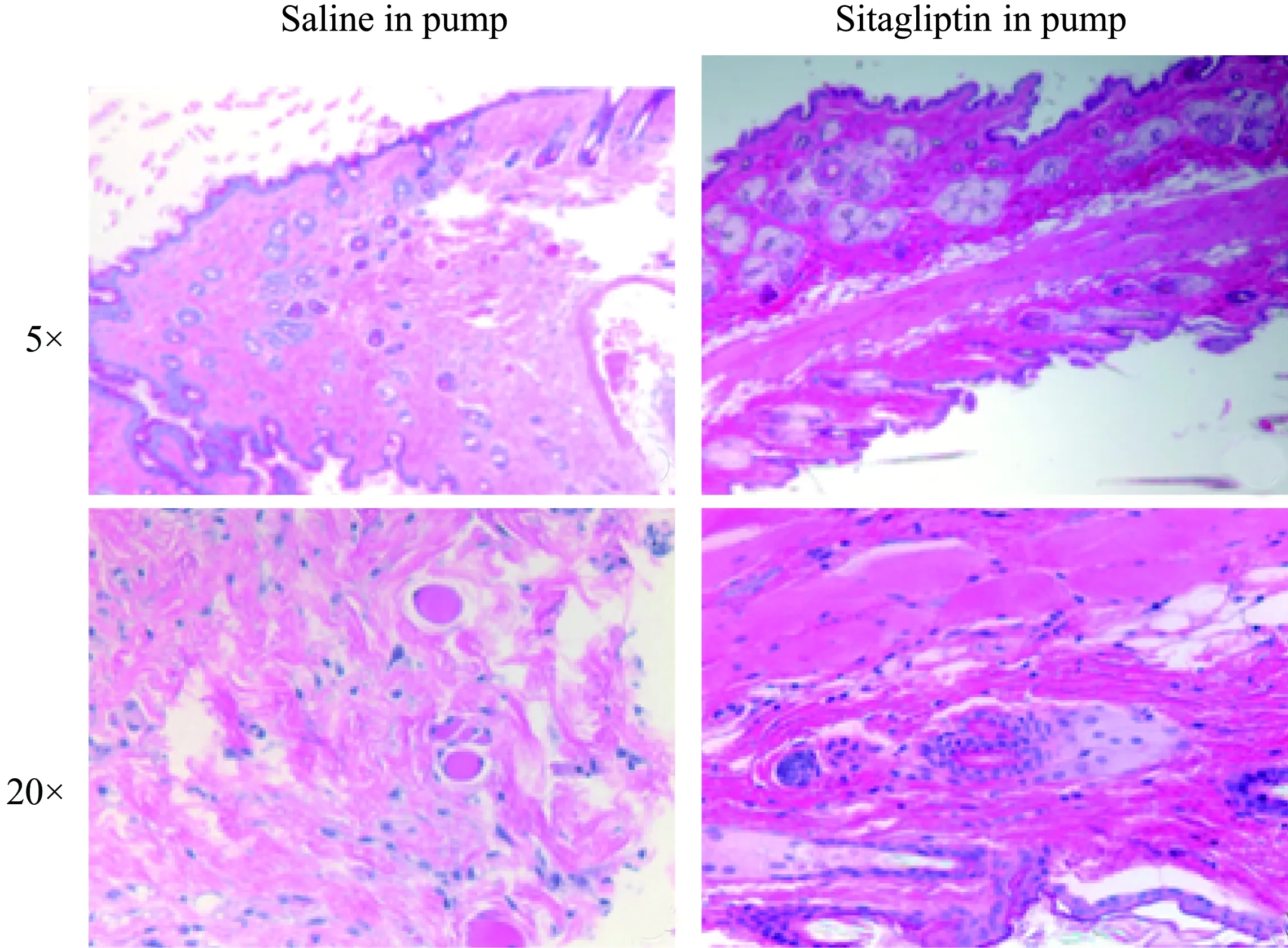
图4 小鼠皮肤的病理形态学检测Fig.4 Pathological morphology of mice skin
为了获得理想稳定的血药浓度,本研究选用了ALZET皮下渗透泵,结果显示与一次性皮下注射相比,接受渗透泵药物治疗组血药浓度相对稳定,在给药后24 h仍有较高的血药浓度,而无渗透泵组在给药后24 h无法检测到西他列汀。同时,渗透泵组小鼠血浆CD26/DPPIV酶活性被稳定持久的抑制,而一次注射组DPPIV活性在给药后第2小时降低,但在给药后第8小时检测发现接近正常值。这些结果说明,DPPIV活性可以通过渗透泵给药得到稳定而持久的抑制,同时避免了每天多次注射的繁琐。但是并非所有的小分子化合物都适合使用渗透泵,结果会根据药物的体内分布模式、代谢途径的不同而具有明显差异[10]。
CD26分子及其具有的蛋白酶活性是调节T细胞活化与执行免疫功能的重要分子,对于增强细胞刺激信号的反应起着重要作用,在关节炎、心力衰竭、Crohns肠病等疾病中起着重要的调控作用。DPPIV分子酶活性与小鼠免疫功能密切相关,通过多种途径参与免疫细胞激活、活化、增生等。采用渗透泵给予西他列汀药物小鼠组的脾T细胞迁移能力受到明显的抑制,而一次性给药组无明显变化,提示通过渗透泵给药是体内研究DPPIV对免疫功能影响可以更好地模拟稳态环境。与不同浓度的一次性给药组相比,渗透泵给药组的小鼠脾T细胞CD26分子表达无明显变化。这些提示西他列汀是通过抑制DPPIV蛋白酶活性而不是影响T细胞CD26分子表达而影响T细胞迁移。
渗透泵需要皮下植入,对于小鼠是一种额外的负荷,通过对小鼠活动度、饮食的监测与观察,渗透泵给予西他列汀没有明显降低小鼠的活跃度。在骨髓、肝肾等器官移植小鼠模型中,渗透泵需要长期植入[11-12]。由于渗透泵是皮下植入,本研究提取了植入渗透泵附近的小鼠皮肤进行病理切片检查,发现皮肤无明显异常,提示通过渗透泵给予西他列汀对皮肤无明显刺激和损害,可以用于小鼠移植物抗宿主病等研究模型。
在本实验研究中,为了获得稳定的DPPIV酶活性抑制,研究了皮下渗透泵作为西他列汀的给药方式,发现通过渗透泵给药可以提高血药浓度,持续抑制小鼠体内DPPIV活性,并且有效的长时间抑制T细胞迁移,对小鼠体质量和皮肤无明显影响。这些结果显示,采用渗透泵给予西他列汀,可在动物体内更好的控制酶活性,对于研究CD26分子的功能与相关效果体内研究提供了有效的给药途径。

