清肝化瘀颗粒的急性毒性试验研究
邓茹芸 ,曹 建 ,魏润杰 ,姚树坤 ,,,4⋆
(1.北京中医药大学,北京 100029;2.北京航空航天大学 生物与医学工程学院,北京 100191;3.北京大学医学部中日友好临床医学院,北京 100029;4.中日友好医院 消化内科,北京 100029)
原发性肝癌全球每年新发病例高达60万人,其中超过50%发生于中国,确诊时多为晚期[1,2]。相关研究发现,中药辩证治疗晚期原发性肝癌患者可以显著减轻临床症状和体征[3]。中国2017版《原发性肝癌诊疗规范》指出中医药治疗是肝癌治疗的重要辅助手段[4]。清肝化瘀颗粒,由黄芩、苦参、白术、莪术等中药组成,该处方是姚树坤教授根据其三十余年临床经验创制的治疗原发性肝癌的有效经验方,该方具有清热解毒,健脾祛湿,活血化瘀,软坚消癥等功效。前期临床相关应用表明清肝化瘀方能够提高患者免疫功能,延长生存期,改善生活质量,可应用于大多数原发性肝癌的患者,具有极高的开发研究价值。目前清肝化瘀颗粒正在进行新药研发,本次试验进行急性毒性试验为临床用药的安全性提供参考依据。
1 材料与方法
1.1 实验材料
实验动物为80只ICR小鼠,SPF级,体重18~21g,雌雄各半,购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2016-0011。
清肝化瘀颗粒(批号:20170731)由中日友好医院药学部提供。以下描述中,“干膏粉”指的是本供试品提取物,每克提取物相当于4.472g生药,“生药”是根据此含量计算得到的生药量。
1.2 实验方法
1.2.1 剂量设置
本品为中药复方,由黄芩、苦参等组成,本试验设置 7个剂量:0.15、0.20、0.27、0.36、0.48、0.65、0.86药粉/ml,给药体积:40ml/kg[6]。剂量设置依据:前期预试验表明,清肝化瘀颗粒(批号同正式供试品),以浓度 0.718、0.431、0.259、0.155、0.093g 干膏粉/ml一次性灌胃给予小鼠后,前2个剂量组有3 只(3/10)、2 只(2/10)雄性动物于给药后 24h 内死亡;后3个剂量组未出现死亡,最低剂量组未见肉眼可见的不良反应。
正式供试品预配制结果显示,清肝化瘀颗粒干膏粉可配制的最高浓度为0.86g干膏粉/ml。因此,本次正式试验进行小鼠半数致死量试验,最高剂量设定为0.86g干膏粉/ml,然后0.75倍间距向下设定6个剂量[5,6],至低于未出现不良反应浓度剂量,6.0g干膏粉/kg。
1.2.2 动物分组
适应期结束后,小鼠禁食约15h,称禁食体重,采用分层随机法,根据此体重分层对纳入试验的80只动物按性别分别进行分组。参考 “SOPTQ035实验动物的随机分组”。80只ICR小鼠采用随机分为8组:对照组(灌胃给予等体积实验动物饮用水)和上述7个剂量的给药组。
1.2.3 给药方法
经口灌胃给药,根据前期药效学相关研究,清肝化瘀给药组给予相应浓度的药液,对照组给予等体积实验动物饮用水,40ml/kg/次,给药1次,于称禁食体重分组后立即给予。
1.3 观察与检测
1.3.1 毒性症状、一般状态观察与剖检结果
给药后,密切观察1h内动物毒性反应,给药当日上下午均进行观察。之后每天1次观察动物,记录动物的一般状况、毛色、活动、步态、神态、大便、尿液等。观察有无中毒症状发生,及发生的时间和持续时间、恢复情况,记录死亡或濒死动物。
1.3.2 体重
给药后第 1 天(D1)、第 2 天(D2)、第 3 天(D3)、第 5 天(D5)、第 8 天(D8)、第 11 天(D11)、第14天(D14)称量动物未禁食体重。
1.3.3 摄食量
给药后(D0)即恢复供食,每笼加定量饲料(200g/笼),与上述体重称量的同时称剩余饲料,每次称剩余饲料后继续定量添加饲料(200g/笼)。计算每笼饲料消耗量,除以每笼动物数,即得该笼平均摄食量(g饲料/鼠日)。
给药当天(D0)给药后定量添加饲料。给药后D1、D2、D3、D5、D8、D11 称剩余饲料量后定量添加饲料。给药后D14称剩余饲料后不再定量添加饲料。
1.4 统计学方法
应用SPSS13.0统计学软件进行统计学分析。动物半数致死量(LD50)采用Bliss法计算,probit程序进行检验;采用单因素方差分析(ANOVA),组间比较方差齐性采用LSD检验,方差不齐时选用 Tamhane’s T2 检验。
2 结果
2.1 小鼠死亡率和不良反应
清肝化瘀颗粒以 26.8、35.8、48.3、64.4、85.9、116.3、153.8g生药/kg,40ml/kg给药体积,一次性经口给予小鼠,可观察到的主要毒性反应为急性死亡。上述剂量给药当日、D1、D2-14的动物死亡情况见表1。剂量组4~7在给药后1h陆续有动物出现死亡,发生在用药后1h~24h内,其中剂量组6的死亡高峰发生在给药后1~2h,其余各组的死亡高峰在给药后4~24h内。采用Bliss法计算得出LD50为69.94g生药/kg(相当于临床剂量的104倍),95%可信限为63.50~81.03g生药/kg。结果见表1所示。
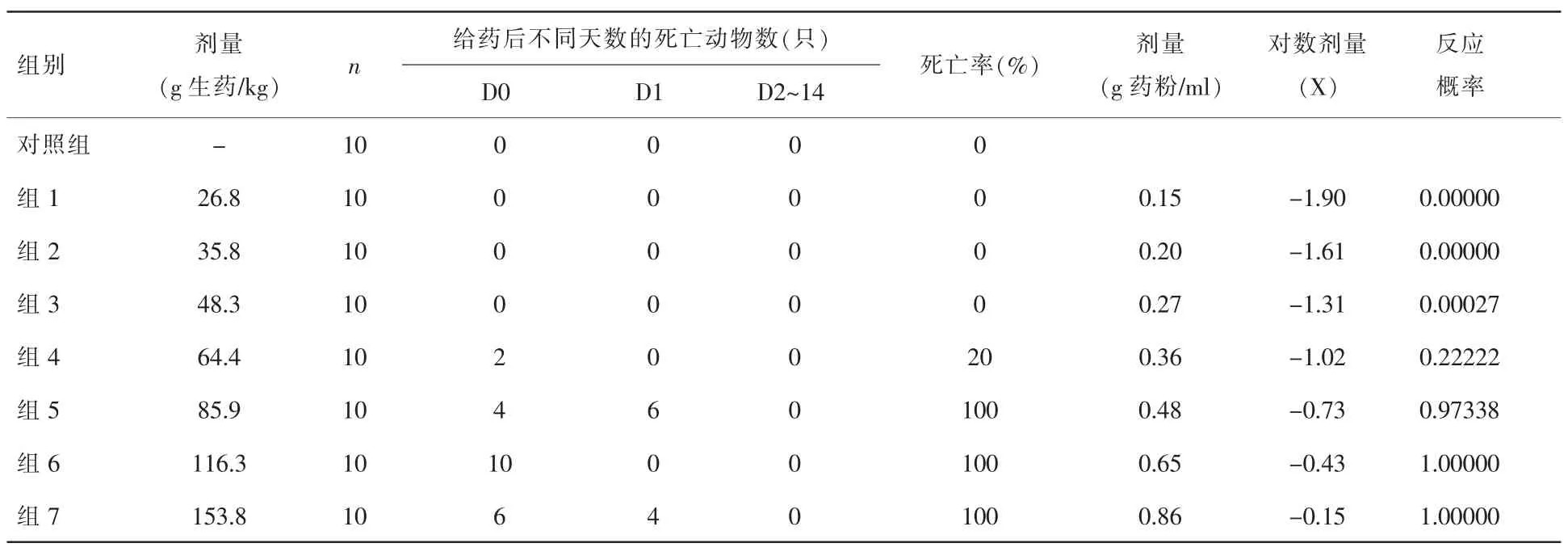
表1 清肝化瘀颗粒急性毒性试验动物死亡情况

表2 清肝化瘀颗粒急性毒性试验不良反应情况
除急性死亡外,其它肉眼可见的不良反应主要表现为腹泻、静卧、步态不稳、翻正反射消失伴肢体僵直;剂量组2、3的小鼠表现为腹泻和/或静卧,发生率分别为30%和40%,约在给药后20~30min发生,在给药后5h内恢复;剂量组4有7只动物出现腹泻和/或静卧的不良反应,发生在给药后30min~2h,除有2只动物在给药后24h内恢复外,其余动物在给药后5h内恢复;5~7剂量组除有腹泻和/或静卧的不良反应外,且出现步态不稳和/或翻正反射消失伴肢体僵直症状,发生在给药后30min~5h内,剂量组5、7虽分别有2只和1只动物的腹泻在给药后4h内恢复,但上述3个剂量组的所有动物均在24h内死亡;剂量组1未出现上述肉眼可见的不良反应。剂量组1~7的不良反应发生率分别为0%、30%、40%、70%、100%、100%和100%;此后直至观察期14d结束,存活动物的一般情况、活动、步态、呼吸、进食、饮水、二便、皮毛等均未见异常见。结果见表2所示。
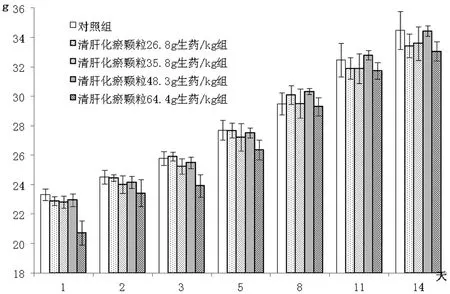
图1 清肝化瘀颗粒急性毒性实验——雄性动物平均体重变化
图2 清肝化瘀颗粒急性毒性实验——雌性动物平均体重变化
2.2 对小鼠体重和摄食量的影响
与对照组相比,给药后14d内,清肝化瘀颗粒雄性动物64.4g生药/kg剂量组在给药后D1~14体重均较对照组偏低,其中D1体重较对照组明显降低(P<0.01),其余各时间点未见明显的统计学差异;雄性动物的其它剂量组和雌性动物各剂量组在各时间点与对照组体重基本相当,与对照组比较均未见明显的统计学差异。各组平均体重见图1、2。
与对照组比较,清肝化瘀颗粒雄性动物64.4g生药/kg剂量组于给药后D1摄食量较对照组降幅明显,约为对照组的52%,D2后摄食量已与对照组基本接近;雄性动物的其它剂量组和雌性动物各剂量组在各时间点与对照组摄食量基本相当。
2.3 大体解剖观察
14d观察期结束,解剖后肉眼观察,动物胸、腹腔未见渗液、出血和粘连,心、肝、脾、肺、肾、肾上腺、胃肠、膀胱、睾丸、附睾等均未见充血、瘀血、出血、渗液、粘连、糜烂、溃疡等肉眼可见的病变。
3 讨论
中药具有调整机体状态,增强免疫功能,减少手术副反应,控制肿瘤发展,改善症状,提高生活质量,延长“带瘤生存”期的;所以研究有效的肝癌中成药具有长远的积极意义。清肝化瘀颗粒是姚树坤教授集多年经验形成的治疗肝癌的有效经验方。本课题组前期动物实验和细胞实验明确了清肝化瘀方的主要有效组分是:氧化苦参碱类、黄芩苷类、莪术醇类;其有效成分在各类肿瘤中均具有具有明确的抗肿瘤、抑制细胞增殖的作用[7~10]。本研究将为临床用药的安全性提供参考。
3.1 不良反应
本实验得出,清肝化瘀颗粒最大无毒反应剂量为26.8g生药/kg(相当于成人临床推荐剂量的40倍)。26.8g生药/kg剂量组未出现任何肉眼可见不良反应;35.8、48.3g生药/kg剂量组毒性反应轻微,发生率分别为30%和40%;64.4g生药/kg剂量组毒性反应较大,不良反应发生率为70%;85.9g生药/kg及以上剂量组,毒性反应剧烈全部致死。除死亡动物出现步态不稳以及翻正反射消失伴僵直等不良反应外,其余不良反应均为腹泻和/或静卧,且在5h内恢复。除最大剂量组外,其余各组给药后摄食量及体重无明显变化,观察期结束后,存活动物解剖后未见明显病变。可见,清肝化瘀颗粒正常剂量临床应用,在不良反应方面可能具有较为明显的优势。
3.2 安全性
本实验表明,过量清肝化瘀颗粒主要毒性反应为急性死亡。实验得出LD50为69.94g生药/kg(相当于成人临床推荐剂量的104倍),95%可信限为63.50~81.03g生药/kg,最大无致死剂量为48.3g生药/kg(相当于成人临床推荐剂量的72倍)。观察期14d结束,存活动物的一般情况、活动、步态、呼吸、进食、饮水、二便、皮毛等均未见异常;因此,清肝化瘀颗粒常规剂量应用,安全性可能较高。
本次试验只观察了动物解剖后可见病变,没有进行血液和组织分析。下一步,课题组将结合临床实践,深入分析清肝化瘀颗粒毒性反应机理,为其临床研究奠定基础。

