3-蒈烯对铜绿假单胞菌的抑菌活性及机理初探
刘雪 何英兰 胡月英 陈卫军 陈海明


摘 要 为了开发一种新的食品防腐保鲜剂,本文初步研究了3-蒈烯对铜绿假单胞菌的抑菌活性及机理。通过肉汤稀释法测定最小抑菌浓度(MIC)和最小杀菌浓度(MBC),评价了3-蒈烯的抑菌活性,考察了3-蒈烯对细菌生长曲线、细胞形态、细胞膜通透性、膜电位及呼吸链脱氢酶等的影响。结果表明:3-蒈烯对铜绿假单胞菌的MIC为20 mL/L,MBC为40 mL/L。3-蒈烯可以抑制铜绿假单胞菌的生长,破坏细胞的正常形态,提高细胞膜的通透性,造成蛋白质、电解质的外泄。3-蒈烯能够降低铜绿假单胞菌菌体的膜电位,干扰细胞正常代谢活动,还能抑制细胞内呼吸链脱氢酶的活性。综上所述,3-蒈烯通过破坏铜绿假单胞菌细胞膜,抑制细菌正常生长,导致细菌细胞死亡。
关键词 3-蒈烯;铜绿假单胞菌;抑菌活性;抑菌机理;细胞膜
中图分类号 TS205.9 文献标识码 A
近年来,随着社会的发展和生活水平的提高,食品安全开始受到人们广泛的关注。食源性疾病是中国食品安全的头号问题,也是世界重要的公共卫生问题,致病微生物的污染是造成食源性疾病的主要原因[1-2]。铜绿假单胞菌,又名绿脓杆菌,食源性致病菌之一,革兰氏阴性属,主要存在于肉制品和饮用水中,能产生外毒素、肠毒素等,容易造成食品腐败污染,危害人们身体健康,很多城市已经对其开展监测[3]。
目前,为了减少食源性疾病的发生,延长食品货架期,防腐剂被广泛使用。精油作为一种植物源天然防腐剂,可以从多种芳香植物中提取,主要由萜类、倍半萜类化合物等组成[4]。已有大量报道证明,精油具有良好的抑菌活性,但是具体是哪种成分主要发挥作用,还鲜有研究[5-6]。
3-蒈烯是许多植物精油的主要挥发性成分,包括松节油、胡椒油、当归油等。分子式为C10H16,是一种单萜烯,呈无色液体状态[7]。由于3-蒈烯本身的松木样香气,在食用香精中有广泛应用,《食品安全国家标准 食品添加剂使用标准》(GB 2760-2014)中规定3-蒈烯为允许使用的食品用合成香料[8]。此外,3-蒈烯可用于农药、药物和化妆品,还是增塑剂等化学品中重要的原料之一[7]。吴桂苹等[9]通过气相色谱-质谱法(GC-MS)测得白胡椒精油中3-蒈烯的含量在21.94%~24.64%之间。Lomarat等[10]研究表明δ-3-蒈烯是黑胡椒油的主要成分(30.75%)。Zhang等[11]研究发现黑胡椒精油对肉中的致病菌——大肠杆菌具有明显的抑制效果。
目前,有关3-蒈烯对铜绿假单胞菌的抑菌机理的探讨鲜有报道。本研究主要通过测定3-蒈烯的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)确定抑菌活性,通过铜绿假单胞菌扫描电镜观察和生长曲线、电导率、蛋白泄漏等指标的测定, 初步分析3-蒈烯的抑菌机理,为3-蒈烯应用于食品的防腐保鲜提供理论依据。
1 材料与方法
1.1 材料
铜绿假单胞菌(ATCC 9027),广东省微生物菌种保藏中心。
(+)-3-蒈烯(>90.0%),日本东京化成工业株式会社(TCI);无菌磷酸盐缓冲液(PBS,浓度为0.1、0.01 mol/L,pH 7.4)、2,3,5-氯化三苯基四氮唑(TTC)、牛肉膏、蛋白胨,北京索莱宝科技有限公司;罗丹明123,上海源叶生物科技有限公司;碱性磷酸酶(AKP)测试盒,南京建成生物工程研究所。
无菌超净工作台,苏州佳寶净化工程设备有限公司;高压灭菌锅,致微(厦门)仪器有限公司;SPX型生化培养箱,宁波江南仪器厂;SHA-2型恒温振荡器,常州澳华仪器有限公司;TGL-16M型高速冷冻离心机,上海卢湘仪离心机仪器有限公司; 5804R型台式高速冷冻离心机,德国Eppendorf公司;S-3000型扫描式电子显微镜,日本日立(Hitachi)工机有限公司;DDS-307型电导率仪,上海仪电科学仪器股份有限公司;TU1810型分光光度计,北京普析通用仪器有限责任公司;F-280型荧光分光光度计,天津港东科技发展股份有限公司。
1.2 方法
1.2.1 菌种活化 将铜绿假单胞菌在营养琼脂培养基中置于37 ℃培养箱培养18~24 h进行传代恢复活性,培养后的细菌用无菌生理盐水(0.9% NaCl)将其从斜面上洗脱下来,采用麦氏比浊法把菌悬液的浓度进行稀释。
1.2.2 最小抑菌浓度(MIC)和最小杀菌剂浓度(MBC)的测定 参照Huang等 [12]的方法做适当调整,将3-蒈烯溶于70 %乙醇中,稀释成800、400、200、100、50、25 mL/L的抑制液,在平板中先加入1 mL抑制液,再倒入降温至50 ℃左右的营养肉汁培养基19 mL,混合均匀,使其终浓度为40、20、10、5、2.5、1.25 mL/L。待培养基凝固之后,在每个平板中加入200 μL浓度为107~108 CFU/mL的供试菌悬液,用涂布棒涂布均匀。空白对照和阴性对照分别为无菌水和70%乙醇,平板倒置培养,于24 h后进行观察,3-蒈烯的最小抑菌浓度(MIC)为完全不长菌的最小稀释浓度。然后,将浓度大于或等于MIC的平板在37 ℃下再培养24 h。仍然没有可见细菌生长的浓度定义为最小杀菌剂浓度(MBC)[13]。
1.2.3 细菌生长的测定 采用干重法[14],按照1 %(V/V)的接种量将稀释至106~107 CFU/mL的铜绿假单胞菌菌悬液接种到液体培养基中,在37 ℃、150 r/min振荡培养12 h后,加入3-蒈烯使其终浓度为MIC、MBC,取样间隔为1 h,取出的菌液在 8000 r/min离心10 min,弃上层液体,下层菌体用无菌水重悬洗涤,将菌体置于80 ℃下烘干至恒重,测得菌体干重。对照组为无菌水。
1.2.4 扫描电镜(SEM)观察 为了观察铜绿假单胞菌的形态变化,参照Tang等[15]的方法对供试菌进行SEM观察。铜绿假单胞菌培养至对数期,分别加入3-蒈烯使其终浓度为MIC、MBC,空白对照和阴性对照分别为无菌水和70 %乙醇,在培养4 h和8 h后将菌悬液取出,6000 r/min离心10 min收集菌体。菌体先用0.1 mol/L的PBS缓冲液洗涤3次,再依次用20%、40%、60%、80%的乙醇溶液进行梯度脱水,最后用无水乙醇进行洗脱。样品置于20 ℃预冻,再于真空冷冻干燥器中干燥12 h。取出干燥完全的菌体、上样、通过阴极喷涂将菌体金覆盖,在扫描电子显微镜上观察铜绿假单胞菌的细胞形态。
1.2.5 菌液电导率的测定 参照张新虎等[16]的方法并做一些改动,铜绿假单胞菌培养至对数期,用无菌PBS缓冲液 (0.1 mol/L)洗涤3次并重悬,分别加入3-蒈烯使其终浓度为MIC、MBC,70 %乙醇作为对照组,电导率测量时间间隔为15 min,连续3 h。
1.2.6 蛋白质泄漏的测定 采用考马斯亮蓝法测定。铜绿假单胞菌培养至对数期,在菌悬液加入MIC、MBC浓度的3-蒈烯溶液,无菌水作为空白对照组。分别在加入3-蒈烯的第0、2、4、6、8、10、12 h取出菌悬液,將菌悬液置于离心机中4000 r/min离心10 min。在上清液中加入5 mL配置好的考马斯亮蓝试剂,混匀静置5 min后在595 nm下测量其吸光度。
1.2.7 碱性磷酸酶的测定 参照肖香[17]等的方法并做一些改动,铜绿假单胞菌培养至对数期,在菌悬液中加入MIC、MBC浓度的3-蒈烯溶液,无菌水作为空白对照组。分别在加入抑菌物质的0、2、4、6、8 h取出菌悬液,4000 r/min 离心 10 min,按照试剂盒说明书测定上清液中碱性磷酸酶(AKP)的含量。
1.2.8 膜电位的测定 采用罗丹明123荧光染色法[18]。铜绿假单胞菌在液体培养基培养 24 h,将菌液浓度调整为106~107 CFU/mL。加入3-蒈烯使其终浓度为MIC、MBC,无菌水作为空白对照组,于37 ℃、150 r/min 振荡培养 3 h后,离心弃上清,再用PBS(0.01 mol/L )洗涤。罗丹明123溶解在PBS缓冲液(0.01 mol/L)中得到浓度为1 mg/mL的母液,加入菌液中使其终浓度为2 ?g/mL,在黑暗中孵育30 min。将菌液用PBS缓冲液(0.01 mol/L)充分洗净,重悬。使用荧光分光光度计在480和530 nm的激发和发射波长处使用荧光分光光度计测定平均荧光强度,狭缝宽度设置为10 nm, 数据用平均荧光强度(MFI)表示。
1.2.9 呼吸链脱氢酶的测定 参照陶文卿[19]的方法并做一些改动,铜绿假单胞菌培养至对数末期,取1 mL菌悬液加入试管中,然后依次加入 Tris-HCl缓冲液(0.05 mol/L,pH 8.6)2 mL、0.1 mol/L葡萄糖溶液2 mL和1 mg/mL的TTC溶液2 mL并摇匀。加入3-蒈烯使其终浓度为MIC、MBC,无菌水作为空白对照组,将试管置于37 ℃培养箱中孵育5 h后,在各试管中滴加2滴浓H2SO4终止反应,然后分别加入5 mL正丁醇萃取,使产物完全进入上层,静置分层后取上层液体4000 r/min离心10 min,以正丁醇作为参照在490 nm处测量其吸光度。
1.3 数据处理
所有实验重复3次,数据采用DPS软件的单因素方差分析进行差异显著性分析(p<0.05),并使用 Origin 9.0软件绘图。
2 结果与分析
2.1 最小抑菌浓度和最小杀菌浓度
3-蒈烯对铜绿假单胞菌具有抑菌作用,且抑菌作用较强。实验结果表明,最小抑菌浓度(MIC)为20 mL/L,最小杀菌浓度(MBC)为40 mL/L,为MIC的2倍。空白对照和阴性对照组24 h后均观察到有菌生长,说明无法抑制铜绿假单胞菌。
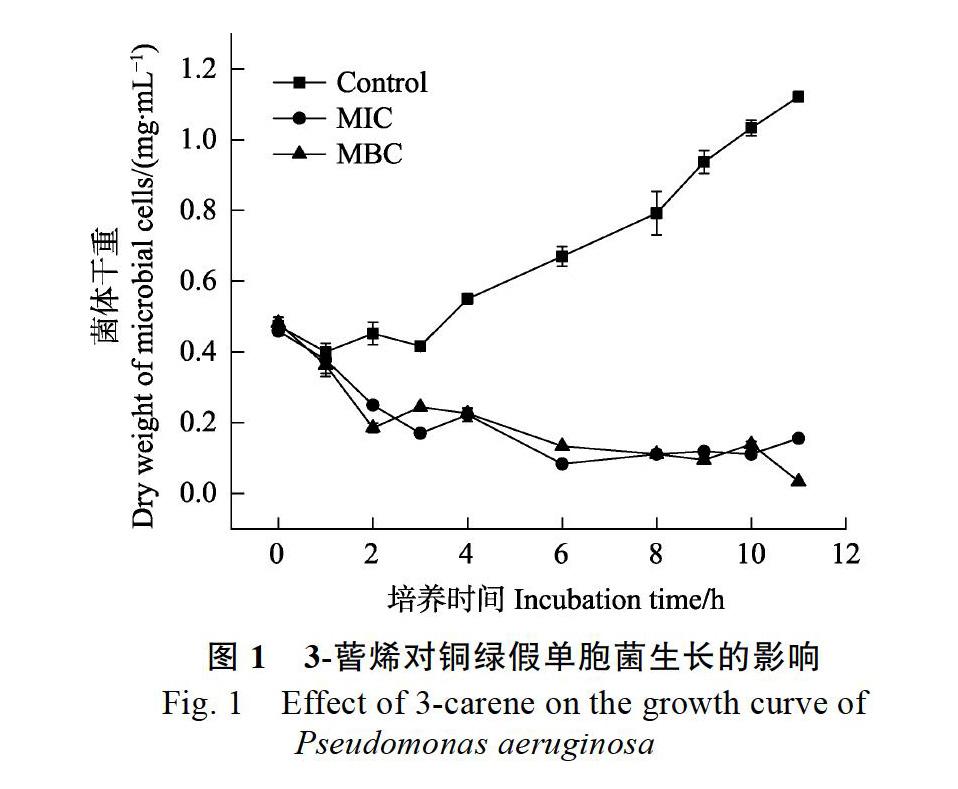
2.2 3-蒈烯对铜绿假单胞菌生长的影响
在研究3-蒈烯抑菌活性的基础上,测定了铜绿假单胞菌的生长曲线。由图1可知,3-蒈烯对铜绿假单胞菌生长的影响。随着培养时间的延长,对照组细菌持续生长、增殖,细菌的干重总体呈上升趋势,从(0.470.02)mg/mL增长至(1.120.01)mg/mL。当加入终浓度为MIC和MBC的3-蒈烯后,铜绿假单胞菌的生长曲线发生显著变化,菌体干重在前2 h内发生明显下降,之后下降速度趋缓。生长曲线可以部分反映细菌在一定的生长环境中生长繁殖的规律。结果表明,3-蒈烯对铜绿假单胞菌的生长存在较好的抑制效果,能够减缓甚至完全阻止细胞增殖。
2.3 3-蒈烯对铜绿假单胞菌形态的影响
3-蒈烯对铜绿假单胞菌的形态影响如图2所示。由图2A1、图2A2可知,空白对照组的铜绿假单胞菌菌体细胞结构完整,表面光滑,大小分布均匀。根据图2B1和图2B2,经乙醇处理4 h和8 h后,铜绿假单胞菌的形态没有明显变化,表明乙醇对细菌形态没有影响。相比之下,使用3-蒈烯处理的铜绿假单胞菌发生明显的形态学损伤。如图2C1、图2D1,在加入浓度为MIC和MBC的3-蒈烯培养4 h后,部分细胞变短、断裂,细胞发生堆叠、粘附现象。3-蒈烯处理8 h后,细胞发生明显变化,其形态受到严重破坏。大部分细胞发生弯曲、凹陷、畸形,细胞破裂(图2C2、图2D2)。此外,添加MBC的3-蒈烯的细菌损伤更严重,更多的细胞发生堆积和粘附,失去其原有形态。该结果与蛋白质泄漏的测试结果一致。
扫描电镜结果可以直接反映细胞膜的形态学和超微结构变化[20]。有研究表明,精油可以影响细胞的结构,主要是其中的抑菌成分能够穿透细胞壁并破坏细胞膜[21]。在本研究中,铜绿假单胞菌的形态学改变可能是由于3-蒈烯对细胞膜完整性和通透性的影响,这将导致细菌细胞膜的不稳定以及细胞膜和壁的分离,随后造成细胞内部物质如蛋白的外泄。本研究结果表明,3-蒈烯改变了铜绿假单胞菌的正常形态,破坏了细胞膜结构,抑制了细菌生长,最终造成细菌死亡。
2.4 3-蒈烯对铜绿假单胞菌电导率的影响
3-蒈烯对铜绿假单胞菌电导率的影响如图3所示,未添加抑菌物质的对照组先上升,后期保持平稳并略有增加,这是因为细菌的正常裂解和死亡。用3-蒈烯(MIC和MBC)处理后,电导率均高于对照组,在前100 min电导率快速增加,总体呈上升趋势,MIC组的电导率从(1514.008.19)?s/cm 上升到(1629.506.36)?s/cm,MBC组的电导率从(1520.6716.80)?s/cm 上升到(1706.007.21)?s/cm。而且,MBC组的电导率显著高于MIC组。
细胞膜是细菌的保护屏障也是渗透屏障,用于小离子如K+,Na+和Mg2+的通过[22]。维持离子稳态在很多方面有重要作用,如溶质运输、代谢调控等。当细菌处在含有抑菌物质的环境中,细胞膜被破坏,带电离子泄漏到膜外,膜外环境的电导率增加,细胞膜通透性改变,对细胞代谢产生有害影响并导致细胞死亡[23]。实验结果表明3-蒈烯能够影响细胞膜的完整性,增加膜通透性并导致膜损伤。李婷等[24]的研究也证明姜厚朴水提物处理后可以提高大肠杆菌和金黄色葡萄球菌的渗透性。
2.5 3-蒈烯对铜绿假单胞菌蛋白释放的影响
3-蒈烯对铜绿假单胞菌蛋白质释放的影响如图4所示。用MBC和MIC浓度处理的铜绿假单胞菌上清液中的蛋白质浓度均显著高于对照组(p<0.05)。从0 h到12 h,对照组的蛋白浓度从(0.0480.001)mg/mL变为(0.0730.002)mg/mL,略有提高,MIC组的蛋白质浓度从(0.052 0.003)mg/mL 大幅增加至(0.232 0.022)mg/mL,MBC组的蛋白浓度从(0.044 0.003)mg/mL大幅增加至(0.1970.019)mg/mL。在6 h,MBC组的蛋白浓度达到最大,为MIC组的1.18倍。
蛋白质作为一种大分子物质,存在于细胞内部,是细胞关键的结构组件。蛋白质的泄漏可以反映细胞膜完整性的损伤情况[25]。本研究结果显示3-蒈烯破坏了铜绿假单胞菌的细胞膜结构,引起蛋白泄漏,对细胞膜完整性造成了不可逆的损伤,和扫描电镜结果相呼应。
2.6 3-蒈烯对铜绿假单胞菌胞外碱性磷酸酶含量的影响
3-蒈烯对铜绿假单胞菌胞外碱性磷酸酶含量的影响如图5所示。细胞壁位于细胞表面,具有保护细胞、保持细胞形状、选择性运输大分子物质的功能。碱性磷酸酶(AKP)是一种非特异性磷酸单酯酶,作为胞内酶存在于细胞壁和细胞膜之间,在正常情况下不会向外渗透。当细胞壁被破坏,细胞壁完整性受损后,碱性磷酸酶会大量外泄到胞外环境中[26]。因此,细胞壁完整性的变化情况可以通过测定胞外碱性磷酸酶含量的变化来反映。
由图5可知,随着培养时间的延长,对照组和处理组的碱性磷酸酶含量都有小幅度增加,但都保持在较低水平。在2 h,MBC组和MIC组的碱性磷酸酶含量显著高于对照组(p<0.05)。4 h之后,3组的碱性磷酸酶含量接近。结果表明,3-蒈烯对铜绿假单胞菌细胞壁的完整性影响较小,细胞壁破坏不严重。这与肖香等的研究结果类似,发现大蒜提取物-茶多酚复合物对3种腐败菌的细胞壁完整性影响较弱[17]。
2.7 3-蒈烯对铜绿假单胞菌膜电位的影响
图6表明,3-蒈烯对铜绿假单胞菌膜电位(MP)有显著影响。未添加3-蒈烯的对照组的平均荧光强度是(522.1513.03)AU,添加3-蒈烯至终浓度为MIC和MBC后,荧光强度分别急剧下降至(319.4110.10)AU和(211.7717.72)AU,跟对照组比较,分别减少了38.19%和59.44%, 差异极显著(p<0.01)。而且,MBC组和MIC组相比平均荧光强度也发生了显著降低,降幅为34.38%。说明随着3-蒈烯浓度增加,平均荧光强度呈下降趋势。
膜电位是指细胞膜内部和外部之间的电位差。维持正常的膜电位对于ATP的产生和保持细胞功能有重要意义[27]。罗丹明123作为染料,可以通过跨膜电位进入细胞基质,膜电位的大小可以通过其荧光强度表示。正常情况下,膜内的电压通常低于膜外,膜电位的降低意味着细胞膜的去极化,去极化会导致细胞代谢异常,影响ATP的产生。3-蒈烯的加入导致膜电位降低,引起细胞膜去极化,导致细胞代谢活性异常和细菌死亡。
2.8 3-蒈烯对铜绿假单胞菌呼吸链脱氢酶活性的影响
3-蒈烯对铜绿假单胞菌呼吸链脱氢酶活性的影响如图7所示,对照组在490 nm处的吸光值为0.3970.029。随着3-蒈烯浓度的提高,铜绿假单胞菌在490 nm处的吸光值显著下降。当添加MIC和MBC的3-蒈烯时,吸光值分别下降至0.0920.006和0.0580.003,分别比对照组下降76.46%和85.32%。而且,MIC组的吸光值与MBC組相比下降了37.63%。表明490 nm处的吸光值随着3-蒈烯浓度的增加而降低。
呼吸链身为细胞的能量来源,对于真核生物,存在于线粒体中,对于原核生物如细菌,存在于细胞膜中。2,3,5-氯化三苯基四氮唑(TTC)作为一种小分子无色物质,能够透过细胞膜,被呼吸链脱氢酶作用还原成红色的三苯甲酰(TF),该物质在490 nm处有最大吸收峰[28]。因此,可通过观察490 nm处吸光度的变化来研究铜绿假单胞菌呼吸链脱氢酶的活性。结果表明,3-蒈烯能够抑制铜绿假单胞菌呼吸链脱氢酶的活性,该抑制作用随着3-蒈烯浓度的提高更加明显。这说明,3-蒈烯可以通过破坏呼吸链的方式抑制铜绿假单胞菌的生长,进而杀死细菌。
3 讨论
本文初步探究了3-蒈烯对铜绿假单胞菌的抑菌活性及机理,表明3-蒈烯对铜绿假单胞菌有较好的抗菌活性,MIC和MBC分别为20和40 mL/L。张闻扬等[29]研究发现大叶桉叶挥发油的主要成分为3-蒈烯,该挥发油对常见致病菌包括沙门氏菌、绿脓杆菌和痢疾杆菌有良好的抑制作用。生长曲线实验表明,加入3-蒈烯后,铜绿假单胞菌的生长受到了抑制。由扫描电镜图片可知,铜绿假单胞菌原有的正常细胞形态发生改变。蛋白质和电解质的外泄表明3-蒈烯可能会损坏原有的细胞膜结构,破坏细胞膜的完整性,增加细胞膜的通透性,导致细胞内大分子物质向外泄漏。王芳等[30]报道,肉桂精油可以造成成团泛菌和腐生葡萄球菌细胞内容物的泄漏,破坏细胞膜完整性。加入3-蒈烯后,细菌的膜电位(MP)降低,可能使细胞发生去极化现象,引发不规则的代谢活动。与本研究结果类似,有研究发现黑胡椒精油可以导致大肠杆菌的细胞膜发生去极化现象[11]。此外,呼吸链脱氢酶活性下降,说明3-蒈烯可能对呼吸链造成损伤。这些变化最终导致细胞走向死亡。
本研究为进一步探索3-蒈烯对铜绿假单胞菌的抗菌机理奠定了基础,也为开发3-蒈烯为食品防腐保鲜剂提供了可能。
参考文献
王博涵. 基于食源性疾病的食品安全监控问题研究[J]. 中国卫生产业, 2012, 9(11): 106.
袁 蒲, 杨 丽, 李 杉, 等. 我国食源性疾病监测研究现状与管理建议[J]. 中国卫生产业, 2018, 15(6): 136-137.
蔡双福, 张 琴, 黄耀雄. 食品中铜绿假单胞菌的监测分析[J]. 中国卫生检验杂志, 2015, 25(6): 875-876.
Tajkarimi M M, Ibrahim S A, Cliver D O. Antimicrobial herb and spice compounds in food[J]. Food Control, 2010, 21(9): 1199-1218.
Calo J R, Crandall P G, OBryan C A, et al. Essential oils as antimicrobials in food systems – A review[J]. Food Control, 2015, 54:111-119.
Jayasena D D, Jo C. Essential oils as potential antimicrobial agents in meat and meat products: A review[J]. Trends in Food Science & Technology, 2013, 34(2): 96-108.
何丽芝, 王 婧, 赵振东, 等. 3-蒈烯资源及其生物活性应用研究进展[J]. 林产化学与工业, 2011, 31(3): 122-126.
何丽芝. 3-蒈烯的制备、氢化及蒈烷溴化-酯化反应探索研究[D]. 北京: 中国林业科学研究院, 2011: 2.
吴桂苹, 谷风林, 房一明, 等. 白胡椒加工过程中的风味物质分析[J]. 农学学报, 2017, 7(11): 51-61.
Lomarat P, Sripha K, Phanthong P, et al. In vitro biological activities of black pepper essential oil and its major components relevant to the prevention of Alzheimers disease[J]. Thai Journal of Pharmaceutical Sciences, 2015, 39(3): 94-101.
Zhang J, Ye K P, Zhang X, et al. Antibacterial activity and mechanism of action of black pepper essential oil on meat-borne Escherichia coli[J]. Frontiers in Microbiology, 2017, 7: 2094.
Huang J, Qian C, Xu H, et al. Antibacterial activity of Artemisia asiatica essential oil against some common respiratory infection causing bacterial strains and its mechanism of action in Haemophilus influenzae[J]. Microbial Pathogenesis, 2018, 114: 470-475.
楊鹏斌, 于 新. 绿色木霉菌发酵液对金黄色葡萄球菌的抑制作用[J]. 食品科学, 2012, 33(19): 25-28.
谢 丽, 孙瑞珠, 马玉龙. 应用电导率仪测定微生物生物量的研究[J]. 安徽农业科学, 2011, 39(31): 19048-19050.
Tang H, Chen W, Dou Z M, et al. Antimicrobial effect of black pepper petroleum ether extract for the morphology of Listeria monocytogenes and Salmonella typhimurium[J]. Journal of Food Science and Technology, 2017, 54(7): 2067-2076.
张新虎, 何 静, 沈慧敏. 苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探[J]. 草业学报, 2008, 17(3): 99-104.
肖 香, 王 瑶, 姜 松, 等. 大蒜乙醇提取物对几种腐败菌的抑制作用[J]. 现代食品科技, 2013, 29(12): 2894-2900.
Zhang Y, Liu X, Wang Y, et al. Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J]. Food Control, 2016, 59: 282-289.
陶文卿. 10-HDA对大肠杆菌抑制机理的研究[D]. 济南: 山东轻工业学院, 2012: 31.
Wang Y, Zhang Y, Shi Y Q, et al. Antibacterial effects of cinnamon (Cinnamomum zeylanicum) bark essential oil on Porphyromonas gingivalis[J]. Microbial Pathogenesis, 2018, 116: 26-32.
Bajpai V K, Alreza S M, Ungkyu C, et al. Chemical composition, antibacterial and antioxidant activities of leaf essential oil and extracts of Metasequioa glyptostroboides Miki ex Hu[J]. Food and Chemical Toxicology, 2009, 47(8): 1876-1883.
Sean Cox, Cindy Mann, Julie Markham, et al. Determining the antimicrobial actions of tea tree oil[J]. Molecules, 2001, 6(2): 87-91.
Stoddart A, Hertz M I, David M, et al. Determination of antibacterial mode of action of Allium sativum essential oil againstfoodborne pathogens using membrane permeability and surface characteristic parameters[J]. Journal of Food Safety, 2013, 33(2): 197-208.
李 婷, 楊舒然, 陈 敏, 等. 姜厚朴水提物对大肠杆菌和金黄色葡萄球菌的抑菌机理研究[J]. 现代食品科技, 2016, 32(2): 84-92.
Bajpai V K, Sharma A, Baek K H. Antibacterial mode of action of Cudrania tricuspidata fruit essential oil, affecting membrane permeability and surface characteristics of food-borne pathogens[J]. Food Control, 2013, 32(2): 582-590.
师 伟. 榛花中抑制金黄色葡萄球菌化合物的筛选及抑菌机制研究[D]. 大连: 辽宁师范大学, 2011: 14.
Xu C, Li J, Yang L, et al. Antibacterial activity and a membrane damage mechanism of Lachnum YM30 melanin aga inst Vibrio parahaemolyticus and Staphylococcus aureus[J]. Food Control, 2017, 73: 1445-1451.
Richter A K, Frossard E, Brunner I. Polyphenols in the woody roots of Norway spruce and European beech reduce TTC[J]. Tree Physiology, 2007, 27(1): 155-160.
张闻扬, 郑燕菲, 袁子娇, 等. 季节对大叶桉和柠檬桉叶挥发油化学成分的影响及抑菌性研究[J]. 应用化工, 2015, 44(11): 2123-2127.
王 芳, 曹锦轩, 潘道东, 等. 肉桂精油对成团泛菌和腐生葡萄球菌的抑菌活性及其机理[J]. 食品工业科技, 2016, 37(19): 75-80.