大青叶粗黄酮提取及其抗氧化性研究
刘富康 杨剑寒 曲映红

摘要[目的]优化大青叶粗黄酮的提取工艺,并考察其抗氧化活性。[方法]以70%乙醇溶液浸提干燥的大青叶,用分光光度法测定提取液中的粗黄酮含量。在单因素试验的基础上,通过正交试验优化大青叶粗黄酮的提取工艺。测定大青叶粗黄酮对DPPH自由基和羟自由基的清除能力。[结果]大青叶粗黄酮的最佳提取条件为提取时间120 min、提取温度80 ℃、料液比1∶25(g/mL)。大青叶粗黄酮对于DPPH自由基和羟自由基的清除能力均大于芦丁,小于VC。[结论]大青叶粗黄酮是一种良好的天然抗氧化剂,值得进一步开发利用。
关键词大青叶;黄酮;提取工艺;抗氧化性
中图分类号R284.2文献标识码A
文章编号0517-6611(2019)02-0150-03
doi:10.3969/j.issn.0517-6611.2019.02.045
大青叶是十字花科植物菘蓝(Isatis indigotica Fort.)的干燥叶片。菘蓝的根入药即为人们俗称的“板蓝根”。大青叶味苦,性寒,具有清热解毒、抗菌抗病毒、增强肌体免疫力等功效[1-2]。有资料显示,大青叶的黄酮类提取物具有一定的抗氧化作用[3-4]。笔者拟研究大青叶粗黄酮提取物对DPPH自由基和羟自由基的清除能力,以期为开发绿色安全的天然抗氧化剂提供一定的理论依据。
1材料与方法
1.1材料与仪器大青叶由江西君岭生物科技公司提供。
试剂:乙醇、DPPH(1,1-二苯基-2-三硝基苯肼)、芦丁、抗坏血酸、氢氧化钠、亚硝酸钠、硝酸铝、硫酸亚铁、水杨酸等,所用试剂均为分析纯。
仪器:AL204电子天平[梅特勒-托利多仪器(上海)有限公司];LLJ-306Z粉碎机(江门市贝尔斯顿电器有限公司);KQ5200E超声波清洗器(昆山市超声仪器有限公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);LGJ-10冷冻干燥机(北京松源华兴科技发展有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);752N分光光度计(上海仪电分析仪器有限公司)。
1.2方法
1.2.1粗黄酮含量测定方法。参照王芳等[5]和LONDOO 等[6]的方法,并做些许改动。准确称取40 mg芦丁,用70%乙醇溶解,定容至50 mL容量瓶中。取5个25 mL比色管,分别加入0、1.0、2.0、3.0、4.0、5.0 mL芦丁溶液,各管中加入70%乙醇溶液3.0 mL和5%亚硝酸钠溶液0.5 mL,混合均匀后放置6 min,加10%硝酸铝溶液0.5 mL,混匀后放置6 min,再加5%氢氧化钠溶液 4.0 mL,混匀后放置15 min,用80%乙醇定容,以未加芦丁溶液的1管作为空白对照,在波长510 nm 处测定吸光度。以芦丁浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。精确称取5 g粉碎并烘干的大青叶,70%乙醇超声浸提,5 000 r/min离心5 min,将上清液旋转蒸发去除溶剂后,转移至100 mL容量瓶中用70%乙醇定容,得到大青叶粗黄酮提取液,按制作标准曲线的方法测定其吸光度,根据标准曲线方程计算粗黄酮得率。
1.2.2
大青叶粗黄酮提取工艺优化。通过单因素试验分别考察提取温度(50、60、70、80 ℃)、提取时间(30、60、90、120 min)、料液比(1∶10、1∶15、1∶20、1∶25 g/mL)3个因素对大青叶提取物中粗黄酮得率的影响。
在单因素试验的基础上,采用L9(33)正交试验,以大青叶提取物中粗黄酮的得率为考察指标,对提取温度、提取时間和料液比3个影响因素进行综合考察,进一步优化大青叶中粗黄酮的提取工艺条件。正交试验设计如表1所示。
1.2.3
大青叶提取物对DPPH自由基清除率的测定。 按“1.2.2”中正交试验获得的最佳提取工艺进行浸提,将离心后的上清液减压蒸发除去溶剂后,转移至100 mL容量瓶中用70%乙醇定容,根据得到的提取液中黄酮浓度,量取包含10 mg粗黄酮含量的提取液于50 mL容量瓶中,使用70%浓度的乙醇将其定容,以备后续测定稀释使用。
将浓度分别为10 、20 、30 、40、50 μg/mL的芦丁、VC和粗黄酮系列溶液按照勾明玥等[7]和方敏等[8]的方法,测定样品和空白反应混合物在517 nm处的吸光度,根据下列公式计算清除率:
K=[1-(A1-A2)/A0 ]×100%
式中,K为样品溶液对DPPH 自由基的清除率;A1为DPPH溶液加样品液后的吸光度;A2为样品液在测定波长的吸光度;A0为DPPH溶液不加样品液的吸光度。
1.2.4大青叶提取物对羟自由基清除率的测定。参照莫正昌等[9]的方法,测定反应体系在510 nm波长处的吸光度。
清除率计算公式:K=[1-(A1-A2)/A0 ]×100%
式中,K为样品溶液对羟自由基的清除率;A1为体系中添加样品液时的吸光度;A2为当向体系中加入1 mL 甲醇代替1 mL H2O2时,测得的样品对照吸光度;A0为将体系中的样品溶液改为加入4 mL甲醇时测得的空白对照吸光度(A0)。
2结果与分析
2.1芦丁标准曲线
经线性回归得到芦丁浓度与吸光度的关系曲线方程为y=0.019 2+0.054 0x,R2=0.971 4。可以看出,该方法线性关系良好,该试验即用此法测定大青叶提取物中粗黄酮的得率。
2.2单因素试验结果
2.2.1
提取温度对粗黄酮得率的影响。由图1可知,粗黄酮的得率随提取温度的升高而增大,80 ℃时的得率最大。可能是分子运动随着温度的升高而加快,从而使黄酮的溶解度不断增大;同时高温导致的细胞膜破损促进了有效成分从组织细胞转移到提取溶剂中,使有效成分的溶出量增加[10]。
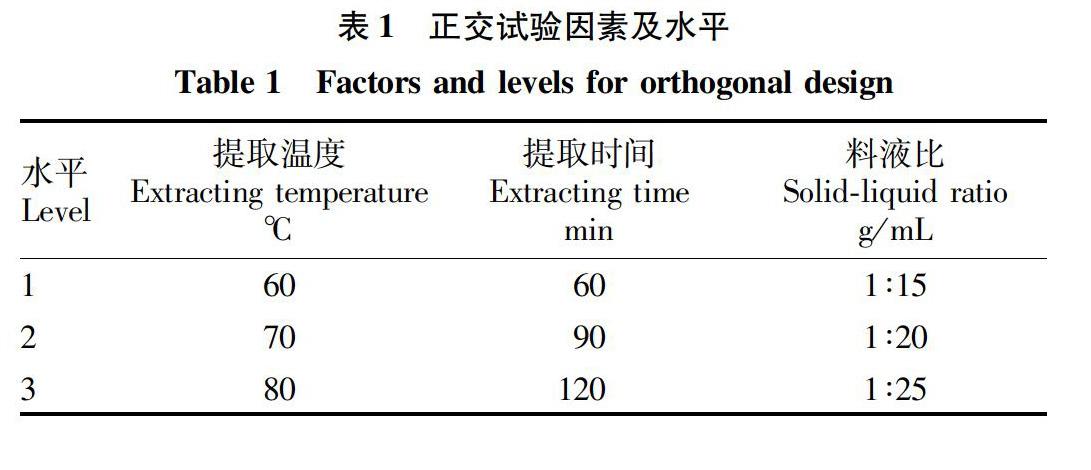
2.2.2提取时间对粗黄酮得率的影响。由图2可知,当提取时间从30 min开始逐渐增加时,粗黄酮的得率随着提取时间的增加而上升,90 min时得率达到最高。 随着提取时间继续增加,粗黄酮的得率开始下降。这可能是由于粗黄酮已基本溶出,持续长时间的高温可能会破坏已溶出的粗黄酮[11]。
2.2.3料液比对粗黄酮得率的影响。
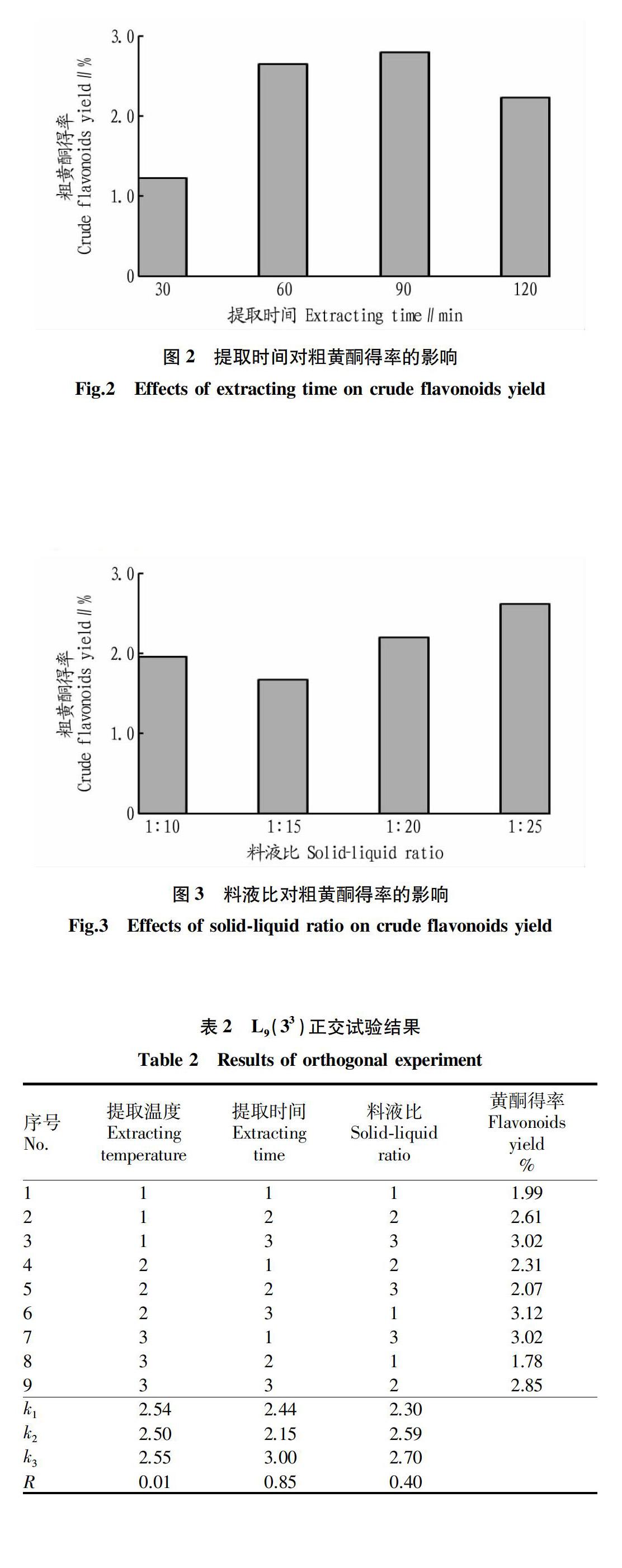
由图3可知,随着溶剂使用量的增加,粗黄酮的得率也随之升高。当料液比为1∶25时,粗黄酮的得率达到最大。继续增加溶剂,费用增加,且粗黄酮得率下降[12]。
2.3正交试验结果
由单因素试验得到最好的3个水平分别为提取温度60、70、80 ℃;提取时间60、90、120 min;料液比1∶15、1∶20、1∶25,按照正交试验设计表进行正交试验。由表2可知,最佳的提取工艺为A3B3C3,即提取温度80 ℃,提取时间120 min,料液比1∶25时大青叶提取物中粗黄酮得率最高。通过极差R分析,三者对粗黄酮得率的影响度为B(提取时间)>C(料液比)> A(提取温度)。
在最佳的提取工艺条件A3B3C3下进行了3次平行的验证试验,结果表明,粗黄酮得率平均值为(3.62±0.01)%,证明正交试验结果是准确和稳定的。
2.4抗氧化性试验结果
由图4可知,大青叶粗黄酮对DPPH自由基的清除率随浓度的升高而上升,在浓度相同的条件下,其清除能力高于芦丁,低于VC,浓度为20 μg/mL的粗黄酮对DPPH自由基的清除率达70%以上。浓度高于30 μg/mL时,大青叶粗黄酮和芦丁对DPPH自由基的清除率很接近,均为85%以上。
图4大青叶粗黄酮、芦丁和VC对DPPH自由基的清除率
Fig.4The scavenging rate of crude flavonoids,rutin and ascorbic acid to DPPH free radicals
由图5可以看出,大青叶粗黄酮对羟自由基的清除率随浓度的提高而上升,在浓度相同的条件下,其清除能力高于芦丁,低于VC,浓度为40 μg/mL的粗黄酮对羟自由基的清除率达50%以上 。
可以明显看出,大青叶粗黄酮对DPPH自由基的清除能力高于对羟自由基的清除能力。
3结论
利用正交试验优化大青叶中粗黄酮的提取工艺,最佳的提取条件为提取时间120 min、提取温度80 ℃、料液比1∶25,该条件下粗黄酮的最大得率为3.62%。
大青叶粗黄酮对DPPH自由基和羥自由基都有一定的清除能力,其清除率介于VC和芦丁之间,尤其是对于DPPH自由基的清除率较高。大青叶粗黄酮是一种良好的天然抗氧化剂,值得进一步开发利用。
参考文献
[1] 陈海红,孙建宇.大青叶的研究进展[J].中国药业,2004,13(8):79-80.
[2] 李微,陈发奎,尹相武,等.大青叶的化学成分[J].沈阳药科大学学报,2005,22(1):15-16,44.
[3] 高桂花.大青叶黄酮化合物的分离鉴定和含量测定方法研究[D].沈阳:沈阳药科大学,2008.
[4] 崔旭,李会端.酶辅助法提取大青叶中总黄酮及抗氧化性研究[J].楚雄师范学院学报,2014,29(6):46-52,79.
[5]王芳,乔璐,淡小艳,等.桑叶黄酮的提取及抗氧化研究[J].广东农业科学,2011,38(15):76-79.
[6] LONDOO J,DE LIMA V R,LARA O,et al.Clean recovery of antioxidant flavonoids from citrus peel:Optimizing an aqueous ultrasoundassisted extraction method[J].Food chemistry,2010,119(1):81-87.
[7] 勾明玥,刘梁,张春枝.采用DPPH法测定26种植物的抗氧化活性[J].食品与发酵工业, 2010,36(3):148-150.
[8] 方敏,王耀峰,宫智勇.15种水果和33种蔬菜的抗氧化活性研究[J].食品科学,2008,29(10):97-100.
[9] 莫正昌,邓靖,汲广全,等.鹿蹄草提取物体外抗氧化活性评价[J].食品科学,2010,31(3):19-21.
[10] KONG K W,ISMAIL A R,TAN S T,et al.Response surface optimisation for the extraction of phenolics and flavonoids from a pink guava puree industrial by-product[J].International journal of food science and technology,2010,45(8):1739-1745.
[11] PENG L X,ZOU L,ZHAO J L,et al.Response surface modeling and optimization of ultrasoundassisted extraction of three flavonoids from tartary buckwheat(Fagopyrum tataricum)[J].Pharmacognosy magazine,2013,9(35):210-215.
[12] 张海涛,刘祺凤,田璐阳,等.超声波辅助提取大青叶中总黄酮及其抗氧化性研究[J].湖北农业科学,2014,53(9):2124-2126.

