材料生物学
——骨修复材料的机遇与挑战
王 靖,刘昌胜
(华东理工大学生物反应器工程国家重点实验室超细材料制备与应用教育部重点实验室,上海200237)
1 前 言
近年来,疾病、自然灾害、交通事故等的频发和人口老龄化的加剧导致临床上骨组织损伤数量巨大[1]。据统计,我国骨关节炎患者已达1.2亿人,骨质疏松患者达1亿余人,骨创伤患者年达300万人。我国骨修复材料的增长率高达20%,远高于同期国际市场的9%。骨组织缺损与损伤已成为影响人们健康和生活的重要疾病,特别是对临界尺寸的修复与重建仍是现代医学力求解决的难题。
对于大段骨缺损,仅仅依靠骨组织自身的修复能力无法愈合,必须进行骨移植手术,否则纤维组织将会填充缺损位置,阻碍新骨形成,造成骨不连。尽管自体骨移植存在骨来源有限、二次手术痛苦和取骨并发症等问题,但目前仍是临床治疗的“金标准”。异体骨移植也因存在免疫排斥及潜在病源传播的风险,临床应用受到限制。采用功能化的人工材料进行修复,不仅可解决自体骨移植“以伤治伤”和来源有限的问题,还有效避免了异体骨移植所存在的诸多问题,成为目前临床上自/异体骨移植之外治疗骨缺损疾病的主要手段。因此,研究和开发满足临床需求的人工骨生物材料成为骨再生领域的重要课题。
目前,应用于临床的人工骨修复材料主要包括钙磷基材料、生物玻璃以及胶原等产品。尽管这些材料在成分或结构的某些方面模拟了天然骨组织,具有一定的引导组织生长和新骨沉积的作用。但与自体骨相比,上述材料仍然存在诸如生物活性不足、难以达到骨性愈合、血管化困难、材料降解速度与组织生长不匹配等瓶颈问题,加之人体创伤部位自身修复能力有限,尤其是对于临界骨缺损患者和再生能力弱的群体,常常导致材料植入后缺损愈合速度慢,成骨量有限,临床疗效不尽人意[2]。这不仅导致医疗费用的增加,更加剧了患者的痛苦。
进一步分析,尽管骨修复材料是材料领域的研究热点,但目前的研究大多集中在对材料表观状态的表征以及对最终成骨效果的评价,而对于材料植入体内后如何参与骨修复的过程缺乏系统和精细的认识;另一方面,宿主微环境对植入材料的影响也不明了。这些认识上的盲区直接制约着新型材料的设计、构建以及对骨组织再生过程的调控。而这些都涉及到材料在体内的生物学效应。本文对材料植入体内后与微环境相互作用并产生新的生物学效应进行了简要介绍,同时提出聚焦材料生物学研究,可能为构建骨修复材料提供新思路。
2 体内微环境
体内微环境是指为组织生长提供营养和场所的环境,主要由基质细胞、细胞外基质及各种细胞因子组成[3-5]。植入的生物材料正是在这一微环境中完成对骨损伤的修复。从细胞和分子水平来看,骨组织修复是一个复杂的过程,涉及材料、细胞、细胞外基质与信号分子的识别、相关因子的表达及新骨的发育成熟等一系列链式过程[6]。材料植入后,也经历与正常骨折愈合相似的炎症期、修复期和塑形期3个阶段。但由于存在材料引起的宿主防御和材料参与的组织再生的交互作用,使得该过程更为复杂。例如,植入材料会选择性地吸附蛋白并释放离子以及生长因子等活性分子,形成新的微环境;体内免疫细胞启动免疫应答机制,成骨相关细胞开始向材料表/界面聚集和粘附,进一步在微环境调控下增殖、分化成特定的成骨细胞系;随后成骨细胞分泌特殊的蛋白,调控生物矿化,最终形成骨组织;同时伴随着材料的降解、吸收和代谢,以及新骨的塑形。可见材料从植入到完成骨修复的全过程都与材料在体内微环境中的生物学效应密切相关。
当材料植入后,材料本身的化学组成、表/界面和本体特征以及携载的生长因子的种类、携载方式等直接对微环境产生影响,继而影响到组织形成。并且体内微环境始终处于动态的变化中。相比之下,目前的材料学研究大多是在体外静态环境中进行的,因而与体内实际情况差别巨大。因此,构建和优化骨修复材料的前提和关键是深入认识和掌握材料与体内微环境的相互作用,以及在这一动态微环境中材料的生物学效应及其基本规律。刘昌胜近年来提出“材料生物学(Materiobiology)”这一新科概念[7],即采用材料学的理论和方法研究生命现象、生命过程(图1)。随着更多的材料生物学新效应被发现,材料生物学对新型生物材料设计与制备的指导作用显得越来越重要。
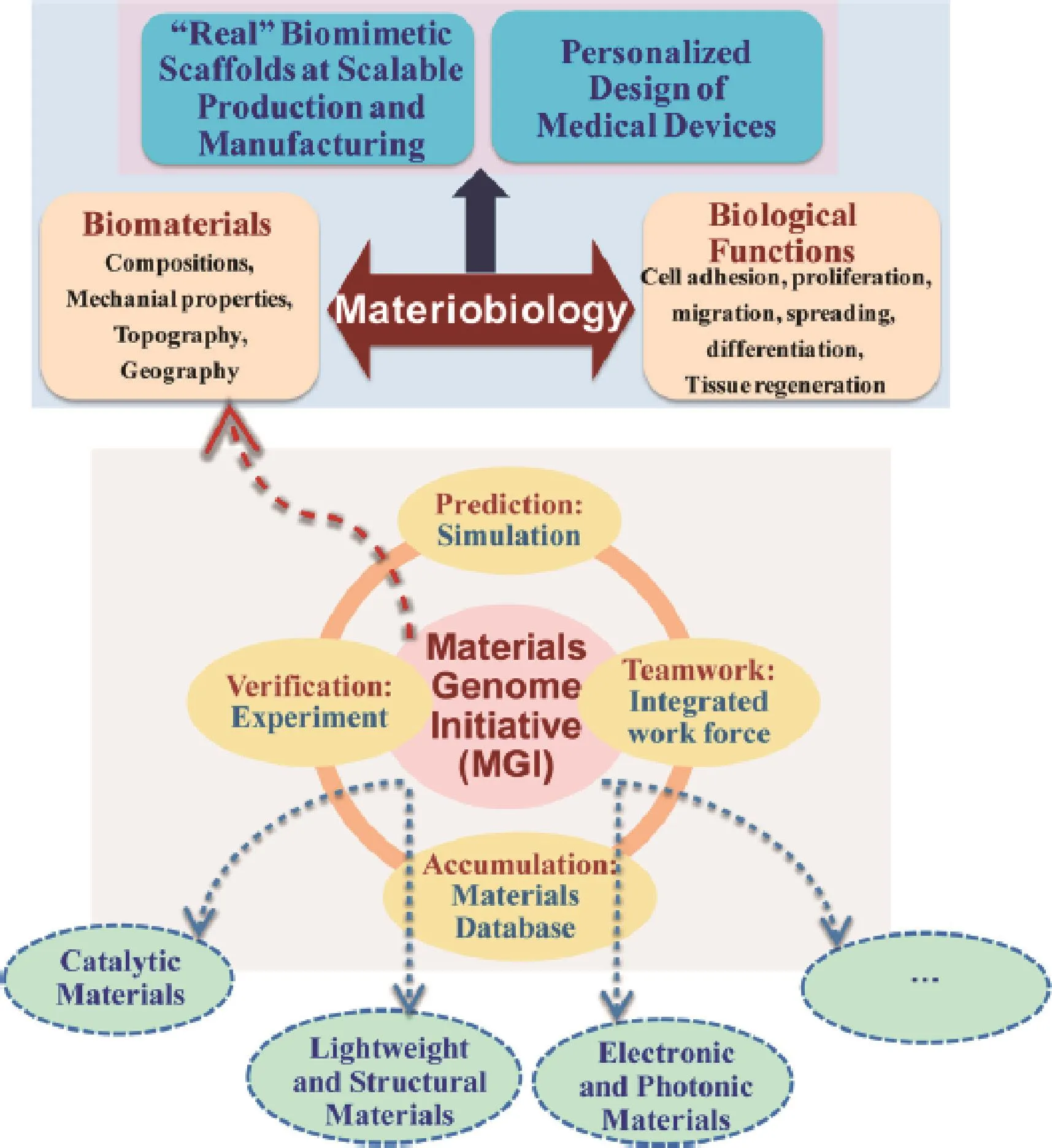
图1 材料生物学将丰富和拓展材料基因组数据库[7]Fig.1 Schematic representation of how the development of materiobiology enrich and deepen the contents of the Materials Genome Initiative(MGI)database[7]
3 炎性微环境及材料的免疫调控效应
单核细胞与巨噬细胞是炎性反应过程中两种主要的免疫效应细胞。巨噬细胞具有可塑性和多样性,对环境中的信号分子能够作出有效响应,并改变其表型。材料植入到组织缺损部位后,首先发生的是微环境对体内单核细胞、巨噬细胞、中性粒细胞等免疫细胞的招募。这些免疫细胞一方面包围和吞噬外来物质,另一方面分泌各种细胞因子和生长因子,并进一步募集细胞参与组织再生与重建。对于骨修复材料与体内免疫防御体系的认识,大多仍停留在如何避免植入材料引起炎症反应。但免疫反应对于组织修复来说并非完全不利[8,9]。近年来更多的研究认为:材料植入后激发的机体的免疫应答在材料参与骨组织再生方面起了关键作用。例如,研究发现,单核细胞在相关趋化因子作用下,从血液迁移至材料植入部位分化成巨噬细胞,并根据局部刺激因素不同,向M1型、M2型和调节性巨噬细胞极化,在炎症反应和后续免疫活动中起不同的作用。M1型细胞分泌促炎性细胞因子,促进组织的损伤,其长期活化对组织修复不利;M2型细胞主要释放抗炎因子起到免疫调节作用,并释放相关生长因子促进血管化和胞外基质形成,利于组织修复和再生;巨噬细胞在材料及细胞因子的调控下,相互融合形成多核巨细胞,包裹于材料表面形成初始包裹体而促进组织修复。不同材料刺激下巨噬细胞所表达的趋化因子、表面标记和代谢酶具有很大差异,从而在炎性和非炎性环境中表现出不同的功能。可见巨噬细胞的极化方向对于骨组织修复重建的成败起着重要作用。探明材料对巨噬细胞的极化方向及其信号通路的影响因素,在骨缺损修复的不同阶段辅以适时引导,将更好地调控骨修复过程。此外,尽管宿主的炎症反应是组织对损伤和异物的正常应答,但是炎症的强度和持久性最终将影响材料在体内的生物相容性、稳定性和植入的有效性。设计具有适度免疫反应的材料,通过激发适当的免疫响应,促进骨组织再生,这将是骨修复材料设计的新思路。同时,对骨修复材料的评价不仅需要考虑其对成骨相关细胞的作用,还应考虑材料的免疫响应及其产生的炎性环境对骨修复的影响。
免疫细胞在骨生成中起着不可或缺的调节作用,在骨再生过程中发挥积极作用。存在于骨组织中的巨噬细胞(OsteoMacs)是巨噬细胞中的特殊亚型,约占所有的骨髓细胞的六分之一[10]。炎性微环境被认为是影响细胞成骨分化的重要因素之一,可以影响成骨细胞的行为、凋亡、粘附和通透性。炎性因子种类众多,并且其中许多因子之间能够相互调节,表明免疫细胞在骨再生过程中具有双重作用。充分了解免疫细胞是如何影响骨生成过程,将有助于开发免疫调节干预策略,促进骨修复。
从宿主的免疫系统来看,植入的生物材料也是一种异物,能够引起自身系统多种的免疫反应。生物材料不仅是简单的免疫细胞的攻击靶点,而且能够显著影响免疫反应的程度和类型,材料的表面特性、粒径大小、孔隙率和释放的产物等都对免疫反应有影响[11-14]。例如,表面粗糙度会影响由巨噬细胞分泌的炎性因子和趋化因子。相比光滑的钛表面,粗糙的钛表面有利于巨噬细胞的粘附和伸展。粗糙表面的植入物能够促进伤口修复。材料表面调节免疫反应的机理主要与蛋白的吸附行为有关,蛋白在吸附之后结构产生变化使一些隐蔽的抗原暴露从而被免疫细胞识别,细胞通过特异受体结合而吸附于材料表面。
孔隙率和孔径是支架材料的两个关键参数,同样也会影响巨噬细胞的免疫行为。小孔可能严重阻碍血液和组织液中营养物质和氧气的扩散,尤其是在植入材料的中心,会造成局部低氧环境,缺氧会增强局部炎症,最终形成肉芽肿。有研究表明,随着孔径的增加,异物免疫反应就会降低。增加纤维孔的大小能促进巨噬细胞从M1型向M2型转变。
生物材料植入体内后通过物理化学溶解、热解、酶解或腐蚀会出现不同程度的降解,在降解过程中释放的离子会改变局部微环境,从而进一步影响免疫响应[15]。例如,钙是钙磷基骨修复材料的主要成分之一,钙离子通过非经典通路Wnt/5A进行免疫调节。镁是一种可降解的生物相容性金属材料,镁离子可以通过抑制Toll样受体(TLR)通路进行免疫调节。锶是一种已经被用作治疗骨质疏松症的微量元素,其可以通过阻断NF-κB通路而抑制TNF-α的分泌。另外,Zn,Si,Co等生物活性离子也会引发系统不同的免疫响应,因此可以通过控制生物材料中离子的释放来操纵免疫反应,这对骨修复材料的研发设计具有十分重要的意义。
以已获临床使用的磷酸钙骨修复材料为例,Liu等研究发现[16],掺入少量镁离子后,磷酸钙镁支架(Magnesiumdoped calcium phosphate scaffold,MCPC)通过释放镁离子,调节了巨噬细胞RAW 264.7的炎性响应,促进M2表达,并且M1表达下调。对成骨的影响方面,镁离子的掺入降低了巨噬细胞炎性因子TNF-α、IL-6和IL-10的表达,并且诱导巨噬细胞高表达BMP-2和TGF-β1。在此基础上,进一步研究了磷酸钙镁材料激发的巨噬细胞的免疫响应,对骨髓基质干细胞(BMSCs)成骨分化和内皮细胞成血管能力的影响。在含有巨噬细胞条件培基的培养液中,MCPC对BMSCs的碱性磷酸酶(ALP)活性、矿化及成骨相关基因表达产生影响,其中磷酸钙诱导的M1型免疫环境对BMSCs成骨无明显作用,而磷酸钙镁所诱导的M2型免疫环境有利于成骨分化,这与RAW 264.7分泌的炎性因子密切相关。对细胞迁移实验与芽体发生和血管化基因表达结果分析发现,磷酸钙镁对巨噬细胞的刺激能够促进内皮细胞HUVECs的血管化行为(图2)。因此,磷酸钙镁能够诱导RAW 264.7发生M2极化,这种转变产生的免疫微环境有利于骨修复。
4 成骨微环境与材料的因子协同效应

图2 磷酸钙镁支架(MCPC)的免疫调控效应及其对成骨的影响[16]Fig.2 Schematic illustration of effects of MCPC on immunomodulation and the subsequent osteogenesis[16]
为了促进骨修复,提高植入材料的成骨活性,越来越多的研究者青睐于将骨诱导生长因子引入骨修复材料。其中,骨形态发生蛋白(BMP)是一类具有诱导骨生成能力的生长因子,能使间充质干细胞定向分化为成骨细胞。因其强大的成骨能力,BMP-2已经被美国食品与药品监督管理局(FDA)批准用于临床骨损伤治疗[17]。
尽管BMP-2具有显著疗效,但其在实际使用当中仍然存在诸多局限性。BMP-2体内半衰期很短,植入体内数小时后即可被蛋白酶分解。为获得良好的融合效果,临床上BMP-2的使用剂量都处于毫克级的超生理浓度范围,不仅消耗了大量的医疗成本,而且易导致软组织水肿、皮肤红疹、局部炎症反应、异位骨化和免疫反应等并发症,直接影响患者的健康和生命安全。为了保持和提高BMP-2在体内的生物活性,目前骨修复领域研究重点之一是寻找可能与BMP-2存在协同效应的药物或试剂,筛选BMP-2与药物分子的最佳配伍,使BMP-2在其它生物分子的共同参与下,更好地诱导新骨形成。生物材料在维持生长因子活性、延长其半衰期方面作用显著,通过载体材料的特性来缓慢释放BMP-2,从而在局部达到有效的骨诱导作用[18-20]。
除了载体的保护作用外,以肝素为代表的磺化多糖还能增加 BMP-2本身的生物活性[21-23]。肝素能够与BMP-2中的肝素结合域结合,剂量依赖性地增强BMP-2的同源二聚体和异源二聚体如BMP-2/6或BMP-2/7诱导的体外成骨分化;并且肝素存在下,BMP-2与其受体BMPR-IA、BMPR-II的结合增强。同时,肝素能够通过降低BMP-2与其拮抗剂Noggin的结合,阻碍拮抗剂分子对BMP-2的降解和抑制作用,从而增强BMP-2所诱导的体内外的成骨分化。Liu等进一步研究了多糖与BMP-2的相互作用,发现多糖需要与BMP-2发生亲和,才能调节BMP-2的成骨活性。磺化多糖对BMP-2成骨活性的调节呈现“低促高抑”的规律,在最佳作用浓度下,磺化多糖通过上调BMSCs中内源性受体BMPRs的表达,增强BMP-2-BMPRs间的识别,协同促进BMP-2诱导的成骨分化。在此基础上,提出了生物材料的生长因子协同效应[24](图3)。生物材料不仅能通过缓控释作用,保护生长因子,延长生长因子的作用时间,而且能通过对生长因子构象、拮抗剂、受体结合等方面的影响,在不改变作用时间的条件下,增强生长因子的作用效率[25-26]。因此,设计特定的生物材料可以作为生长因子的增强剂,协同生长因子调控细胞的定向分化。
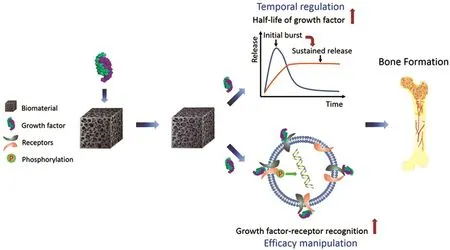
图3 生物材料作为生长因子的增强分子[24]Fig.3 Biomaterials act as enhancer for growth factors via dual-mechanisms[24]
5 血管化微环境与材料的促血管再生效应
血管形成主要通过血管发生和血管再生两种途径,创伤修复时新血管的再生以血管再生为主。组织修复再生以毛细血管网重建为开端,是一个由新的微血管发展成血流供应系统的过程,其主要方式有出芽、套叠、镶嵌体血管以及血管生成拟态等[27]。大尺寸骨组织缺损修复面临的主要挑战之一就是血管化三维结构的建立,因为细胞只能通过血液弥散获取200 μm之内的氧和营养物质。如果不能建立良好的血液循环,那么骨修复材料的最终尺寸将受到很大程度的限制。因此,如何提高骨修复材料的促血管化功能受到了关注。
一般情况下,血管生成受到多方面因素的调节,主要包括:促进血管再生的生长因子、基质金属蛋白酶、纤维状肌动蛋白、以及血管壁基质的调节作用。由于血管化的重要性,理想的骨修复支架材料应该具备促血管化的功能。目前,已有研究从材料表面和三维结构等方面促进材料修复时的血管化。研究表明,生物惰性且表面相容性差的聚乙烯材料,不论其形状大小、植入时间长短以及是否添加促进血管形成的生长因子,在血管长入方面都比羟基磷灰石差。材料表面涂层胶原或纤连蛋白后,血管内皮细胞可以很好地粘附和增殖,并形成血管样结构。
支架材料适宜的三维孔隙结构有利于营养物质、氧气以及代谢产物的运输和交换,并为新生血管的长入提供通道,因而有利于骨修复材料的血管化。对松质骨和皮质骨再血管化的研究证实,松质骨较皮质骨血管形成更迅速和完全,这是因为松质骨具有天然的三维多孔结构,为血管长入提供了大量通道。借鉴松质骨的高度连通结构,利用3D打印技术可制备出高度连通中空结构的支架,在临界尺寸修复中发现有大量的连续血管生成,在动物实验中发现骨修复效果更好[28]。
在材料组成方面,研究发现,在胶原材料中加入细胞外基质成分氨基多糖可减少材料植入体内时的异物反应,改善细胞相容性和生物活性,并促进血管形成,其原因不仅是减少了不利于血管长入的异物反应以及炎性细胞和纤维包膜的形成,也可能是由于氨基多糖本身能够刺激血管的形成。另外,掺锶聚硅酸钙陶瓷的降解产物能明显促进脐静脉内皮细胞的增殖和迁移[29]。
Liu课题组发现了类肝素磺化壳聚糖促血管化作用。2-N,6-O-磺化壳聚糖(26SCS)通过调节促血管发生类细胞因子、促内皮细胞有丝分裂和增殖类细胞因子及炎症类细胞因子这3类细胞因子的分泌,从而直接或间接地影响血管生成。此外,26SCS存在下,HUVECs的增殖、芽体发生、血管化相关基因表达和细胞因子分泌都增强。基于磺化壳聚糖的促血管化效应设计骨修复材料,在兔桡骨大段骨缺损的动物实验中,能够有效促进缺损部位血管网络的修复[30],促进骨修复,提高修复质量(图4)。

图4 含磺化多糖材料对骨修复的影响[30]Fig.4 Schematic diagram of the effect of sulfated chitosan-contained biomaterials on the bone repairing[30]
6 结 语
已有研究表明,植入材料在体内微环境中表现出免疫调控效应、与生长因子的协同效应、促血管化效应等新的生物学效应。但由于目前对材料的生物学功能的研究大多停留在单一因素分析,缺乏对材料生物学效应的系统研究,因此导致材料的潜在的生物学效应还未发现,而这些生物学效应恰恰是在体内复杂的动态微环境、多细胞体系的作用中表现出来的。因此,有必要聚焦涉及生命现象和生命过程的生物材料及其生物学效应,揭示材料在生命活动中的作用规律,在细胞、组织/器官及整个生物体等不同层面探索材料特征对其生物学功能的影响及其调控规律,研究材料特性与生物功能的关联性,建立生物材料基因组数据库,为新型材料的设计和新功能挖掘提供理论支持。

