亚低温对番茄hta9hta11 双突变体光合碳同化相关指标的影响
卢盼玲, 郭世荣, 杨学东, 冯 岩, 季维维, 张 辉, 田守波, 朱为民,①
(1. 南京农业大学园艺学院, 江苏 南京 210095; 2. 上海市农业科学院设施园艺研究所 上海市设施园艺技术重点实验室, 上海 201403;3. 上海星辉种苗有限公司, 上海 201403)
表观遗传机制可调控植物对逆境胁迫的应答,组蛋白变体H2A.Z 为重要的表观修饰因子,参与多种非生物胁迫[1-3],并且,其基因家族成员较多[4-5]。hta9hta11双突变体植株具有多效性表型,且H2A.Z基因家族其他成员的表达不能补偿HTA9 和HTA11 蛋白功能缺失[6]。
番茄(LycopersiconesculentumMill.)为重要的设施蔬菜和常用的模式植物,对低温敏感[7]。 亚低温条件下番茄hta9hta11双突变体生长明显迟缓[8]。 为了探明亚低温条件下番茄组蛋白变体H2A.Z 对光合碳同化表观遗传机制的作用,作者就亚低温对番茄野生型和hta9hta11双突变体光合碳同化相关指标的影响进行了研究,以期进一步探明番茄组蛋白变体H2A.Z 的功能,并为利用表观遗传修饰提高番茄对亚低温的耐受能力进而提高番茄产量和品质提供研究基础。
1 材料和方法
1.1 材料
以上海市农业科学院设施园艺研究所上海市设施园艺技术重点实验室保存的番茄品种‘1479’的野生型和hta9hta11双突变体幼苗为研究对象。
1.2 方法
1.2.1 亚低温处理方法 选取3 叶1 心期长势良好且基本一致的野生型和hta9hta11双突变体幼苗,移入人工气候箱中,培养1 d 后进行亚低温处理。 设置对照组(昼温和夜温分别为25 ℃和20 ℃)和处理组(昼温和夜温分别为15 ℃和10 ℃)。 其他培养条件相同,光照时间14 h·d-1、光照强度500 μmol·m-2·s-1,空气相对湿度70%。 栽培基质为V(泥炭)∶V(蛭石)= 2 ∶1的混合基质。 采用随机区组排列,每组野生型和hta9hta11双突变体幼苗各50 株,均3 个重复。 处理20 d 后取样检测各指标。
1.2.2 指标测定 在晴天9:00 至11:00,每组取3 株苗,用GFS-3000 便携式高级光合作用-荧光测量系统 (德国Walz公司)测定苗顶端向下第3 枚叶的净光合速率,重复测定3 次。 测定时,开放气路,光照强度800 μmol·m-2·s-1,CO2浓度500 μmol·mol-1,叶室温度(25±2) ℃,空气相对湿度60%~70%。
每组取9 株苗,采集顶端向下第2 和第3 枚叶,测定叶绿素含量[9]以及淀粉和蔗糖含量[10],并测定果糖-1,6-二磷酸醛缩酶活性[11]以及核酮糖-1,5-二磷酸羧化/加氧酶和果糖-1,6-二磷酸酯酶活性[12]。 每个指标重复测定3 次。
每组取9 株苗,采集顶端向下第2 和第3 枚叶,每3 株为1 组,视为1 个重复。 将叶剪碎后混合,称取0.1 g,在液氮中研磨成粉,用RNA 提取试剂盒〔宝生物工程(大连)有限公司〕提取总RNA,用PrimeScriptTMRT Master Mix 反转录试剂盒〔宝生物工程(大连)有限公司〕合成cDNA 第1 条链,用TBTMGreenPremixDimerEraser 试剂盒〔宝生物工程(大连)有限 公司〕在AppliedBiosystemsQuantStudio5 实时荧光定量PCR仪(美国ABI 公司)上完成扩增反应,并采用2-ΔΔCt法[13]计算基因的相对表达量。 供试基因引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。
1.3 数据分析
利用EXCEL 2016 软件处理数据,采用SPSS 19.0 统计分析软件进行单因素方差分析。
2 结果和讨论
亚低温对番茄野生型和hta9hta11双突变体光合碳同化相关指标的影响见表2。 由表2 可见:对照组(昼温25 ℃和夜温20 ℃)野生型和hta9hta11双突变体的净光合速率(Pn),叶绿素(Chl)和蔗糖(Suc)含量,果糖-1,6-二磷酸醛缩酶(FBA)、果糖-1,6-二磷酸酶(FBPase)和核酮糖-1,5-二磷酸羧化/加氧酶(Rubisco)活性以及PRK、RbcS、RbcL、FBPase和FBA基因的相对表达量无显著差异;hta9hta11双突变体的淀粉(Sta)含量和TK基因的相对表达量显著(P<0.05)低于野生型,而其GAPDH、SBPase和RCA基因的相对表达量显著高于野生型。 处理组(昼温15 ℃和夜温10 ℃),hta9hta11双突变体的Chl 含量略低于野生型;其Pn 值,Suc 和Sta 含量,FBA和FBPase 活性以及TK、GAPDH、SBPase、PRK、RbcL、RCA、FBPase和FBA基因的相对表达量显著低于野生型;而其Rubisco 活性和RbcS基因的相对表达量显著高于野生型。

表1 用于扩增反应的各基因的引物序列Table 1 Primer sequences of each gene used for amplification reaction
由表2 还可见:就野生型而言,对照组和处理组间的Chl和Suc 含量、Rubisco 活性和TK基因的相对表达量无显著差异;处理组的Pn 值、Sta 含量和RbcS基因的相对表达量显著低于对照组,而其FBA 和FBPase 活性以及GAPDH、SBPase、PRK、RbcL、RCA、FBPase和FBA基因的相对表达量显著高于对照组。 就hta9hta11双突变体而言,对照组和处理组间的Chl 和Suc 含量、Rubisco 活性以及FBPase和FBA基因的相对表达量无显著差异;处理组的Pn 值,Sta 含量,FBA 活性以及TK、GAPDH和RCA基因的相对表达量显著低于对照组,而其FBPase 活性以及SBPase、PRK、RbcS和RbcL基因的相对表达量显著高于对照组。
表2 亚低温对番茄野生型(WT)和hta9hta11 双突变体(hta9hta11)光合碳同化相关指标的影响(±SD)1)Table 2 Effect of mild hypothermia on photosynthetic carbon assimilation related indexes of wild type (WT) and hta9hta11 double mutant(hta9hta11) of Lycopersicon esculentum Mill. (±SD)1)
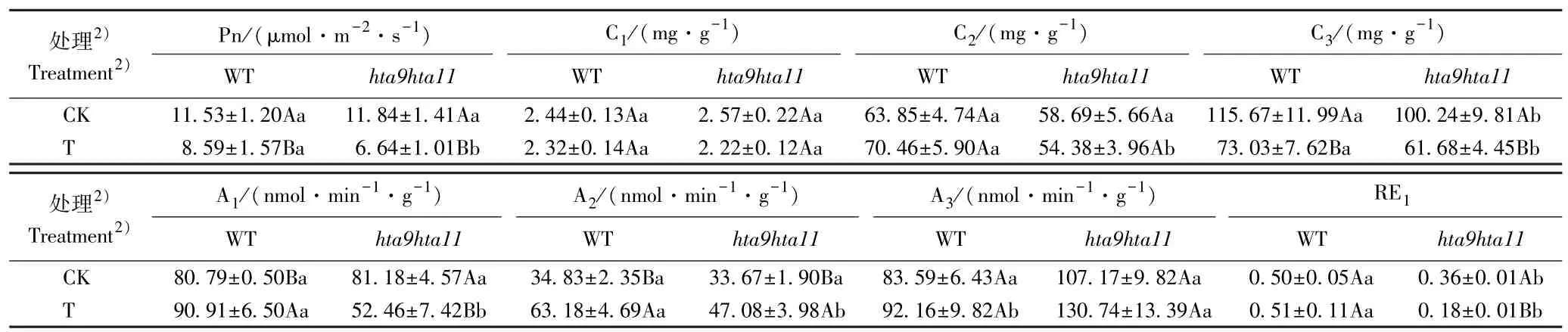
表2 亚低温对番茄野生型(WT)和hta9hta11 双突变体(hta9hta11)光合碳同化相关指标的影响(±SD)1)Table 2 Effect of mild hypothermia on photosynthetic carbon assimilation related indexes of wild type (WT) and hta9hta11 double mutant(hta9hta11) of Lycopersicon esculentum Mill. (±SD)1)
处理2)Treatment2)Pn/(μmol·m-2·s-1)C1/(mg·g-1)C2/(mg·g-1)C3/(mg·g-1)WT hta9hta11 WT hta9hta11 WT hta9hta11 WT hta9hta11 CK 11.53±1.20Aa 11.84±1.41Aa 2.44±0.13Aa 2.57±0.22Aa 63.85±4.74Aa 58.69±5.66Aa 115.67±11.99Aa 100.24±9.81Ab T 8.59±1.57Ba 6.64±1.01Bb 2.32±0.14Aa 2.22±0.12Aa 70.46±5.90Aa 54.38±3.96Ab 73.03±7.62Ba 61.68±4.45Bb处理2)Treatment2)A1/(nmol·min-1·g-1)A2/(nmol·min-1·g-1)A3/(nmol·min-1·g-1)RE1 WT hta9hta11 WT hta9hta11 WT hta9hta11 WT hta9hta11 CK 80.79±0.50Ba 81.18±4.57Aa 34.83±2.35Ba 33.67±1.90Ba 83.59±6.43Aa 107.17±9.82Aa 0.50±0.05Aa 0.36±0.01Ab T 90.91±6.50Aa 52.46±7.42Bb 63.18±4.69Aa 47.08±3.98Ab 92.16±9.82Ab 130.74±13.39Aa 0.51±0.11Aa 0.18±0.01Bb
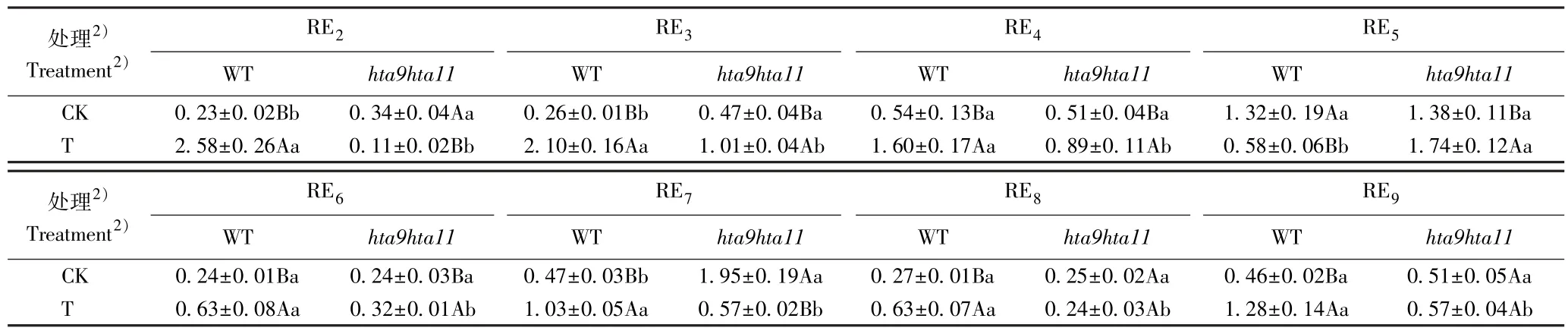
续表2 Table 2 (Continued)
本研究中,处理组番茄野生型和hta9hta11双突变体的Pn值显著低于对照组,处理组hta9hta11双突变体的Pn 值显著低于野生型,说明hta9hta11双突变体对亚低温更敏感。 处理组hta9hta11双突变体的Suc 和Sta 含量显著低于野生型;处理组hta9hta11双突变体的FBA 和FBPase 活性显著低于野生型,而其Rubisco 活性显著高于野生型,据此推测在亚低温条件下番茄组蛋白变体H2A. Z 可能对光合碳同化关键酶活性有调节作用。 与对照组相比,hta9hta11双突变体TK、GAPDH和RCA基因的相对表达量显著下降,而SBPase、PRK、RbcS和RbcL基因的相对表达量却显著上升,说明在亚低温条件下番茄组蛋白变体H2A. Z 可能参与调控光合碳同化关键酶基因的表达,但具体调控机制尚不明确,有待进一步研究。 综合分析认为,亚低温条件下番茄hta9hta11双突变体的光合碳同化能力低于野生型,组蛋白变体H2A.Z 可能在调控番茄光合碳同化途径中起重要作用。

