慢性间歇低氧对小鼠心肌低氧诱导因子-2α和β3肾上腺素能受体表达及心功能的影响
王 越 郝文静 李宜嘉 王悦 吴小凡
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea,OSA)是以慢性间歇低氧(chronic intermittent hypoxia,CIH)为主要病理特征的疾病,好发于肥胖人群。临床研究证实,OSA是肥胖患者发生心力衰竭的危险因素[1]。低氧诱导因子(hypoxia inducible factor,HIF)2是机体生理性和病理性缺氧条件下发挥调节作用的转录因子,由功能亚基α和结构亚基β构成,已有研究表明HIF-2α与心室重构相关[2],但是其参与心室重构的具体机制尚未阐明。β3肾上腺素能受体(β3 adrenergic receptors,β3 AR)是广泛表达于血管、心肌等组织的一类β肾上腺素能受体,具有调节钠钾泵、钙离子通道等作用,近年来成为心力衰竭研究领域的热点[3]。然而,CIH对心肌β3 AR的表达是否具有调节作用尚未明确。本实验以高脂饮食喂养ApoE-/-小鼠建立肥胖模型,探究CIH刺激对肥胖小鼠心肌HIF-2α和 β3 AR的调节作用及对心功能的影响,为揭示OSA促进肥胖患者心力衰竭发生发展的具体机制提供实验依据。
材料与方法
1.研究材料 (1)实验动物 无特定病原体级,ApoE-/-雄性小鼠,6~7周龄,体质量(25±3)g,购自北京华阜康生物科技股份有限公司。实验动物在首都医科大学附属北京安贞医院实验动物房内正常饲养,符合实验动物伦理委员会的要求。
(2)主要实验试剂 高脂饲料(含21%脂肪,0.15%胆固醇)购自北京华阜康生物科技股份有限公司;苏木素染液购于上海碧云天公司;HIF-2α多克隆抗体、β3 AR多克隆抗体均购于美国Abcam公司;辣根过氧化物酶标记的羊抗兔二抗、DAB显色剂均购于北京中杉金桥公司;蛋白定量试剂盒购于赛默飞世尔科技有限公司;GAPDH多克隆抗体购于北京普利莱基因技术有限公司。
2.方法 (1)动物模型及分组6~7周龄无特定病原体级ApoE-/-雄性小鼠24只,适应性喂养1周后随机分为三组:对照组(n=8):普通饲料喂养,无特殊处理;高脂组(n=8):高脂饲料喂养12周;高脂+低氧组(n=8):高脂饲料喂养4周后,将ApoE-/-小鼠放入低氧舱内,以计算机控制舱内氧浓度在30 s内降至6.0%,维持5 s后向舱内充入氧气,在30 s内将舱内氧浓度升至21.0%,维持5 s后向舱内充入氮气,70 s为一个循环,低氧组小鼠每天在舱内8 h,持续8周,舱内温度、湿度与室内相同[4]。
(2)心脏多普勒超声测量 8周的慢性间歇低氧结束后,采用VisualSonics Vevo 2100型超声仪对小鼠进行心脏多普勒超声测量。将ApoE-/-小鼠称重麻醉后剃去胸前毛发,固定于操作台,将30 MHz的探头置于左胸前,调整角度以获得左心室的长轴切面,在此切面将M型取样线分别置于二尖瓣、乳头肌、主动脉根部及心尖部等部位,获得相应M型曲线,进行测量;将探头顺时针转动900,获得左心室短轴的各个切面。测量指标包括:舒张末期室间隔厚度(IVSd)、收缩末期室间隔厚度(IVSs)、舒张末期左心室内径(LVIDd)、收缩末期左心室内径(LVIDs)、左心室后壁舒张末期厚度(LVPWd)、左心室后壁收缩末期厚度(LVPWs),根据所得指标计算:左心室舒张末期容积(EDV):EDV=[7/(2.4+LVIDd)]×LVIDd3;左心室收缩末期容积(ESV):ESV=[7/(2.4+LVIDs)]×LVIDs3;LVEF:EF=100%×(EDV-ESV)/EDV;左心室短轴缩短分数(FS):FS=100%×(LVIDd-LVIDs)/LVIDd[5]。
(3)心肌HIF-2α免疫组织化学染色 超声测量结束后剪开小鼠胸腔,用冰肝素0.9%氯化钠液经心尖灌至内脏组织变白后,分离心脏。取部分心脏组织浸泡于4%多聚甲醛溶液中固定36~48 h,常规石蜡包埋,连续切片,厚度约5μm。各组小鼠心脏组织石蜡切片脱蜡后以3%过氧化氢室温处理15 min,牛血清封闭1 h后以HIF-2α抗体(1∶200)4℃孵育过夜,羊抗兔二抗室温孵育1 h后进行DAB显色,细胞质中出现黄色或棕黄色颗粒为HIF-2α蛋白阳性表达[6]。每只小鼠选3张切片,100倍视野下摄相,每张切片取2个视野,计算每个视野内阳性面积占组织总面积的百分比。
(4)心肌β3 AR免疫印迹实验 取各组小鼠新鲜心脏组织,称重后按照组织质量:裂解液体积为1∶9的比例加入组织裂解液,制备心脏组织匀浆,利用BCA法测定蛋白质含量。进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离后,转移到硝酸纤维素膜上,用5%牛奶封闭液封闭1 h,加入一抗 β3 AR(1∶2 000)、GAPDH(1∶1 000),4℃孵育过夜,以羊抗兔二抗(1∶10 000)室温孵育1 h,胶片发光,扫描分析各条带吸光度值[7]。
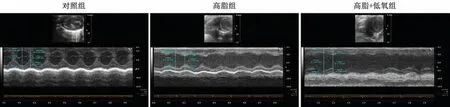
图1 三组小鼠心脏多普勒超声经线测量图
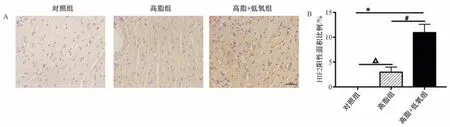
图2 各组小鼠心肌组织HIF-2α表达水平A:免疫组织化学染色示HIF-2α在各组小鼠心脏组织中的定位表达情况(标尺为25um);B:各组小鼠心脏组织HIF-2α阳性面积占总面积的比例n=5~8),注:高脂组与对照组相比,△P<0.05;高脂+低氧组与对照组相比,*P<0.05;高脂+低氧组与高脂组相比,#P<0.05
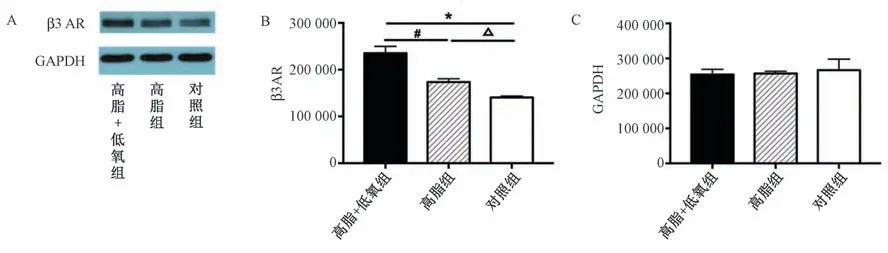
图3 各组小鼠心肌组织β3 AR表达水平 A:各组小鼠心肌组织GAPDH和 β3 AR蛋白条带;B:各组小鼠心肌组织β3 AR条带吸光度值(n=6);C:各组小鼠心肌组织GAPDH条带吸光度值(n=6)。注:高脂组与对照组相比,△P<0.05;高脂+低氧组与对照组相比,*P<0.05;高脂+低氧组与高脂组相比,# P<0.05
表1 三组小鼠心脏多普勒超声测量结果()
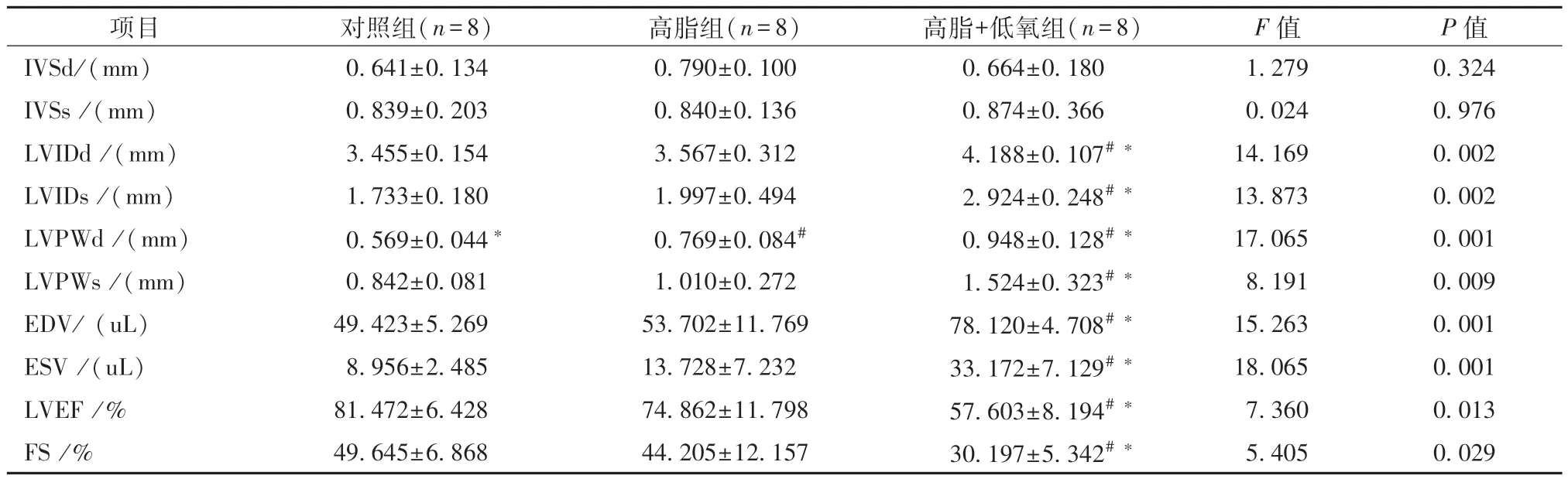
表1 三组小鼠心脏多普勒超声测量结果()
注:与对照组比较,#P<0.05;与高脂组比较,*P<0.05
项目 对照组(n=8) 高脂组(n=8) 高脂+低氧组(n=8) F值 P值IVSd/(mm) 0.641±0.134 0.790±0.100 0.664±0.180 1.279 0.324 IVSs/(mm) 0.839±0.203 0.840±0.136 0.874±0.366 0.024 0.976 LVIDd/(mm) 3.455±0.154 3.567±0.312 4.188±0.107#* 14.169 0.002 LVIDs/(mm) 1.733±0.180 1.997±0.494 2.924±0.248#* 13.873 0.002 LVPWd/(mm) 0.569±0.044* 0.769±0.084# 0.948±0.128#* 17.065 0.001 LVPWs/(mm) 0.842±0.081 1.010±0.272 1.524±0.323#* 8.191 0.009 EDV/(uL) 49.423±5.269 53.702±11.769 78.120±4.708#* 15.263 0.001 ESV/(uL) 8.956±2.485 13.728±7.232 33.172±7.129#* 18.065 0.001 LVEF/% 81.472±6.428 74.862±11.798 57.603±8.194#* 7.360 0.013 FS/% 49.645±6.868 44.205±12.157 30.197±5.342#* 5.405 0.029
3.统计学分析 采用SPSS 24.0软件对数据进行统计分析。计量资料以均数±标准差表示,三组间比较采用方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1.多普勒超声测量各组小鼠心脏结构与功能多普勒超声结果显示:各组小鼠室间隔厚度无明显差异;无论与对照组小鼠还是高脂组小鼠相比,高脂+低氧组小鼠左心室内径和左心室后壁厚度均增加,LVEF和短轴缩短分数均减少,提示CIH使ApoE-/-小鼠左心室扩张、心功能减低(图1,表1)。
2.免疫组织化学染色检测心肌内HIF-2α的表达 免疫组织化学染色可见HIF-2α在对照组小鼠的心肌组织中无明显表达,在高脂组和高脂+低氧组小鼠的心肌组织中均有表达(图2 A),高脂组和低氧组HIF-2α的阳性比例分别为(2.98±1.03)%和(10.94±1.68)%(图2 B),低氧组小鼠的心脏组织中HIF-2α水平明显高于对照组和高脂组(均P<0.05)。
3.蛋白免疫印迹检测 β3 AR在心肌组织的表达免疫印迹检测可见β3 AR在各组小鼠的心肌组织中均有表达,与对照组和高脂组小鼠相比,高脂+低氧组小鼠的心肌组织中 β3 AR表达量明显上调。高脂+低氧组、高脂组和对照组小鼠心肌组织GAPDH蛋白条带的吸光度值分别为(253 737.40±14 954.00)(256 692.25±6 584.46)和(266 384.00±31 306.30),各组间差异无统计学意义;β3 AR蛋白条带的吸光度值分别为(235 302.40±14 552.94),(173 631.25±7 014.01)和(140 720.33±2 976.35),P<0.05(图3 A~C)。
讨 论
OSA多发于肥胖人群,以夜间睡眠中反复发生上气道塌陷和CIH为首要病理表现。已有临床研究表明OSA可使无基础心脏疾病的肥胖患者心脏舒张功能减低[8]、促进心室重构[1],Warbrick等[9]发现,合并OSA的肥胖患者发生射血分数保留的心力衰竭的比例明显增加。基础研究[2]发现在CIH环境下,脂肪组织中HIF-2α表达明显上调,并参与心室重构,但是具体机制尚不明确。近年来,β3 AR因其具有调节钠钾泵、钙离子通道等作用而成为心力衰竭领域的研究热点,但是CIH是否会影响 β3 AR在心肌组织中的表达进而影响心功能尚不明确。本实验利用高脂饲料喂养ApoE-/-小鼠构建肥胖模型,在CIH刺激下探究其对小鼠心肌组织中HIF-2α和β3 AR表达及心脏功能的影响,为揭示CIH促进心力衰竭的具体机制提供实验依据。
在本实验中,我们以ApoE-/-小鼠为研究对象,通过高脂饮食喂养建立肥胖模型,发现与单一高脂喂养相比,CIH联合高脂饮食喂养8周后,ApoE-/-小鼠的左心室出现明显扩张、心功能明显下降,与既往临床研究[1]提示OSA促进肥胖患者心力衰竭进展的结论一致。在以上实验的基础上,我们进一步探究CIH对心肌组织中HIF-2α和 β3 AR表达的影响。
Lin等[10]发现肥胖小鼠的脂肪组织中HIF-2α明显上调,HIF-2α可能通过调节脂肪组织内的炎症反应促进心室重构,敲除脂肪组织中的HIF-2α可阻止心肌肥厚、心室重构的发生。本实验发现生理状态下的对照组ApoE-/-小鼠心肌组织中几乎不表达HIF-2α,但是CIH条件下,伴随着左心室扩张和心功能下降,心肌组织中的HIF-2α水平明显上调,据此我们推测HIF-2α在CIH诱导的心力衰竭中发挥一定作用。
已有临床试验证实给予β3 AR特异性激动剂米拉贝隆活化心肌组织中的 β3 AR,可改善慢性心力衰竭患者的预后[11];大量基础研究发现活化的β3 AR可以通过调节心肌细胞表面的钠钾泵、钙离子通道状态和心肌细胞内一氧化氮含量而维持心肌细胞的舒缩活性[12-14]。大量研究证实CIH可通过诱导心肌去甲肾上腺素水平增加,进而导致心肌细胞肥大、心室重构[1,15-17],Watts等[18]发现在去甲肾上腺素诱导的大鼠心肌细胞肥大的过程中,β3 AR基因表达增加、受体数量上调,其下游活性物质环磷酸鸟苷水平下降,给予β3 AR激动剂后,β3 AR受体数量减少、下游活性物质水平增加,心肌细胞表面积缩小。以上研究提示在心肌细胞肥大、心室重构的病理进程中,存在β3 AR活性下降、数量代偿性增加的病理改变。本实验同样发现在CIH刺激下,ApoE-/-小鼠心肌组织中 β3 AR的蛋白含量明显增多,提示CIH使β3 AR活性受损进而引起该受体数量的代偿性增多。另外有研究发现在脂肪组织中HIF-2α可调节 β3 AR活性[19],但是在CIH诱导心室肥厚的病理进程中,是否同样存在HIF-2α对β3 AR活性的靶向抑制作用,仍需要进一步探究。
综上所述,本实验发现CIH上调心肌组织中HIF-2α和β3 AR表达,引起左心室扩张、心功能受损。HIF-2α和β3 AR有望成为预防肥胖合并OSA患者发生心力衰竭的重要靶点。

