蓝光对老年小鼠角膜上皮组织和泪膜功能的影响
袁晴 李娟 刘康成 叶蕾 李清海 刘钰鑫 闵幼兰 邵毅
(1南昌大学第一附属医院眼科,江西 南昌 330006;2西安市第四医院眼科)
研究证明发光二极管(LED)会对眼部造成损伤〔1〕,包括眼表和眼底的各个组成部分,虽然可采取一定的保护措施,但仍不能完全避免其带来的损伤〔2〕。蓝光属于LED构成元素中的一种,波长380~500 nm,用于治疗新生儿黄疸〔3〕,但蓝光对眼睛有害。本文旨在探讨蓝光对老年小鼠的泪膜和上皮细胞的影响。
1 材料与方法
1.1实验动物及分组 选取24只BABL/c老年雄性小鼠(体重20~25 g,24~28周龄,西安交通大学医学院实验动物中心提供),均为无特定病原体(SPF)级,实验前先在裂隙灯显微镜下观察有无角膜异常,整个实验过程均在标准环境下饲养〔4〕。将24只老年小鼠随机分为两组,A组不进行任何处理,B组持续照射蓝光,分别于干预前、干预后1、4、7 d行泪液分泌测试(SIT)、泪膜破裂时间(BUT)检测,实验第7天行角膜荧光素染色(FL),取所有小鼠眼球做透射电镜及切片苏木精-伊红(HE)染色,观察角膜上皮损伤情况。本次研究实验符合动物伦理委员会要求〔5〕。
1.2蓝光笼制作 鼠笼顶部安置两根蓝光灯管(波峰430 nm,半波宽约20 nm,蓝光强度2.635 mW/cm2),留出喂食通道,鼠笼四周贴上反光的镜面纸,为防止灯管产热对实验造成误差,装置排风扇,底面放置垫料。
1.3SIT 首先将泪液检查酚红棉线(天津晶明新技术开发有限公司)剪成1.5 cm长,剪棉线时注意保证边缘整齐,以免因粗糙刺激角膜而影响实验数据。左手抓稳老年小鼠并固定头部,使其眼睑处于自然状态,右手持镊子夹住棉线一端,将另一端置于小鼠内眦处并保持姿势固定,15 s后取出棉线拉直,用游标卡尺读出棉线浸湿的长度并记录。保证由同一操作者在相同环境(温度、湿度、时间、光照强度)下完成测试。
1.4BUT 参照文献的方法〔6〕,将1 μl 10 g/L的荧光素钠用移液枪滴入老年小鼠眼表,并辅助其瞬目,此刻的荧光素钠已经很好地附着在眼表,然后在裂隙灯显微镜的钴蓝光下观察并记录小鼠角膜染色区出现第一个黑斑的时间,即为泪膜破裂时间,注意移液枪的枪头不要触及小鼠眼表,以免造成不必要的损伤而影响实验结果。
1.5FL 给小鼠滴1滴1%荧光素钠滴眼液,辅助其瞬目,评分系统参考文献标准〔7〕,无任何染色为0分,轻微散点状着染<30个点为1分,点状染色≥30点,但未发生融合为2分;浸润弥漫性染色,没有斑块为3分;有荧光素斑块为4分。
1.6角膜HE染色 将老年小鼠的角膜制成冰冻切片,晾干,于冰丙酮中固定后冲洗,进行HE染色3 min,着色后冲洗,放入1%盐酸酒精中分化并冲洗,伊红染色,漂洗,分别在70%、80%、98%、100%酒精中脱水,二甲苯透明2次,晾干,树胶封片。在显微镜下观察老年小鼠角膜上皮细胞的情况。
1.7透射电子显微镜(TEM) 收获角膜标本并在2.5%戊二醛和4%多聚甲醛的PBS溶液(pH=7.4)中固定2 h。将角膜标本包埋、切片和染色后用TEM显微镜(JEM2100HC,JEOL,Tokyo,Japan)拍摄TEM图像。
1.8统计学方法 采用SPSS17.0软件进行χ2检验、重复测量方差分析、LSD-t检验。
2 结 果
2.1SIT结果 干预前两组SIT差异无统计学意义(P>0.05)。实验第1天,与干预前相比两组SIT差异无统计学意义(P>0.05),两组间差异无统计学意义(P>0.05)。干预后4、7 d,A组与实验前相比SIT差异无统计学意义(P>0.05),B组与实验前相比SIT显著降低(P<0.05),且B组SIT明显小于A组(P<0.05),见表1。

表1 两组干预前后SIT比较
与干预前比较:1)P<0.05;下表同
2.2BUT结果 干预前,两组BUT差异无统计学意义(P>0.05);干预后1 d,两组与实验前相比BUT差异无统计学意义(P>0.05),两组间BUT差异无统计学意义(P>0.05);干预后4、7 d,与实验前相比,B组BUT明显降低(P<0.05),且B组BUT明显小于A组(P<0.05),见表2。

表2 两组干预前后BUT比较
2.3FL结果 干预前,两组FL评分差异无统计学意义(P>0.05);干预后1 d,两组与实验前相比FL评分差异无统计学意义(P>0.05),且两组间FL评分差异无统计学意义(P>0.05);干预后4、7 d,A组与实验前相比,FL评分差异无统计学意义(P>0.05),而B组出现大量斑块着染,差异有统计学意义(P<0.05),且B组FL评分明显大于A组(P<0.05),见表3。
2.4HE染色结果 A组角膜上皮由4~6层上皮细胞组成,细胞排列整齐紧密,无缺损;B组角膜上皮层数未见明显增加,基底细胞层为单层柱状上皮,角膜厚度未发生明显改变,表层上皮未见脱落、损伤,表面光滑(图1)。两组上皮细胞层数差异无统计学意义(P> 0.05);A组上皮空泡细胞数显著大于B组(P<0.05),见表4。
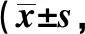
表3 两组干预前后各时段角膜FL评分分,n=24)

图1 两组角膜HE染色(×400)

表4 两组干预后角膜HE染色及电镜结果对比
2.5TEM结果 A组上皮细胞界限分明,明亮细胞较多,微绒毛和褶皱排列整齐,未见明显异常;B组上皮细胞形态未见异常,大小均匀等,边界较清晰,微绒毛和褶皱排列整齐,微绒毛数量减少,但与A组比较差异无统计学意义(P>0.05),见表4、图2。

图2 两组角膜TEM图像(×10 000)
3 讨 论
LED因其低耗能、照明强而在市场上占据越来越大的地位,而对眼睛造成的损伤不容忽视〔8〕,会导致近视、白内障等眼部疾病〔9〕。同时也有研究表明强光、激光照射会促进脉络膜新生血管形成,损伤视网膜结构与功能〔10~12〕。LED包含红、蓝、绿3种不同波长的光,其中蓝光波长介于380~500 nm之间,而角膜仅能吸收295 nm以下的可见光〔13〕,故蓝光可能会对角膜造成损伤。大气中的紫外线为不可见光,波长小于400 nm,当眼球过度吸收紫外线时,发现患白内障的概率大大增加〔14〕。当然,并不是所有的蓝光都对人体有害,蓝光中存在低能量部分是可以起到保护作用的〔15〕,可以刺激黑色素细胞而调节人体的昼夜规律〔16〕,但蓝光中的高能部分(波长415~455 nm)同紫外线一样,会对眼球造成损伤,致使视网膜细胞凋亡,发生黄斑变性等〔17~20〕,而这些高能蓝光主要存在于电子产品中,如智能手机、平板电脑等。氧化应激反应和细胞凋亡在干眼症发病中起关键作用〔21〕,而蓝光具有促进氧化应激的作用〔22〕。研究表明,过度暴露于具有短波长的蓝光下可引起角膜氧化,增加角膜及泪膜中炎症因子的表达,如白细胞介素(IL)-1β,IL-6,通过核因子(NF)-κB和丝裂原活化蛋白激酶信号通路,形成氧化应激产物,导致角膜上皮细胞DNA损伤,从而导致上皮细胞凋亡、杯状细胞减少及黏蛋白表达紊乱,继而造成泪膜损伤导致干眼症〔23〕。
本研究使用小鼠为研究对象是因为其眼表和人相似,角膜上皮细胞均由外胚层发育而来,将角膜分层,使之处于非角化状态〔24〕。眼表的腺体分泌受中枢神经系统调控,当泪膜损伤,眼表的光滑度则变差,中枢神经系统的调控作用会随之下降〔25〕,因此,保护泪膜的稳定性显得尤为重要。泪膜从外到内分别为脂质层、水液层、黏蛋白层,厚度约3 μm,很容易发生损伤。泪膜的主要功能是维持眼表水分稳定〔26〕,对获取清晰视力起到了不可或缺的作用,当眼表水分丢失时,泪膜功能受损,导致眼部出现的各种不适症状称为干眼综合征〔27〕。主要表现为眼部不适、异物感、视疲劳、视物模糊等症状〔28,29〕。因此,有效地保护泪膜对降低干眼症的发病率起到了重要作用。导致干眼的因素有很多,如吸烟、维生素缺乏和性激素失调等〔30~32〕。本实验可能时间较短,尚未累及到角膜上皮细胞,同时,没有设置不同的光照梯度,分组较少,对比不够强烈。当然,蓝光的功率也需要进一步探索。因此认为,短期蓝光照射会影响老年小鼠泪膜功能的稳定性,而对角膜上皮组织未造成损伤。本实验显示蓝光对泪膜的稳定性产生影响,而干预后7 d HE染色与正常对照组结果无明显差异,透射电镜未见明显异常,推测可能实验时间较短,尚未累及到角膜上皮细胞。
综上,高能蓝光照射会影响老年小鼠泪膜的稳定性。但由于本实验蓝光照射的时间较短,对角膜上皮的影响无法进行较好的观察。而且研究并未对蓝光的能量设置较好的梯度,也就无法判断各个能量梯度的蓝光对泪膜的稳定性及角膜上皮的影响程度。今后可进一步加长蓝光照射的时间及设置不同的照射强度。另外,蓝光损伤眼表与结膜杯状细胞的黏蛋白分泌、眼睑腺体(如睑板腺和泪腺)形态变化而导致的泪膜黏蛋白层和脂质层成分改变等是否有一定的关联也需进一步研究。值得探究的是,蓝光照射是否是一个可逆的过程,去除蓝光暴露的条件,老年小鼠的泪膜是否可以有所恢复甚至恢复正常,有待进一步研究。

