磁共振扩散加权成像表观扩散系数评估肝癌患者TACE疗效
章李,彭志毅
1.浙江大学医学院,浙江杭州310058;2.浙江大学医学院附属第一医院,浙江杭州310003
前言
肝细胞癌是常见消化系统恶性肿瘤危害性较大的一类。近年来,其在我国的发病率及死亡率逐渐上升。据最新的统计显示,肝癌已上升为我国第2位的癌症病死病因[1]。经导管肝动脉栓塞术(Transhepatic Arterial Chemoembolization, TACE)是目前临床不可切除肝癌、晚期肝癌局部治疗的常用标准治疗方法[2]。磁共振扩散加权成像(MR-DWI)目前在临床中广泛应用,其在肝细胞癌TACE后疗效评价中的作用已得到广泛重视[3]。本研究在对比肿瘤组织TACE 治疗前后表观扩散系数(ADC)值基础上,跟踪对比研究不同疗效治疗前后ADC 值及治疗后1个月和3个月患者ADC值变化情况,探讨磁共振扩散加权成像表观扩散系数在肝癌患者TACE 后化疗效果评估中的价值。
1 资料与方法
1.1 一般资料
选取浙江大学医学院附属第一医院2014 年6 月至2018 年3 月间收治的肝细胞癌患者52 例,病灶共计79 个,所选择的患者均按照《原发性肝癌诊疗规范》(2011版)确诊。患者中男性32例,女性20例,年龄29~78 岁,平均年龄(59.1±9.3)岁,其中肿瘤直径1.1~10.5 cm,平均直径(4.6±2.1)cm,共计进行TACE161 次。整个研究在患者的知情同意下完成,并经过本院伦理委员会批准。
1.2 方法
1.2.1 TACE 基础治疗药物组成及剂量:顺铂20 mg+吡柔比星20 mg+丝裂霉素2 mg+48%超液化碘油10 mL。在治疗过程中,根据患者肿瘤大小及分布位置增加或者减少某种或几种化疗药物的使用剂量,同时根据不同患者身体状况和肝功能变化制定个体化化疗方案,按照总体上药物剂量低于3倍基础量控制药物总量。
1.2.2 MR-DWI仪器与方法 在治疗前、治疗后、治疗后1 个月、治疗后3 个月分别进行MRI 检查,治疗前后分别测定肝脏正常组织和肿瘤组织的ADC值。检查和测定仪器选择西门子公司生产的AVANTO 1.5T MRI,检查时常规行MRI,DWI 序列扫描,利用该仪器自带的软件测量所有患者ADC 值,测量时手动勾画每层肿瘤区域的感兴趣区。所有患者检查资料均由2名具有5年以上资质的影像医师分别判别,得出诊断结论。治疗后1个月、治疗后3个月分别对肿瘤组织区测定ADC 值,判别肿瘤是否出现液化坏死和是否是肿瘤复发病灶。收集完整病例资料后分析观察所有患者在治疗前、治疗后、治疗后1个月、治疗后3个月ADC值变化情况。
1.3 疗效评定标准
根据患者治疗后肝脏存活病灶的改变进行判断,具体分级如下:疗效分为完全缓解(优良)、部分缓解(一般)和进展(差)[6]。完全缓解的分级标准为T1WI信号各不相同,T2WI出现均匀低或等信号,MRI增强扫描在早动脉期则无明显强化,DWI低信号,对患者跟踪随访2 次及以上,对比前一次肿瘤组织区DWI 信号特征无明显变化;部分缓解的分级标准为肿瘤组织区MRI增强扫描动脉期强化靶器官最大长径减少30%,在肿瘤组织治疗区出现碘油覆盖的缺失,T1WI、T2WI 信号各不相同,门静脉期及延迟期信号强度出现不同程度下降,在早动脉期强化的碘油末沉积处则呈现略高信号,DWI 影像出现不同程度的混杂信号;进展的分级标准为肿瘤组织内未出现碘油影像或仅有较少区域存在,信号强弱较治疗前无明显变化。
1.4 统计学处理
采用SPSS 18.0 for windows 软件进行统计学处理,患者各时期ADC 值采用均数±标准差表示,各组间和组内前后比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 正常肝组织与肿瘤组织ADC值比较
本组共分析TACE术后病灶79个,其中7个病灶碘油沉积完整,6 个病灶碘油沉积部分性缺损,28 个病灶碘油少量沉积,11 个病灶无或极少量碘油沉积。治疗前79 个肿瘤病灶ADC 值显著低于正常肝组织(P<0.05),治疗后肿瘤病灶ADC 值显著高于正常肝组织(P<0.05),见表1。
2.2 治疗前后肝肿瘤组织ADC值变化
治疗后患者肿瘤组织ADC 值为(1.48±0.16)×10-3mm2/s,显著较治疗前升高(P<0.05),治疗前后正常肝组织无明显变化(P>0.05),见表1。
表1 肝癌患者TACE前后不同组织ADC值比较(±s,×10-3 mm2/s)Tab.1 Comparison of apparent diffusion coefficient(ADC)values of different tissues before and after transhepatic arterial chemoembolization(TACE)in patients with liver cancer(Mean±SD,×10-3 mm2/s)
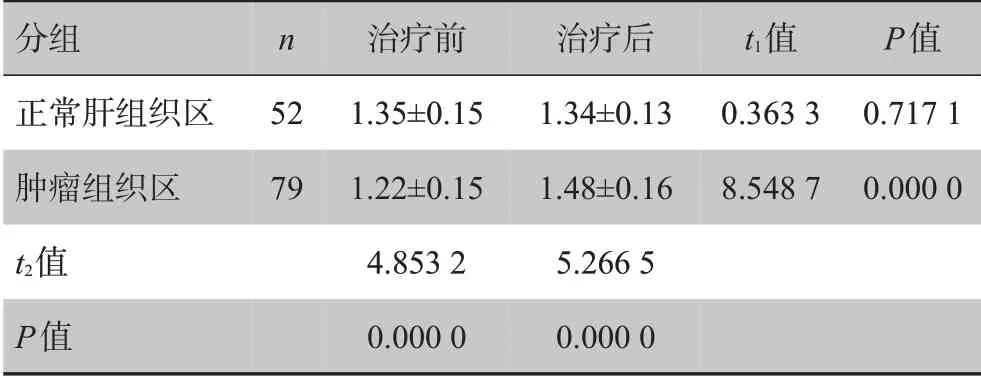
表1 肝癌患者TACE前后不同组织ADC值比较(±s,×10-3 mm2/s)Tab.1 Comparison of apparent diffusion coefficient(ADC)values of different tissues before and after transhepatic arterial chemoembolization(TACE)in patients with liver cancer(Mean±SD,×10-3 mm2/s)
分组正常肝组织区肿瘤组织区t2值P值n 52 79治疗前1.35±0.15 1.22±0.15 4.853 2 0.000 0治疗后1.34±0.13 1.48±0.16 5.266 5 0.000 0 t1值0.363 3 8.548 7 P值0.717 1 0.000 0
2.3 肝癌患者TACE 治疗前后不同疗效肿瘤组织区ADC值比较
治疗后肿瘤组织区域ADC值升高程度优良组最明显,一般组次之,进展组最小,优良组和一般组治疗前后肿瘤组织区域ADC值比较差异有统计学意义(P<0.05),进展组治疗前后肿瘤组织区域ADC 值比较差异无统计学意义(P>0.05),见表2。
表2 肝癌患者TACE治疗前后不同疗效肿瘤组织区ADC值比较(±s,×10-3 mm2/s)Tab.2 Comparison of ADC values of different groups before and after TACE treatment for liver cancer(Mean±SD,×10-3 mm2/s)
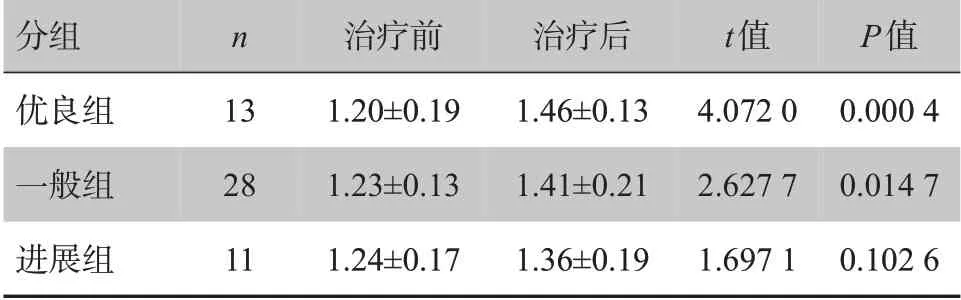
表2 肝癌患者TACE治疗前后不同疗效肿瘤组织区ADC值比较(±s,×10-3 mm2/s)Tab.2 Comparison of ADC values of different groups before and after TACE treatment for liver cancer(Mean±SD,×10-3 mm2/s)
分组优良组一般组进展组n 13 28 11治疗前1.20±0.19 1.23±0.13 1.24±0.17治疗后1.46±0.13 1.41±0.21 1.36±0.19 t值4.072 0 2.627 7 1.697 1 P值0.000 4 0.014 7 0.102 6
2.4 肝癌患者TACE 后不同疗效肿瘤组织区ADC 值比较
一般组患者治疗后3个月肿瘤组织区ADC值较治疗后1 个月降低,差异有统计学意义(P<0.05),优良组与进展组治疗后3个月肿瘤组织区ADC值与治疗后1 个月比较差异无统计学意义(P>0.05),见表3。治疗后1个月和3个月各组间两两比较差异均有统计学意义(P<0.05),3 组比较差异有统计学意义(P<0.05)。
表3 肝癌患者TACE后不同疗效肿瘤组织区ADC值比较(±s,×10-3 mm2/s)Tab.3 Comparison of ADC values of different groups after TACE for liver cancer(Mean±SD,×10-3 mm2/s)
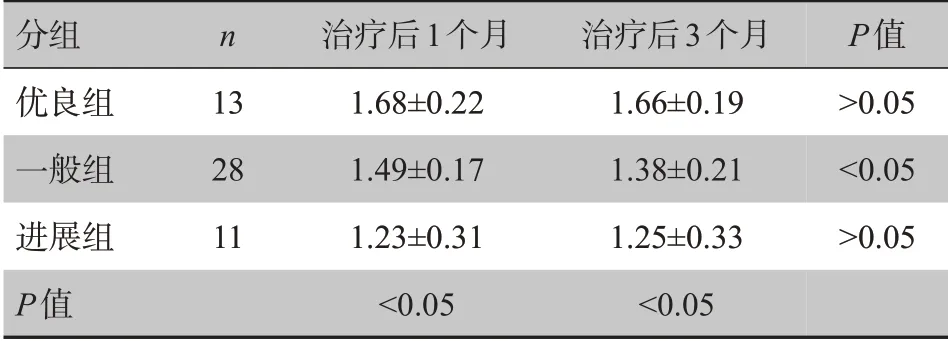
表3 肝癌患者TACE后不同疗效肿瘤组织区ADC值比较(±s,×10-3 mm2/s)Tab.3 Comparison of ADC values of different groups after TACE for liver cancer(Mean±SD,×10-3 mm2/s)
分组优良组一般组进展组P值n 13 28 11治疗后1个月1.68±0.22 1.49±0.17 1.23±0.31<0.05治疗后3个月1.66±0.19 1.38±0.21 1.25±0.33<0.05 P值>0.05<0.05>0.05
3 讨论
肝细胞癌是原发性肝癌的主要类型,占90%左右,作为严重影响我国人民健康的主要疾病,其每年病死人数高达11 万[7-8]。但是由于其发病隐匿,恶化程度高,患者很难得到早期确诊及治疗,大部分患者在确诊时已经失去最佳手术机会[9]。相较于全身化疗,TACE 可提高肿瘤组织局部的药物浓度,使得大部分化疗药物能直接作用于肝脏肿瘤组织,仅有小部分进入循环系统,可提高化疗的疗效,同时还可栓塞肿瘤营养血管,切断肿瘤组织的血供,抑制肿瘤的生长,最终达到清除肿瘤的目的[10-11]。MR-DWI是目前临床唯一用于检测人体组织内水分子扩散运动的技术[12],通过MR-DWI 测量ADC 值可以量化地反映患者肿瘤病变的进展情况,其在肝脏肿瘤的应用已有广泛研究,但是研究结果却差异较大,特别是在肝脏良恶性肿瘤ADC 值之间的差异存在诸多结果,肝细胞癌早期出现程度较轻范围较小的脂肪变性,肿瘤细胞中发现少量脂肪变性细胞夹杂,MRI 检查很难发现[13]。既往研究也发现其具有特征性影像学表现,包括肝癌病灶多位于肝脏边缘、脂肪变性细胞在病灶周围区域以斑片状形式散在分布、具有“快进快出型”强化影像表现等[14]。
本研究中治疗前79 个肿瘤病灶ADC 值显著低于正常肝组织,这可能与肝癌肿瘤组织中水含量增加有关,含水量增多导致水分子自由扩散运动受限。TACE后化疗药物引起肿瘤血管栓塞,导致组织缺氧、缺血,同时细胞膜通透性增加,使细胞中结合水分子减少,在影像检查中就会出现ADC 值增加[15]。TACE 治疗后不同疗效患者之间ADC 值比较:完全缓解和部分缓解患者组治疗前后肿瘤组织区域ADC值均增加,治疗后1个月和治疗后3个月不同疗效患者组间之间两两比较差异均有统计学意义,TACE 促使肿瘤区域细胞发生液化性坏死,肿瘤细胞细胞膜破裂,使得肿瘤组织细胞数量减少,组织其中的水分子运动不再受到限制,而在肿瘤活性组织或再发组织区,在MR-DWI上会表现出高信号,与前面相反,在这些区域局部细胞增多,密度增大,水分子运动就会受到限制,同理,在同时存在肿瘤活性组织和完全坏死的肿瘤组织的碘油沉积区,MR-DWI上信号则较为复杂,其中等信号、低信号和稍高信号均有表现[16-17]。本研究结果显示不同疗效组别患者ADC 值变化差异显著,说明ADC 值可以评估TACE疗效。
本研究证实MR-DWI 在肝细胞癌TACE 疗效的评估中有较好的参考价值,但同时我们也认识到其在小病灶检出的局限性,因MR-DWI较低的分辨率,使得图像比较模糊,且MR-DWI 成像容易产生图像变形及伪影,测量出准确的ADC 值有一定困难,同时,由于存在个体差异,不同b值适用于不同患者,可能增加成像难度,在缺乏规范性和标准化的扫描参数和后期处理方法的实际下,目前MR-DWI 及ADC值在肝癌治疗后的疗效评估中可作为一种有效的补充手段。

