腰椎管狭窄症的治疗进展
王坤 梅伟
腰椎管狭窄症(lumbar spinal stenosis,LSS)是指腰椎管由于骨性或纤维性结构异常增生等原因导致管腔各经线缩小,最终神经血管在狭窄的空间内受到挤压而出现一系列临床症状。LSS是导致腰痛和下肢麻木的常见原因之一,也称为腰椎椎管狭窄综合征[1]。一般来说,在休息或者蹬自行车时没有不适症状,而在步行或站立一段时间后会逐渐出现腰部酸困、下肢疼痛、麻木无力等不适,只有坐下休息一段时间后才能继续行走,即间歇性跛行。随病情进展,病人步行的距离逐渐变短,每次休息的时间也逐渐延长。腰椎的退行性变多始于椎间盘,退变的椎间盘压迫神经根、硬膜囊、马尾神经等重要结构;同时,椎间盘退变后,其含水量减少,椎间高度会部分丢失,高度丢失会引起椎间不稳,关节突关节负荷加大,进而发生代偿肥大及结构紊乱,黄韧带也会发生肥大、松弛皱褶,最终导致椎管内神经受压,出现一系列临床症状[2]。老年人发病率较高,有学者研究表明日本LSS的总体发病率约为5.7%,且患病率随年龄增长而增加[3]。随着我国人口老龄化趋势的进展,LSS病人逐年增多,严重影响病人的日常生活,问题严峻,亟待解决。
当病人出现腰腿痛、神经源性间歇性跛行等症状时,则需要进行治疗。治疗的目的是缓解症状,维持和改善日常活动。对于一些病人,非手术治疗可以很好地改善症状;而对另一部分病人,经过非手术治疗仍然不能从事日常活动或工作,则应考虑手术治疗。
一、文献检索策略
本文通过中文检索词“腰椎”、“椎管狭窄”、“手术”、“非手术”、“治疗”、“脊柱融合术”以及英文检索词“lumbar spine”、“spinal stenosis”、“operation”、“surgery”、“non-operative”、“non-surgery”、“spinal fusion”在中国知网、万方数据库、维普数据库、PubMed、Embase等平台进行检索,筛选发表时间为近二十年内,共检索到文献1 227篇。应用EndNote删除重复及无法获取全文的文献852篇,通过浏览文题、摘要、全文后排除非中文或英文文献、质量或证据等级较低的文献,最终共计纳入文献47篇,其中中文文献21篇,英文文献26篇(图1)。
文献纳入标准为:与LSS相关的回顾性研究、前瞻性研究。文献的排除标准为:①同一研究的阶段性数据;②无法获取全文或仅有摘要的文献;③文献质量或证据等级较低的研究;④非中文或英文文献。
二、LSS的非手术治疗方法
LSS治疗的主要目的在于缓解病人临床症状,且非手术治疗通常作为退变性腰椎管狭窄症病人确诊后的首选治疗方案。通过非手术疗法,能减轻局部组织水肿及炎症反应,解除肌肉痉挛[4],从而减轻、延缓临床症状并恢复功能。当前,非手术疗法主要有:药物治疗、物理治疗和硬膜外注射治疗。
(一)药物治疗
药物治疗可以减轻疼痛及局部组织的无菌性炎症并滋养神经组织。Onel等[5]报道了145例LSS病人行综合药物治疗后,70%的病人症状有明显改善,另有23%的病人病情发生轻微好转,这说明药物治疗是有效的。目前常用于缓解及治疗LSS疼痛症状的药物有:①非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs),如塞来昔布、布洛芬、艾瑞昔布等;②营养神经类药,如维生素B12、甲钴胺等;③消除水肿类药,如迈之灵、甘露醇、地塞米松等;④其他还有麻醉镇痛药、抗抑郁药、肌肉松弛剂、抗癫药及前列腺素类药等。但麻醉镇痛药含有吗啡成分,长时间用药不仅会产生头昏脑胀感,还会让病人产生依赖性,疗效逐渐降低,因此,这类止痛药不宜长期使用。抗抑郁药则对神经性疼痛非常有效,其副作用是产生昏睡感,并可损伤肝脏。Rodrigues等[6]采取前瞻性、随机、双盲、安慰剂对照试验评估口服皮质类固醇的方案治疗LSS的有效性,31例口服类固醇,30例给予安慰剂,并采取多种方式评估疗效,最终两组结果类似,说明口服皮质类固醇治疗LSS是无效的。
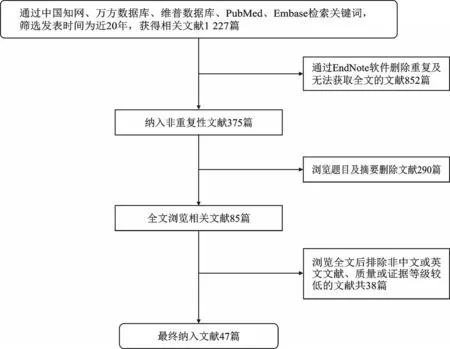
图1 文献筛选流程图
(二)物理治疗
常用的物理治疗方法有休息制动、有氧运动与姿势锻炼。休息时机体处于放松状态,可以不同程度地缓解腰肌痉挛从而减轻疼痛症状。腰部佩戴腰带或支具进行局部制动,有助于加强脊柱的稳定性,对伴有滑脱的椎管狭窄疗效较好,能明显改善不适症状。但腰部支具也不宜长期应用,应用过久会出现支具依赖性腰肌萎缩。
姿势锻炼的主要目的是增强腰背部肌肉的功能,主要通过背部伸肌和腹部屈肌的锻炼来加强其对腰部的支撑作用,以维持腰椎稳定状态,从而可减缓脊柱退变速度。Onel等[5]研究表明,腹肌加强后能自然地控制腰椎于过屈位,从而使椎管内有效容积增大,神经压迫减轻,静脉回流通畅,从而下肢症状得以缓解。另外,骨盆牵引可拉开椎小关节间和椎体间距离,减轻神经根的受压,减轻充血、水肿从而缓解临床症状[12]。
(三)硬膜外注射治疗
LSS及椎管内神经受到压迫,会导致脊神经根产生机械和化学损伤。而脊神经根的水肿和静脉充血会导致受压迫程度进一步加重,甚至出现缺血性神经炎及神经毒素的外渗。糖皮质激素具有强大抗炎效应,能降低白细胞的迁移,炎症因子释放减少,稳定细胞膜的正常状态。LSS应用硬膜外激素注射治疗有多年的临床实践,适用于有急性神经根症状或神经根源性间歇性跛行的病人。有研究表明,硬膜外类固醇注射短期内可提供较好的效果,并减少了一些可能需要手术的病人的手术需求[13]。另有卫沛然等[14]研究表明,LSS引起的神经根疼痛在硬膜外注射肿瘤坏死因子-α抑制剂后有所缓解或消失。硬膜外注射治疗为保守治疗争取了时间,尤其是对老年病人,仍不失为一种较为理想的手术治疗的替代手段。经过上述一种或多种联合非手术治疗,多数病人的临床症状在短期内可以得到控制,但仍没有足够的证据表明非手术治疗可获得长远效益。
三、LSS的手术治疗方法
非手术治疗虽然在一定程度上能够减轻或消除神经根和马尾神经的炎性水肿,实现“内减压”的目的,但并没有从根本上解决椎管狭窄,因此随着病人病史的延长,极有可能会再次出现症状并比以往时候更加严重[15]。手术是治疗LSS的有效方法之一,多数研究表明手术疗效确切[16],并且老年LSS病人也被认为适合手术治疗[17]。
(一)手术指征
一直以来,LSS的手术指征都存在一定争议,其主要手术指征包括:非手术治疗难以控制且病人难以耐受的严重疼痛;经2~3个月正规保守治疗,持续性下肢症状及进行性间隙性跛行未见有好转;严重神经根受压及进行性神经功能丢失;症状、体征与影像学表现一致的马尾综合征。
(二)手术方式
解除椎管内神经组织受到的压迫是外科治疗的目标。传统的减压术式主要有全椎板切除、半椎板切除,但其创伤大,对脊柱稳定性影响较大,由此,减少创伤以及微创减压术式应运而生。这些技术包括椎板间开窗术、椎间盘镜(microendoscopic discectomy,MED)技术、经皮椎间孔镜(Yeung endoscopic spine system,YESS&transforaminal endoscopic spine system,TESSYS)技术等等。
1.椎管减压术
减压是治疗LSS的基本原则和有效方法。减压手术在短期内疗效确切,对于减压方式应根据狭窄位置、责任节段、脊柱畸形或脊柱不稳进行选择。当前椎管减压术主要有:传统开放式椎板减压术、经显微内镜椎管减压术。
传统开放式椎板减压术主要包括:①全椎板切除术;②半椎板切除术;③椎板间开窗术。其中,全椎板切除减压术是切除责任节段双侧椎板暴露硬膜,然后行神经根管及其周围区域的扩大减压。主要适用于严重的中央型狭窄、多节段狭窄、运动节段有骨桥形成及欲行脊柱融合术者。由于该术式严重破坏了脊柱的后柱结构,因此术后常有腰椎不稳的报道[18],近年来主要与融合手术联合应用。半椎板切除术和椎板间开窗术对脊柱后柱的破坏则大大降低,手术创伤较小,减压彻底,既保证了疗效,又减少了并发症,可以作为有效选择。半椎板切除术应用后正中入路,把骶棘肌向两边牵拉,使病侧椎板尽可能暴露,切除棘突根部至椎弓根内侧缘之间的椎板,该术式主要适用于有单侧病变而对侧无症状者。该方法切除的腰椎后方结构较少,故在术后较全椎板切除术有较高的脊柱稳定性。椎板间开窗术所致手术创伤更小,故其对脊柱的稳定性比半椎板切除术还要小。但是,该术式对神经结构的显露不如椎板切除术,因此这就对术者的临床技术水平提出了较高的要求,否则会因减压不充分而致手术疗效降低。
近年来,随着微创理念的不断深入,以椎间盘镜、椎间孔镜为代表的微创新技术迎来了发展的热潮。经显微内镜减压术主要术式有MED、YESS和TESSYS技术。1997年,MED系统首次面世,在责任间隙经后正中切口进入,进行椎板开窗并植入工作通道,在椎间盘镜下为腰神经根减压。该术式可以完成椎板及内侧椎小关节切除、椎孔成形、侧隐窝减压等,从而获得一定程度的减压。切口缩小至约16 mm,只需在棘突的一边剥离肌肉组织,减小了对椎旁肌的损伤,术后残余腰痛等并发症发生率大大降低。术中仅咬掉少许椎板下缘,脊柱的正常稳定结构未遭破坏,故术后腰椎稳定性几乎不受影响。内镜下视野及组织辨识也更清晰,从而达到精准操作。吴习威等[19]进行了前瞻性、随机对照研究,采用后路椎间盘镜治疗LSS,发现采用椎间盘镜治疗后病人白细胞介素-1β、IL-6、C反应蛋白水平均较开放手术明显降低,即MED技术可以降低对病人的手术创伤。但是,MED手术操作空间有限,在对神经根管减压时,神经根的松解较为困难。
Yeung等[20]报道的脊柱内窥镜YESS技术是一种经Kambin安全三角区进入而行椎间盘减压的技术。它是一种“由内向外”进行椎间孔扩大减压成形的通道技术。该手术操作相对简单,容易学习,但其具有较窄的适应证,仅适用于单纯椎间盘组织突出或脱出的病人。
TESSYS技术是基于YESS技术发展而来,其是将椎间孔扩大后再进入椎管,具有更大的操作空间,对神经根的减压是在直视下完成的,从而更加安全有效。与YESS技术不同,TESSYS技术学习曲线长、操作难度大,容易损伤椎管内结构。程才等[21]应用TESSYS技术治疗LSS 65例,L3/411例,L4/539例,L5/S115例,优良率为90.8%(59/65)。根据每个LSS病人的具体实际来制定相应的减压策略,才能取得较好的疗效[22]。无论采用哪种手术方式,都要遵循减压手术的原则:①维持脊柱稳定性;②彻底减压。
2.融合内固定术
对于病情复杂的LSS病人,如合并有腰椎失稳、侧弯、滑脱及椎间盘突出等,Hansraj等[23]认为减压后进行融合是有意义的。融合可使脊柱维持相对稳定,脊柱的稳定状态是其一系列生理功能的基础,如发挥运动、支持和保护脊髓与神经根等。
伴随科技的发展,目前可供选择的术式包括:后外侧椎间融合术(posterolateral fusion,PLF)、后路椎间融合术(posterior lumbar interbody fusion,PLIF)、经椎间孔椎间融合术(transforaminal lumbar interbody fusion,TLIF)、微创经椎间孔椎间融合术(minimally invasive transforaminal lumbar interbody fusion,MIS-TLIF)、斜外侧椎间融合术(oblique lumbar interbody fusion,OLIF)、椎间孔外椎间融合术(extraforaminal lumbar interbody fusion,ELIF)等。椎间融合术可一定程度上恢复椎间高度,且融合率高,能较好地维持脊柱稳定性。
PLIF术通过在后路将椎板碎骨块植于椎体间,从而融合责任节段并有效维持一定椎间高度,临床疗效确切,是一种传统的经腰部后正中入路的椎间融合术式[24],被公认为LSS治疗的“金标准”,能明显缓解症状,促进神经功能恢复,但由于其剥离暴露明显,对椎旁肌、硬膜囊及神经根刺激比较大,故其术后残余症状较为明显。因此,又产生了其他各种入路的术式,以减少类似并发症。
TLIF术是在PLIF术基础上改良而来,该术式改进了PLIF术诸多弊端,具有一定的优势[25]。TLIF术通过切除部分关节突经椎间孔进入,相较PLIF术,不仅保留了棘上、棘间韧带及骶棘肌椎板附着点等后方张力结构,而且减小了对硬膜囊和神经根长时间牵拉刺激。TLIF术具有手术创伤小、出血少、医源性神经根损伤低[26],术后脊柱稳定性较高等优势。有研究[27,28]报道TLIF术式更容易到达椎板、黄韧带和小关节等后方结构处,较PLIF术更加保护韧带复合体等,有助于保持责任节段和邻近节段生物力学稳定性。其缺点和PLIF术相似,即与椎旁肌长时间牵拉收缩有关的椎旁医源性损伤。另外,其难以改变脊柱冠状位失衡、很难恢复脊柱生理前凸。Hunt等[29]研究发现TLIF术后约2.5%病人会出现对侧神经根症,分析认为其原因为:手术过程中,在一侧椎板扩张器辅助下植入椎弓根螺钉时会使对侧椎间孔发生楔形变,从而在对侧引起压迫。Hunt等[29]认为改用在棘突间使用撑开器可避免上述对侧椎间孔的楔形变,术中行肌电图或神经电生理监测,并置钉后进行对侧孔的探查也是有帮助的。
2002年,Foley等[30]报道了在管型通道辅助下进行的微创经椎间孔腰椎椎间融合术(MIS-TLIF)。该术式入路为多裂肌与最长肌之间的Wiltse间隙,肌肉组织被通道向四周均匀撑开,故椎旁肌肉受到更微小的损伤,后路结构大多完整保留,最大程度地维持了后路结构的稳定性[31],降低了术后腰背痛的发生率;研究表明,通道下MIS-TILF术与传统TLIF术疗效相同[32]。石义华等[33]应用改进的MIS-TLIF术治疗退行性腰椎疾病55例,腰椎间盘突出症突出并不稳30例,LSS病人17例,腰椎滑脱8例,经治疗末次随访时按改良MacNab标准评价疗效:优47例,良8例,疗效显著。虽然MIS-TLIF术有多方面技术优势,但其适应证有限,如对于多个节段病变、严重椎管狭窄、中央椎管狭窄及重度腰椎滑脱病人,手术风险及治疗难度均较高,不可为了一味地追求“微创”而盲目扩大手术适应证。
2012年,Silvestre等[34]报道了OLIF术,作为一种新型微创技术,该术式经左腹部侧前方的肌间隙进入腹膜外间隙,然后在腹膜后部主动脉与腰大肌前方之间的自然间隙直达病变椎体侧前方,与经腰大肌入路的直接外侧入路椎间融合术(direct lateral Interbody fusion,DLIF)相比,其入路为自然间隙,几乎不损伤腰大肌、腰丛神经等结构,从而术后屈髋无力、局部疼痛、大腿感觉异常等问题发生率大大降低。与TLIF术相比,OLIF术在治疗继发于腰椎退变滑脱的椎管狭窄时临床疗效相似,但OLIF术近期优势较突出,如术中创伤小、出血少,病人卧床时间及住院时间短等优势[35]。OLIF术属于间接减压,故减压作用有限,适应证比较局限。
近年来,随着数字化骨科技术的推进,谭军教授团队[36]借助数字化技术提出椎间孔外椎间融合术(ELIF)。ELIF术的入路较MIS-TLIF更靠外,其是经髂肋肌和多裂肌之间的自然间隙进入,不经下关节突,直接显露并切除引起神经症状的上关节突及病变椎间盘,最后植入融合器进行植骨融合,由于残余上关节突仍可与下关节突形成良好吻合,从而最大可能地维持脊柱稳定性。杨明杰等[37]研究发现ELIF与TLIF在都应用单侧固定时,ELIF具有更好的稳定性,但ELIF单侧固定的稳定性要低于TLIF双侧固定。ELIF手术单侧固定联合对侧经椎板关节突螺钉固定可明显提高其稳定性,在限定载荷范围内与TLIF双侧椎弓根螺钉固定相当。因此,ELIF是一种安全有效,同时更加微创的椎间融合术式。
3.非融合内固定术
融合手术是国内外广泛应用的治疗LSS的方法,但是经过融合术后,邻近节段退变(adjacent segment degeneration,ASD)速度明显增加[38],人们对腰椎退行性疾病的治疗理念逐渐发生变化,因此非融合技术应运而生。
应用较多的非融合技术有棘突间撑开系统和椎板间撑开系统,棘突间撑开系统又分为静态棘突间撑开系统和动态棘突间撑开系统。静态棘突间撑开X-STOP系统主要适用于LSS引起的轻度和中度神经源性间歇性跛行。其有效性优于保守治疗,与传统融合术相比则相对安全,是介于二者之间的的有效方法。Wallis系统动态固定治疗单节段LSS的短期疗效较好[39]。Wallis适应证较X-STOP更为广泛,融合术后可防治邻近节段的病变。由于切除棘间韧带后才能将Willis植入,故其手术较X-STOP要复杂。Coflex系统适应证较Wallis系统更为广泛,适应于LSS需行减压术者,同样也可以用于腰椎长节段固定融合的相邻节段,以起到减缓邻近节段退变的作用。同其他棘突间固定物一样,Coflex也不适用于重度腰椎退行性变及重度腰椎滑脱病人。经椎弓根动态稳定(Dynesys)系统在国内外开展已有20余年,对其研究多以单中心的回顾性研究为主,有研究结果显示Dynesys系统可以保留部分椎间活动度,对邻近节段影响小,具有满意的中远期临床疗效[40]。刘广武等[41]研究表明,应用Dynesys系统在治疗腰椎退变性疾病方面可获得良好的早期临床疗效,病人生活质量明显改善,同时并发症发生率较低。Wu等[42]通过将Dynesys非融合技术与传统融合术比较,发现Dynesys系统在改善腰椎失稳和盘源性腰痛方面与传统手术等效,在腰椎活动度的维持方面要优于传统手术。另有研究报道其临床短期疗效不理想,且其椎弓根螺钉有断裂、松动、脱出等情况发生[43,44]。
随着棘突间撑开装置应用的增多,其缺陷也逐渐显露,如装置陷入棘突中、生物力学变化导致棘突骨折等。近年来,针对上述缺陷,IntraSPINE作为一种椎板间动态稳定系统应运而生并被引入国内,对于小关节突综合征、腰椎间盘突出症、软性椎间孔狭窄、椎间盘切除术后防止椎间隙塌陷等方面,可将其作为一种新的选择。作为一种动态固定方法,其可以最大限度保存责任节段活动度,使邻近节段应力较传统融合术明显减小,从而邻近节段不会出现明显的退变。该装置置入椎板间,比棘突间固定装置更靠前,更加接近脊柱生理旋转中心,具有独特的恢复椎间孔高度和改善节段稳定性等优势[45]。IntraSPINE引入国内虽已6年余,但目前为止,国内只有为数不多的几家医院开展了此项技术,样本量还不够充足且多为回顾性研究。
有研究表明,Dynesys技术及棘突间撑开装置应用后ASD还时有发生[46,47]。因此,我们应谨慎对待腰椎非融合技术的应用,其是否能获得长期稳定的脊柱动态内固定,尚缺乏多中心、前瞻性、随机对照、大样本等研究来证实。
四、讨论与展望
当前的许多治疗都缺乏可靠证据的支持,即使是减压、融合手术也没有达到完美的阶段,依然存在各种潜在风险。对于不同的LSS病人,虽然其有不同的疾病演变特点,但初诊时一般都首先考虑行正规保守治疗,以改善其疼痛和功能障碍等。对于规范保守治疗得不到预期效果的病人,则需要进一步考虑手术治疗,当前手术治疗的发展方向是有限化和微创化,兼顾减压效果、脊柱稳定性及其自然生物力学特征。另外,随着国内人口老龄化的加速,65岁以上退变型LSS病人逐年增加,但是还没有一种方法可以针对性地考虑老年群体病人的具体情况。我们认为,将适合年轻病人的治疗策略大量应用于老年病人是不科学的。退变性LSS多发生于老年人,由于老年人的身体和心理素质均有不同程度的下降,他们的肌肉、血管等状况较差,脊柱生理发生了老化,因此,最好的治疗方式应该是适应年龄的治疗,在手术后最大限度地保持老年病人的独立性,即治疗方法要因人而异,这一点值得国内外同行深思。