整合素-β3与雌、孕激素受体在子宫腺肌病中的表达及临床意义
贺凌云 朱炜 罗君玲
子宫腺肌病广义上是指子宫内膜的腺体及部分间质侵入子宫肌层,进行性生长,合并出血,致子宫肌层局部或广泛增大的一种预后良好的疾病,临床表现为经量持续增多、经期延长和或继发性、进行性加剧的痛经,痛经率甚至高达64.8%~77.8%[1]。其具有粘附、侵袭及转移等类似于恶性肿瘤的生物学特性。目前该病发病率呈上升趋势,但发生原因与机制并不十分清楚。本研究拟探讨整合素-β3及ER、PR在子宫腺肌病中的表达并分析其意义。
1 材料与方法
1.1 研究对象选取我科2013年6月~2014年12月因子宫腺肌病行子宫切除或腺肌病病灶切除的患者46 例,年龄42~47 岁,平均(44.58±3.82)岁;另选取同时期宫颈CINⅢ及宫颈原位癌全子宫切除后宫体部获取的正常子宫组织的患者20 例,年龄44~49岁,平均(46.55±2.86)岁。病理诊断均为我院两名副主任医师以上医生诊断。全部研究对象的病理及临床资料完整,术前6 个月内未使用过甾体类药物。该研究经伦理学委员会批准,患者知情同意。
1.2 研究方法
1.2.1 标本收集及处理 子宫腺肌病患者在子宫切除及腺肌病病灶切除后随即切取病灶组织1cm×1cm×1cm 大小;宫颈CINⅢ及宫颈原位癌患者在子宫切除后,在宫体部切取1cm×1cm×1cm大小的正常子宫肌层组织。取材后立即放入4%中性甲醛中固定72h 后脱水包埋,每一个组织块均先进行HE 染色,进行筛选,明确诊断后进行免疫组化染色,分别用于检测整合素-β3及ER、PR的表达。
1.2.2 免疫组织化学染色 采用链菌素亲生物素-过氧化物酶法(streptavidin peroxidase,SP 法)检测标本中整合素-β3及ER、PR的表达。鼠抗人整合素-β3单克隆抗体及兔抗人ER、PR单克隆抗体均购自福州迈新生物技术有限公司。以PBS 液代替一抗做阴性对照。具体操作步骤严格按照说明书进行。
1.3 结果判定整合素-β3 的阳性表达呈现黄色及棕黄色颗粒,在腺肌病病灶中主要定位于腺上皮细胞及间质细胞的胞浆中;而正常子宫肌层中主要表达于间质细胞的胞浆中,肌细胞中较少表达。ER及PR的阳性表达呈现棕黄色颗粒,在腺肌病病灶中主要定位于腺上皮细胞及间质细胞核中;在正常子宫肌层中仅间质细胞中表达。
应用Leica QW550 图像分析系统并采用阳性单位(positive unit,PU)对免疫组化染色的标本进行量化分析。在排除切片底色因素后,按灰度值将纯免疫组化反应的程度分为0~255 个等级,共计256个等级,每一个等级即为一个PU。PU 值的大小与阳性反应程度成正比[2]。
1.4 统计学方法采用SPSS 统计软件对数据进行处理。整合素-β3、ER 及PR 阳性表达的PU 值采用均数±标准差(±s)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
在子宫腺肌病病灶及正常子宫肌层中整合素-β3 及ER、PR 均呈现阳性表达,表现为黄色或棕黄色颗粒,其中,整合素-β3主要在腺肌病病灶中的上皮及间质细胞浆中,肌组织少见。但是,正常子宫肌层中表达于间质细胞胞浆,肌组织细胞中较少表达。ER及PR在腺肌病病灶中主要定位于腺上皮细胞及间质细胞核中,在正常子宫肌层中仅间质细胞中表达。
应用Leica QW550 图像分析系统并采用阳性单位(positive unit,PU)对免疫组化染色的标本进行量化分析,结果显示各部位表达的PU值不一致,见表1。整合素-β3、ER、PR与正常子宫肌层中表达均可见差异有统计学意义(P<0.05)。
表1 整合素-β3及ER、PR在子宫腺肌病病灶及正常子宫肌层中的表达(±s)
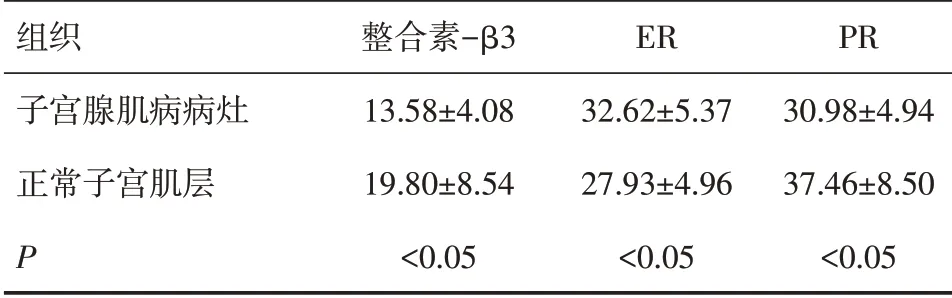
表1 整合素-β3及ER、PR在子宫腺肌病病灶及正常子宫肌层中的表达(±s)
组织子宫腺肌病病灶正常子宫肌层P整合素-β3 13.58±4.08 19.80±8.54<0.05 ER 32.62±5.37 27.93±4.96<0.05 PR 30.98±4.94 37.46±8.50<0.05
3 讨论
子宫腺肌病(adenomyosis)是子宫内膜腺体及间质组织侵入子宫肌层并在其中粘附、种植、浸润同时伴随新生血管的增生最终呈现弥漫性生长的一种疾病,其组织学形态表现为良性,但却具有恶性肿瘤的生物学特性。然而,有关子宫腺肌病发生的原因与机制仍不十分清楚。子宫肌层内的各种细胞因子、免疫因子、激素及其受体、酶及酶的抑制剂等,对其发生与发展均起着重要作用。有学者通过声脉冲辐射力成像技术诊断子宫腺肌病,认为超声声脉冲辐射力成像技术能实时敏感检测子宫腺肌病,可重复性好,同时能体现子宫腺肌病肌层病变随月经周期性的改变,有望成为子宫腺肌病诊断手段之一[3]。当前,对于该病的治疗包括曼月乐(左炔诺孕酮宫内缓释系统)、病灶切除、高强度聚焦超声刀治疗、腹腔镜辅助下阴式子宫全切术、LNG-IUS 治疗、芳香烃酶抑制剂、子宫动脉栓塞等治疗方法[4~12],但对于其与整合素之间的关系的研究较少,有学者认为子宫动脉栓塞治疗该病痛经的有效率为77.2%[13],同时,高强度聚焦超声消融治疗能改善有生育要求的子宫腺肌病患者的临床症状,且不增加妊娠及分娩时并发症的发生率[14],联合GnRH-a和(或)LNG-IUS能提高高强度聚焦超声消融治疗子宫腺肌病的疗效,降低复发率[15]。
子宫内膜腺体与间质脱离原来位置进入子宫肌层导致子宫腺肌病的发生,除内膜腺体与间质自身的因素,细胞外组织基质的异常对疾病的发生起着决定性的作用。在组织基质中存在着一种细胞因子即整合素。整合素是由α、β两个亚单位以非共价键连接组成的异二聚体跨膜糖蛋白,属于层粘连蛋白受体,存在于细胞表面,可粘附其他细胞和细胞外基质,它是细胞与细胞外基质间相互连接并传递多种生物学信号的通道,并在细胞粘附、生长、增殖与迁移中发挥重要作用[16]。当整合素合成不足或降解加速使其表达下降,即可影响其功能的有效发挥。本研究显示,子宫腺肌病与正常子宫肌层中整合素-β3均呈现阳性表达,其PU值为13.85±4.08与19.80±8.54,两组比较差异有统计学意义(P<0.05),表明子宫腺肌病病灶中整合素-β3 的表达下调,其功能减弱并由此导致细胞外基质降解及重建失调,出现细胞外基质疏松,粘附能力降低,内膜细胞间的连接减弱,稳定性发生紊乱,导致腺肌病病灶扩散而加速疾病进一步发展。子宫腺肌病为一种进行性加重的疾病,此机制也符合子宫腺肌病的临床特征。
子宫腺肌病是一种雌激素依赖性疾病,高水平雌激素是子宫腺肌病发生的重要危险因素[17]。雌激素可以使子宫内膜腺体与间质组织向肌层逆向生长,导致子宫腺肌病的发生,在此过程中雌激素需要通过与特异性的雌激素受体结合而发挥生物学效应[18]。孕激素作为一种维持子宫内膜周期性变化的重要激素,对子宫腺肌病的发生与发展起着重要作用,同样孕激素也需要与孕激素受体结合才能发挥作用。当子宫内膜腺体异位进入子宫肌层后也同样受到雌、孕激素的影响而产生相应的变化。本研究显示,子宫腺肌病病灶及正常子宫肌层中雌激素受体表达的PU值为32.62±5.37与27.93±4.96(P<0.05),表明子宫腺肌病病灶中雌激素受体的表达高于正常子宫肌层,而雌激素受体是反映雌激素调控状态与效能的重要指标[19]。高水平的雌激素受体可以结合高水平的雌激素而发挥作用,当子宫内膜腺体进入肌层后,在这种高水平雌激素环境的影响下增生更加活跃,移动、种植与生长加速,从而促进子宫腺肌病的发展。而孕激素受体在子宫腺肌病病灶及正常子宫肌层中也呈现阳性表达,其PU 值为30.98±4.94与37.46±8.50(P<0.05),表明在子宫腺肌病病灶中仍有较高水平的孕激素受体表达,提示异位进入肌层的内膜腺体也同样受到孕激素的影响而产生相应的变化。异位的子宫内膜腺体在雌、孕激素的共同作用下依然出现增生、分泌并出血的改变,继而加速子宫腺肌病的发展。同时,免疫组化分析结果也提示在子宫腺肌病病灶及正常子宫肌层中整合素-β3及ER、PR均呈现阳性表达,表现为黄色或棕黄色颗粒,其中,整合素-β3主要在腺肌病病灶中的上皮及间质细胞浆中,肌组织少见。但是,正常子宫肌层中表达于间质细胞胞浆,肌组织细胞中较少表达。ER及PR在腺肌病病灶中主要定位于腺上皮细胞及间质细胞核中,在正常子宫肌层中仅间质细胞中表达。说明3者可能在子宫腺肌病中相互作用,相关性机制需进一步探讨。
研究认为,整合素-β3在子宫内膜的表达受雌、孕激素的调控,雌激素对整合素-β3 的表达有抑制作用,而孕激素则诱导其表达,两者呈反向调节,相互协调平衡整合素-β3 在子宫内膜的正常表达[20]。本研究也显示,雌激素受体在子宫腺肌病病灶中的表达较正常子宫肌层上调,而整合素-β3 的表达则下调。当雌激素与受体结合后通过相应机制抑制整合素-β3的表达,使细胞间粘连松动,异位腺体细胞容易移动为子宫肌腺病的发生与发展提供了病理学基础。而孕激素受体的表达在子宫腺肌病病灶中的表达下调,对整合素-β3的促进作用减弱,整合素-β3 不能有效发挥作用,也促进子宫腺肌病的发展。
综合分析,我们认为,整合素-β3 与ER、PR 在子宫腺肌病的发病中起着相互促进的作用。研究该机制有助于我们采取更有效的治疗方案。

