Ni3S4花状分等级微/纳米结构及其在高性能超级电容器中的应用
吴俊凯,刘时雨,张志华,曹奇益,王 伟,陶 锋,王志俊
(安徽工程大学 机械与汽车工程学院,安徽 芜湖 241000)
近年来,随着全球经济的快速发展和环境污染的日益严重,为满足未来的能源需求,设计高效、清洁的储能转换装置成为日益迫切的问题[1]。超级电容器以其良好的循环稳定性、高功率密度、高电荷传输速率和低维护成本等优点,成为近年来最有前途的储能系统之一,引起了人们的广泛关注[2-3]。根据储存机理,超级电容器分为双电层电容、赝电容和混合电容器,其中双电层超级电容器将电荷存储在电极和电解液界面处的双电层中,而赝电容超级电容器是利用在电极界面上发生快速、可逆的氧化还原反应来储存能量。由于过渡金属氧化物(如Co3O4、MnO2、NiO、Fe3O4等)能够提供多种价态来提高氧化还原反应中的电荷移动,具有比双电层超级电容器更高(10倍以上)的储能特性,故赝电容超级电容器通常采用过渡金属氧化物为电极材料[4]。但是氧化物电极具有导电性差、电化学窗口较窄等缺点,严重影响了赝电容器的工作性能。为了解决这个问题,科学家们不断地探索成本较低、孔径分布适宜、比表面积高、电阻率低的新型电极材料。
近年来,人们发现过渡金属硫化物,如CoS、NiS、CuS等,具有非常复杂的结构及优良的物理化学性质,相比于其氧化物具有更高的比电容,可用作新型超级赝电容器电极活性材料[5-8]。此外硫元素具有较低的电负性,使得电子传输更容易实现[9]。由于超级电容器的储能能力主要是由电极材料的比表面积(SSA)、孔结构和杂原子掺杂效应决定,因此具有高比表面积和良好的导电性能的电极材料是进行能量存储的关键,也是决定超级电容器性能的核心影响因素。设计和开发具有高比表面积的过渡金属硫化物材料是当前的研究热点之一。Luo[10]等通过微波快速法制备了三维花状硫化钴纳米结构材料,在电流密度为1 A/g时其比电容达到了586 F/g。Wei[11]等发现α-NiS中空球在0.6 A/g下具有较高的比电容(562.3 F/g)。Li[12]等采用溶剂热法在石墨烯(G)纳米片上生长了CuS纳米片阵列,形成了CuS/G纳米复合电极材料,在0.2 A/g电流密度下其比电容为497.8 F/g。Wang[13]等合成了一种松球状硫化钴锰电极材料,该材料在电流密度为1 A/g时的比电容达到了992 F/g。同年Xu[14]等通过一步电沉积法在镍纳米线上生成了Ni-Co-S纳米片,在电流密度为0.5 A/cm时,其比电容达到了392.8 F/cm。
研究以硫脲和六水合氯化镍为原料,采用简单的水热法,在不同的pH值下,合成了3种不同形貌的硫化镍材料,分析了3种样品的成分和显微结构特征,并对比了3种不同硫化镍样品的电化学性能。结果表明具有高比表面积的花状分等级结构Ni3S4样品具有良好的电化学性能,在电流密度为1 A/g时,其比电容高达1 005 F/g。
1 实验部分
1.1 实验原料
六水合氯化镍(NiCl2·6H2O),分析纯(硫酸盐≤0.005%);氢氧化钠(NaOH),分析纯;氢氧化钾(KOH),分析纯;导电炭黑;聚偏氟乙烯(PVDF);N-甲基-2-吡咯烷酮(NMP)(国药集团化学试剂有限公司);硫脲(CH4N2S),分析纯(上海晶纯试剂有限公司);浓硝酸(HNO3),分析纯(上海振企化学试剂有限公司);碳布(日本东丽TORAY(TGP-H-060))。
1.2 样品的制备
实验所使用的试剂均未经过前处理或进一步提纯。根据配比分别称取2.37 g NiCl2·6H2O和0.76 g CH4N2S分别溶于10 mL去离子水。边搅拌混合,边逐滴加入5%稀硝酸溶液和1 mol/L氢氧化钠溶液调节溶液pH值至设定值(4、7、9),调节pH=4的过程中,混合溶液无明显现象发生;调节pH=7过程中,溶液中会产生少量浅绿色浑浊;调节pH=9的过程中,溶液中产生大量浅绿色浑浊。调节完pH后,将混合溶液装入密闭30 mL不锈钢反应釜内,填充率为80%,在180 ℃条件下水热反应12 h。最后将所得的产物分别用酒精和去离子水离心洗涤3~5次后,置于60 ℃的电热鼓风干燥箱中干燥12 h,所得样品分别标记为样品1、样品2和样品3。
1.3 样品表征
利用D8 FOCUSX-射线衍射仪(德国布鲁克仪器有限公司)检测样品的物相(Cu靶λ=0.154 18 nm,Ni滤波片,靶电压40 kV,靶电流60 mA,扫描范围为20°≤2θ≤80°,扫描速度为2°/min,步进角度为0.02°,积分计数方式,闪烁计数器)。产品的形貌用S4800型场发射扫描电子显微镜(FE-SEM,日本日立仪器有限公司)进行观察。加速电压分别为5.0 kV。
1.4 电化学性能测试
研究中电化学性能测试是在三电极体系中测试的,通过在三电极体系电解槽中的循环伏安法(CV)、恒流充放电法(GCD)和交流阻抗(EIS)对所制备样品进行电化学测试,使用的仪器是CHI760E电化学工作站。活性物质、导电剂(超导电炭黑)和黏接剂聚偏氟乙烯(PVDF)按质量比8∶1∶1在N-甲基-2-吡咯烷酮(NMP)中均匀混合,搅拌成均匀的状物涂在1 cm*1 cm碳纸上制成电极片,作为工作电极,以饱和氯化银电极为参比电极,铂丝电极为对电极,电解液为6 mol/LKOH溶液。循环伏安测试的电势范围为-0.1~0.4 V(以SCE为标准),扫描速率为5~50 mV/s。恒流充放电测试的电势范围为0~0.4 V,电流密度为1~5 A/g。交流阻抗测试在频率为10~100 000 Hz的条件下进行。所有测试均在常温下进行。
2 结果与讨论
2.1 材料的结构与形貌表征
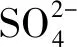

图1 不同pH值下产物的XRD谱
不同pH下产物的SEM图如图2所示。不同pH下产物的形貌有很大的区别。由图2a可知,pH=4时产物为厚片交叉堆积形成的类花状结构,宽约为6 μm左右。由图2b可知,当pH=7时,产物为薄片组装形成的微米花状结构,长度约为2 μm。相比于酸性条件下,当pH=7时,片的厚度明显减小,堆积的片层数明显增多。在酸性和中性条件下,都有明显的片状结构存在,表明在晶体生长过程中存在明显的择优生长。由图2c可知,在pH=9时,产物的形貌发生了明显的变化,产物为球状结构,直径约为300 nm,分散性较差。XRD和SEM结果表明,pH对最终产物的形貌有着重要的影响,随着溶液pH的增大,产物形貌、结构和物相均发生了明显的变化。硫脲是一种有机络合剂,在酸性条件下具有还原性质[16],在加热至60 ℃时,会发生水解反应。

(1)

图2 不同pH下产物的SEM图
酸性越强,硫脲越易水解,粒子进行快速形核并生长成立方相,有利于形成稳定的厚片堆积的Ni3S4结构[17]。随着pH增大至中性时,水解反应变弱,片结构变薄,使得片层间隙变大,堆积结构变疏松,形成规则的花状结构。pH进一步增大至碱性时,由于硫脲在碱性溶液中不稳定,易分解为硫化物和氨基氰:

(2)
生成的硫化物和Ni2+形成NiS沉淀,而氨基氰可转变为尿素[18]:

(3)
此外,碱性条件下,有利于Ni离子的扩散和沉积迁移[11],提高了镍硫比,使Ni∶S的比例趋于1∶1,物相转变为β-NiS,同时尺寸减小,形貌转化为球状纳米粒子。
2.2 电化学性能研究
(1)循环伏安测试(CV)。为了对比不同形貌和结构硫化镍的电化学性能,将3种不同pH下的样品制成电极,测试了不同扫描速度(5 mV/s、10 mV/s、20 mV/s、30 mV/s、50 mV/s)条件下的循环伏安曲线,如图3所示。3种样品的CV图中都存在着明显的氧化还原峰,这表明该电容器的储能机理是基于氧化还原反应的赝电容原理。图中氧化还原峰归因于在碱性KOH溶液中Ni2+/Ni3+的转换,但不同电极材料的电极反应有所不同。酸性和中性产物Ni3S4的电极反应按照如下进行[19]:
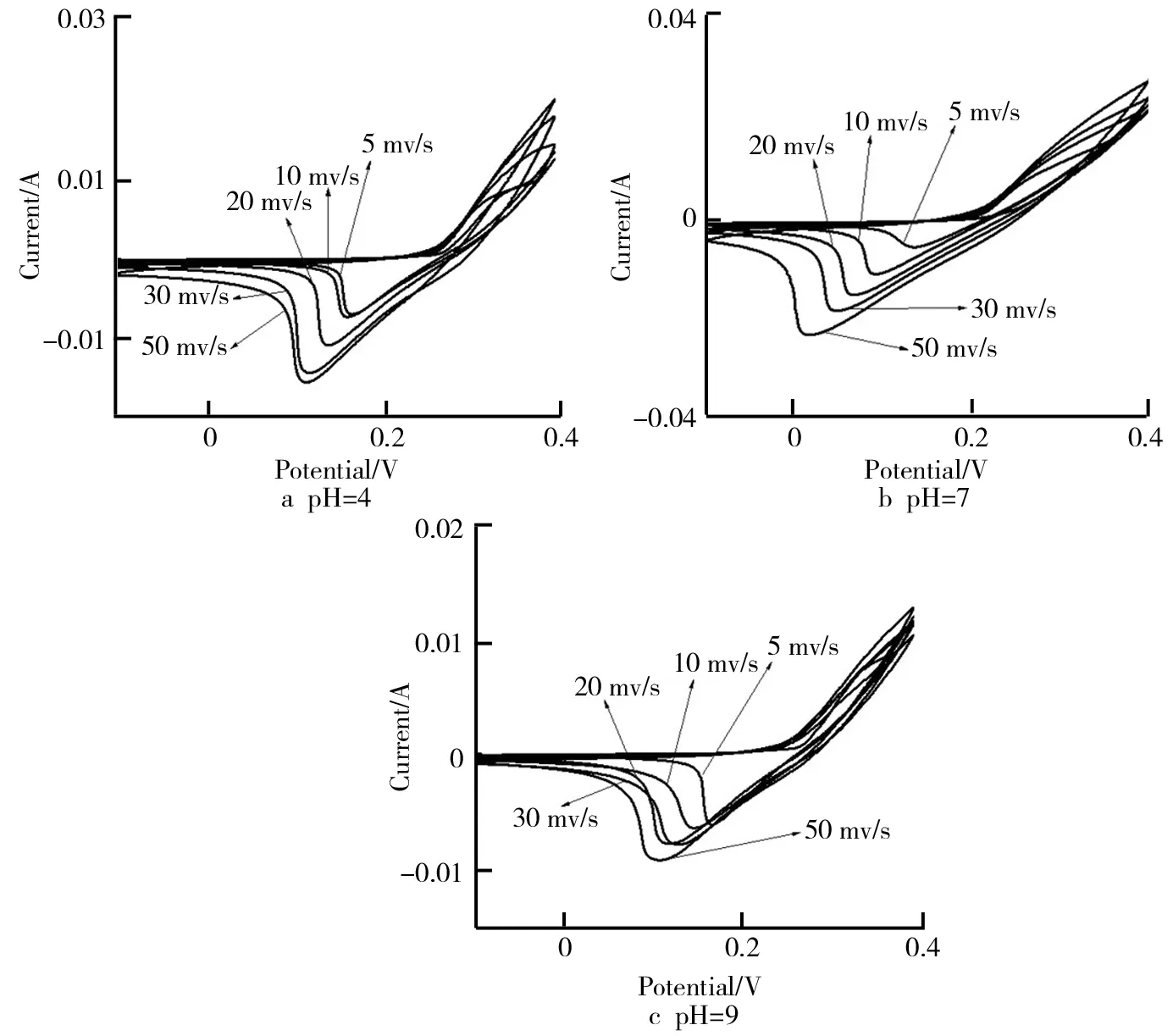
图3 不同pH下产物的CV曲线
(4)

(5)

(6)
而碱性产物NiS电极反应为[20]:

(7)

(8)
此外,闭合CV曲线面积随扫描速率增大而增大,在较低扫描速率下,由于离子具有足够的时间与电极材料相互作用,所以可获得较高的电容值,而在较高扫描速率下,仅电极材料的外表面参与,所以导致较低的比电容[12]。
从CV曲线可以看出,随着扫描速率的增加,氧化还原电流增大,阳极峰向正电位偏移,阴极峰向负电位移动,这是由于在低扫速下OH-的扩散速率高于氧化还原反应产生电子的生成速率,说明硫化镍电极具有较低的电阻和较快的化学反应速率[12]。当扫速増加时,反应体系中的离子迁移速率难以中和氧化还原反应生成电子的生成速率[21],也就是说溶液中离子的迁移速率限制了氧化还原反应的发生,导致电极产生了极化现象,所以阳极峰与阴极峰分别向低电位与高电位方向转移。其中样品2阳极峰和阴极峰迁移更为明显,这表明花状等级结构具有更高的电子/离子传输速率和优异的氧化还原反应动力学性能[12]。
(2)恒流充放电测试(GCD)。恒流充放电测试是一种在给定的电流密度和电压区间内,对电极进行的充电和放电测试,记录电势V随充放电时间t的关系。它与循环伏安法原理不同,相比较循环伏安测试它更适合于实际应用,对材料的充放电能力、比容量研究更加深入具体。循环伏安测试的结果常常作为恒流充放电测试的辅助,两者数据可结合分析。
将3种材料制成电极在6 mol/L KOH电解液中进行电化学性能测试,在不同电流密度下的恒流充放电曲线如图4所示。电位区间在0~0.4 V,电流密度大小依次设置为1 A/g、2 A/g、3 A/g和5 A/g。非线性的充放电曲线显示典型的法拉第赝电容行为,这与CV曲线结果一致。GCD放电曲线显示出3个清晰的电压降阶段(0.4~0.15 V,0.15~0.1 V,0.1~0 V)。第一阶段为双电层电容,放电时间较短,而第二阶段的放电时间较长,为法拉第电容,第三阶段为两者的混合电容。

图4 不同pH下产物的GCD曲线
材料的比电容可以通过以下公式计算[17]:
式中,C代表比电容(F/g);I表示放电电流(A);Δt为放电时间(s);m表示活性物质的质量(g);ΔV表示电势范围(V)。根据放电曲线计算得出,3种不同产物(pH=4、pH=7、pH=9)在电流密度为1 A/g时的比电容分别为801.5 F/g(pH=4)、1 005 F/g(pH=7)、882.5 F/g(pH=9)。由于电压降的增加和氧化还原过程中活性物质不足,比电容随电流密度的增加而逐渐减小。样品2具有较高的比电容和较好的倍率性能,这首先归功于其独特的三维互穿框架组成的花状分层结构所赋予的高表面积;其次,表面较薄的片层可以大大缩短电解质离子的扩散和迁移距离;其三,独特的花状分层结构可以在短时间内促进离子从电解质向活性材料表面扩散。此外,小尺寸的薄片层也可以缩短电荷转移距离,保证活性材料的利用率。
(3)交流阻抗测试(EIS)。3种样品的交流阻抗曲线如图5所示。交流阻抗曲线在不同频率的小幅值正弦波扰动信号作用下,由电极系统的响应与扰动信号之间的关系得到电极材料的阻抗。测试得到的数据通过拟合后,可对相应的等效电路图分析体系的电阻大小等。在实际的恒流充放电测试图谱中,充放电的起始阶段常常观察到有压降产生,其原因就是电容器中存在阻抗。
从图5中可以看出,曲线主要由两部分组成,高频区的半圆曲线和低频区的斜线分别对应电化学过程和传质过程[22]。在高频区中,阻抗曲线与X轴的交点代表复合电阻Rs,半圆的直径代表电荷转移电阻Rct,这是由法拉第氧化还原反应在电极材料和电解液界面引起的。由图5和ZView软件拟合后可知,样品1的Rs=4.21 Ω,Rct=1.77 Ω;样品2的Rs=4.19 Ω,Rct=1.78 Ω;样品3的Rs=5.13 Ω,Rct=1.78 Ω,由此可见花状结构(样品2)的电阻较小。在低频区的直线斜率代表电解质离子进入电活性材料的扩散阻力。斜率越大,表明该材料具有越低的扩散阻力,电容行为越好。由图5可以明显看出,pH=7(样品2)的斜率最大,因此该材料扩散电阻较低,性能较好。交流阻抗测试与恒流充放电测试的结果相符合。
图5 三种样品的交流阻抗曲线
3 结论
实验利用简单水热方法,通过控制反应的pH值,成功制备了3种硫化镍微纳米结构。研究结果表明pH值对产物的物相、形状和尺寸有很大的影响,随pH值增加,镍硫比逐渐增加,直至发生相变,尺寸减少,产物形貌由厚片堆积状向花状分层等级结构和纳米粒子转变。电化学性能对比测试结果表明电极材料的形貌和微观结构对其电化学性能有很大的影响。其中在中性条件下获得的花状分层等级结构的电化学性能最佳,在电流密度为1 A/g时,其比电容达到1 005 F/g。结果表明这种花状分等级微米结构具有高比表面积,使电解质能充分浸润电极表面,提高了离子在电极和电解质界面上的传质速率,非常适合作为赝电容超级电容器的电极材料。

