自噬在肿瘤上皮-间充质转化以及侵袭转移中的作用
童 行,何卫阳
(重庆医科大学附属第一医院泌尿外科,重庆 400016)
在真核生物的生长发育中,自噬是一重要环节,其对于维持细胞稳定有着重要意义。根据底物的降解途径不同,自噬可分为大自噬、小自噬、分子伴侣介导自噬。通常细胞会有一定水平但活性较低的基础自噬,在一些应激因素(饥饿、缺氧、炎症、药物)刺激下,细胞的自噬活性可明显增加。自噬过程发生异常,细胞在很多方面,如能量代谢、侵袭转移等方面也会发生异常。研究表明EMT是肿瘤细胞侵袭转移的重要机制之一,但目前自噬对上皮-间充质转化(epithelial-mesenchymal transition,EMT)的影响以及具体机制还不清晰,有待进一步总结探讨。故本文就自噬在肿瘤细胞EMT以及侵袭转移机制中的作用进行综述。
1 自噬分类
根据底物的降解途径不同,自噬可分为大自噬、小自噬、分子伴侣介导自噬。
1.1 大自噬相对于其他两种自噬途径,大自噬的研究较为深入。自噬体的形成是大自噬的鉴别特征。在应激因素(饥饿、缺氧、炎症、药物等)刺激下,内质网来源的双层膜形成,其向外周伸展,该过程即为自噬前体的形成。自噬前体进一步伸展包裹降解底物(可溶蛋白、细胞器等),该过程即为自噬体的形成。最后,自噬体与溶酶体结合形成自噬溶酶体,进而降解底物为细胞生存提供所需物质[1]。
1.2 小自噬在哺乳动物中,小自噬研究较少。膜的直接形变包裹底物是其鉴别特征。小自噬可分为非选择性小自噬、选择性小自噬和内体小自噬。非选择性小自噬表现为非特异性底物直接刺激膜发生内凹,底物进一步从内凹处吸收降解。特定的底物(线粒体、细胞核等)降解是选择性小自噬的主要特点,特定底物先与膜伸出的凸起结合形成内陷小泡,进一步被吸收降解。细胞内多泡体的形成是内体小自噬的主要特征,其和降解底物的循环相关。降解底物通过多泡体、溶酶体被降解[2]。
1.3 分子伴侣介导自噬分子伴侣介导自噬是底物蛋白被分子伴侣识别后运送至溶酶体内降解的过程,没有小泡参与底物降解是分子伴侣介导自噬的鉴别特征。首先,热休克蛋白70(heat shock protein 70,HSP70)和热休克蛋白90(heat shock protein 90,HSP90)、热休克蛋白40(heat shock protein 40,HSP40)等辅助分子选择性识别底物蛋白中的特定氨基酸序列KFERQ,与之结合形成复合物,并使底物蛋白去折叠。该复合物通过溶酶体相关膜蛋白2A(lysosome associated membrane protein,LAMP2A)被转运至溶酶体内进行降解[3]。已有研究表明,LAMP2A与分子伴侣介导自噬的激活程度正相关,LAMP2A高表达,则分子伴侣介导自噬的激活程度高[4]。所以LAMP2A被认为是分子伴侣介导自噬的关键调控蛋白。
2 EMT与侵袭转移
EMT主要分为3个类型,Ⅰ型与胚胎的发育、器官的形成有关,Ⅱ型与组织再生、器官发育有关,Ⅲ型和肿瘤发生进展有关[5]。原始部位的肿瘤细胞发生Ⅲ型EMT,肿瘤细胞的上皮细胞特性慢慢开始丧失,细胞之间的粘附作用进一步降低,这是EMT侵袭转移机制的关键步骤。然后,细胞从基底膜脱落,获得间叶细胞特性,因而侵袭运动能力增加。这些具有侵袭运动能力的细胞最终将侵入血管转移至远处形成新的病灶[6]。尽管已有研究表明,不是所有上皮性肿瘤细胞都需要转变至间充质细胞状态来形成转移灶[7-8],但是EMT仍是细胞侵袭转移机制的研究重点。
EMT表现为上皮细胞的特征消失,其相关蛋白E-钙粘蛋白、细胞角蛋白、α-连环蛋白、β-连环蛋白表达下降;间充质细胞相关蛋白N-钙粘蛋白、波形蛋白、纤连蛋白等表达上升[9]。这些特异标志物的变化也是实验检测EMT发生进展的基础。
EMT通过多条信号途径影响肿瘤细胞的侵袭转移,比如转化生长因子β(transforming growth factor-β,TGF-β)信号途径、Wnt信号途径、Notch信号途径、Hedgehog信号途径、整合素连接激酶(inte-grin-linked kinase,ILK)信号途径等[10-12]。这些途径之间也存在着相互联系,协同上皮-间充质转化的进展。
3 不同类型自噬对EMT的作用
3.1 大自噬对EMT的作用目前,大自噬对肿瘤细胞EMT的作用机制还不完全明确,在不同的细胞中,自噬通过不同的信号途径对EMT发挥着重要的作用。
3.1.1大自噬对EMT的促进作用
3.1.1.1TGF-β 在肿瘤细胞生理、病理进程中,TGF-β是诱发EMT的重要的因子。外源重组的TGF-β细胞因子可以刺激许多肿瘤细胞系发生EMT[13-14]。一般认为TGF-β可以通过Smad、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)等途径上调BECN1、自噬相关基因(autophagy-related gene,ATG) 5、7等从而上调自噬[15]。另外,我们研究团队发现,在膀胱癌细胞株中,饥饿处理细胞6 h诱导的大自噬可促进TGF-β1分泌增加,TGF-β1作为配体与膜上的Ⅱ型受体结合,使Ⅰ型受体激活,进而使转录激活因子Smad 2、Smad3发生磷酸化,磷酸化后的Smad 2、Smad3可以与Smad4形成复合体进入细胞核内,调控靶基因表达,促进EMT进展,进一步促进膀胱癌细胞侵袭转移能力(图1)[16]。
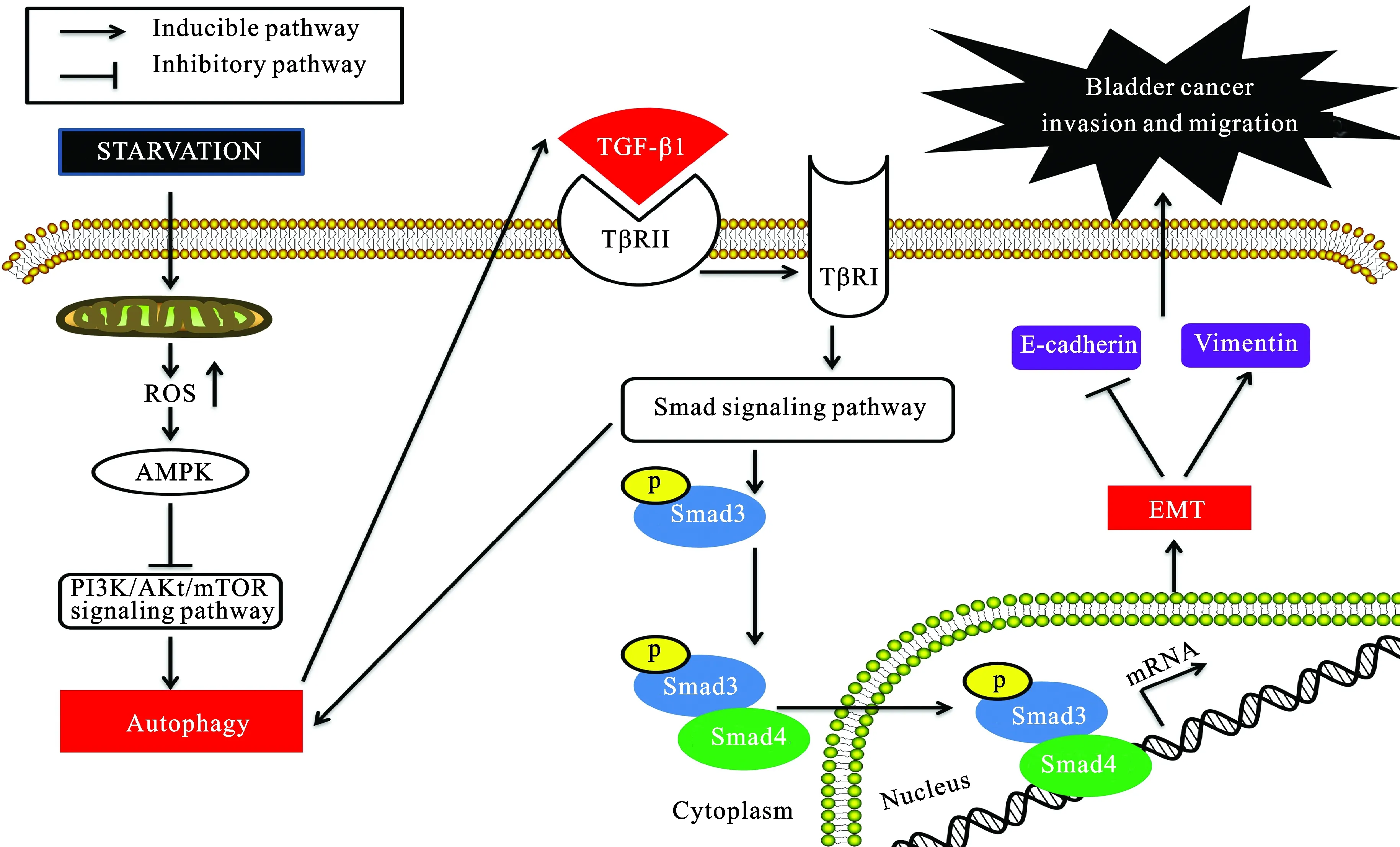
图1 饥饿诱导大自噬促进膀胱癌细胞株EMT进展
饥饿处理膀胱癌细胞株,诱导的大自噬可促进TGF-β1分泌增加,TGF-β1作为配体与膜上的Ⅱ型受体结合,使Ⅰ型受体激活,进而使转录激活因子Smad 2、Smad3发生磷酸化,磷酸化后的Smad 2、Smad3可以与Smad4形成复合体进入细胞核内,调控靶基因表达,促进EMT进展,进一步促进膀胱癌细胞侵袭转移能力。
在头颈部鳞状细胞癌中,CHEN等[17]应用外源的重组TGF-β1细胞因子处理细胞,发现TGF-β1在诱发EMT增强细胞侵袭迁移能力的同时也诱导了自噬的发生,抑制自噬后,EMT也被抑制,细胞侵袭迁移减弱。说明了在头颈鳞癌中,自噬对TGF-β1诱导的EMT正性调控。在肝癌细胞中,TGF-β2在诱导细胞发生EMT增强侵袭转移的同时也能诱导自噬的发生,抑制自噬后,其对EMT的促进作用也受到了抑制。说明在肝癌细胞中,自噬对TGF-β2诱导的EMT正性调控,其机制可能与抑制自噬后导致细胞内活性氧(reactive oxygen species,ROS)水平增加有关[18]。
3.1.1.2Notch信号途径 Notch信号通路与细胞的增殖、分化、凋亡以及侵袭转移等过程密切相关,也是EMT发生的重要途径之一[19]。在非小细胞肺癌细胞株A549中,用无血清培养基饥饿处理细胞可诱导自噬发生的同时也明显促进EMT的发生,并且细胞迁移能力增强。通过沉默Atg3抑制自噬后,其迁移能力下降,EMT相关标志物逆转以及Notch、snail蛋白的表达明显降低;说明自噬通过Notch/snail信号通路对EMT正性调控[20]。
3.1.1.3Hedgehog信号途径 Hedgehog信号途径主要参与胚胎细胞的生长分化,在胚胎发育过程中起着重要的调控作用。同时Hedgehog信号途径同样参与肿瘤的进展,其也是EMT发生的重要途径之一[21]。有研究表明,在膀胱癌细胞中,辣椒素(capsaicinoids,CPS)可以通过诱导自噬激活Hedgehog信号途径从而促进EMT的发生[22]。
3.1.1.4自噬通过其他途径促进EMT 鞘氨醇激酶1(sphingosine kinase1,SPHK1)是一种鞘氨醇代谢酶,可以通过多途径影响肿瘤侵袭转移能力,比如SPHK1通过促进表皮生长因子受体(epidermal growth factor receptor,EFGR)通路激活从而促进食管癌细胞侵袭转移[23];SPHK1通过促进PTK2/FAK通路激活促进结肠癌细胞侵袭转移[24]。LIU等[25]发现,在肝癌细胞中,SPHK1诱导EMT增强侵袭转移能力的同时也能诱导自噬发生。在过表达SPHK1增强侵袭迁移的同时应用3-甲基腺嘌呤、氯喹抑制自噬,EMT相关标志物逆转且迁移侵袭能力降低。表明在肝细胞癌中,SPHK1诱导EMT发生与自噬相关,且自噬正性调控EMT,其具体机制与自噬促进上皮钙黏蛋白基因1(cadherin1,CDH1)的降解密切相关。CDH1是上皮钙黏蛋白编码基因,其表达下降是EMT发生的基础。胰腺癌细胞中,低氧在诱导自噬的同时促进EMT发生并增强细胞的迁移能力;应用3MA抑制自噬或干扰低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)后,细胞迁移能力下降,EMT相关蛋白标志物逆转。说明在胰腺癌细胞中,低氧通过HIF-1α诱导的自噬正性调控EMT[26]。乳腺癌相关成纤维细胞(carcinoma-associated fibroblasts,CAFs)能促进乳腺癌细胞的侵袭、转移,其部分是通过诱导自噬,促进EMT完成的[27]。在缺氧条件下,长链非编码氨基甲酰磷酸合成酶1(long non-coding carbamoyl phosphate synthetase 1,lncRNA CPS1)可抑制结直肠癌细胞EMT与侵袭转移,其可能是通过lncRNA CPS1抑制 HIF-1α,从而抑制缺氧诱导的自噬完成的[28]。其表明自噬正性调控结直肠癌EMT,lncRNA CPS1通过抑制自噬进而抑制了细胞的EMT进展。
3.1.2大自噬对上皮-间充质转化的抑制作用
3.1.2.1Wnt信号途径 前文提到EMT通过TGF-β、Notch、Hedgehog、Wnt等多条信号途径影响肿瘤细胞的侵袭转移,其中自噬可以正性调控TGF-β、Notch、Hedgehog信号途径促进EMT进展。而对于Wnt信号途径,有研究表明自噬对其则是负性调控来影响EMT。在结肠癌细胞中,雷帕霉素和饥饿处理诱导自噬后,Wnt信号通路的关键诱导因子Wnt3a表达下降,用3MA抑制自噬后,饥饿处理对Wnt3a的抑制作用得到逆转,说明了自噬可以负性调节Wnt信号通路进而影响EMT[29]。
3.1.2.2P62蛋白 P62蛋白对于肿瘤的进展、炎症反应以及一些代谢相关疾病都发挥重要调节作用,也是自噬降解的一种选择性底物蛋白,可以起到接头蛋白调节信号转导的作用。有研究表明,在小鼠黑色素瘤细胞中,抑制自噬能促进EMT:敲除Atg3、Atg5、Atg9、Atg12抑制自噬后,P62表达增加,E-钙黏蛋白表达下降,同时细胞侵袭转移能力增强。这里自噬负性调控EMT与P62对TWIST1的正性调控有关,TWIST1是EMT的重要调控因子,具有抑制肿瘤细胞E-钙黏蛋白的作用[30]。
3.1.2.3SNAIL转录因子 SNAIL转录因子和前文提到的TWIST1都是诱导EMT发生的关键性调控因子和始动因素。在胶质母细胞瘤中,饥饿处理或应用雷帕霉素后,自噬被诱导,细胞迁移侵袭能力下降,抑制自噬后其迁移侵袭能力上升。其具体机制与自噬对SNAIL的抑制有关,自噬被诱导后,抑制SNAIL表达,其对钙黏蛋白的抑制解除,钙黏蛋白表达增加,细胞进而获得上皮样表形[31]。
3.1.2.4BECN1对EMT的直接作用 BECN1是自噬的特异基因,是自噬的关键启动因素。在乳腺癌细胞中发现死亡效应结构域DNA结合蛋白(death effector domain DNA-binging protein,DEDD)能直接与BECN1复合体结合,稳定磷酸肌醇-3-激酶3 (Phosphoinositide-3-Kinase Class 3,PIK3C3),促进BECN1与PIK3C3的相互作用,诱导自噬发生,进而抑制EMT和细胞侵袭转移[32]。
3.1.2.5自噬通过其他途径抑制EMT 有学者认为,在肿瘤进展过程中细胞骨架与线粒体是自噬和EMT相互作用的桥梁。EMT的激活可使细胞骨架聚合和重塑,进而促进线粒体裂解进一步维持EMT和细胞迁移。但自噬的大量激活可诱导线粒体重建,导致游离线粒体减少,进而抑制细胞EMT进程和迁移[33]。
3.2 分子伴侣介导自噬对EMT的作用分子伴侣介导自噬和大自噬一样,在一些应激因素刺激下,都会被诱导。已有研究表明分子伴侣介导自噬对于肿瘤的生存、进展起着重要作用。KON等[34]首先验证了在多种肿瘤细胞株中,分子伴侣介导自噬具有高活性,然后在肺癌细胞株中,沉默分子伴侣介导自噬的限速蛋白LAMP2A后,分子伴侣介导自噬活性降低,肿瘤细胞的增殖、迁移能力也明显下降。另外有研究发现,分子伴侣介导自噬活性的减弱会导致P65降解受损,而逐渐积累的P65会增加核因子κB(nuclear factor kappa-B,NF-κB)的活性,进一步促进EMT的进展[35]。分子伴侣介导自噬对肿瘤细胞EMT的作用以及具体机制尚不完全明确,还有待进一步研究。
3.3 小自噬对EMT的作用相对于其他两种类型自噬,小自噬的研究较为浅显。特别是在哺乳动物的肿瘤细胞中,小自噬研究较少。目前关于小自噬的研究大多集中在其形态学方面,其对肿瘤细胞侵袭转移作用以及其对EMT作用还有待进一步研究。
4 总结与展望
在早期阶段,自噬通过诱导线粒体重塑并去除受损和有毒性物质来抑制肿瘤侵袭转移。肿瘤进展到晚期,自噬又可通过协助肿瘤细胞应对外界刺激,获得更顽强的生存能力以及更强的侵袭转移能力。自噬可能以不同的分子机制在肿瘤上皮-间充质转化侵袭转移过程中发挥着“双重作用”(图2)。研究表明,自噬作为一种细胞自我保护机制,对许多肿瘤化疗药耐药的形成至关重要,抑制这种保护性自噬后,药物敏感性增加[36-37]。但是,在抑制自噬增强化疗药敏感性的同时,抑制自噬对肿瘤细胞上皮-间充质转化以及侵袭转移是否也是抑制作用?即靶向调控自噬,是否在多方面对肿瘤的治疗起到协同作用,这还需要进一步的探讨。
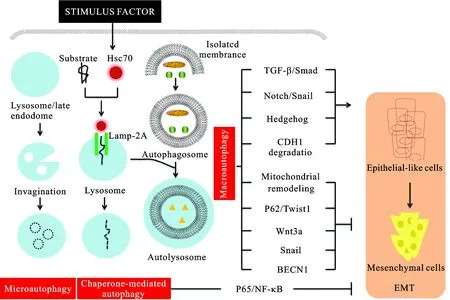
图2 自噬以不同的分子机制对EMT的作用
现阶段关于自噬对肿瘤细胞上皮-间充质转化作用的研究还处于初步阶段,分子伴侣介导自噬和小自噬对EMT以及侵袭转移机制的研究并未深入。进一步探讨不同肿瘤、不同诱导因素诱导的自噬对EMT的作用以及3种自噬功能的交互联系,明确其关键调节点的信号通路,针对不同肿瘤靶向调控自噬,将有可能为个性化的抑制肿瘤侵袭转移寻找新的思路。

