尿斑蛋白Ⅲ在SD大鼠前列腺各叶的表达及意义
安凌悦,张 珩,罗光恒,田 野,孙兆林
(1.贵州医科大学附属人民医院泌尿外科,贵州贵阳 550002;2.贵州省人民医院泌尿外科,贵州贵阳 550000)
前列腺切除术后尿路感染发生率为3.9%~14.0%,尿道狭窄和膀胱挛缩的发生率为7.0%~10.0%,尿道灼热及尿痛的发生率为6.9%~29.5%[1-2]。可见,前列腺切除术并发症仍未得到较好的控制,究其重要原因是前列腺切除术后创面修复的机制仍不甚清楚。为揭示术后创面修复机制,减少前列腺切除术后并发症,需明确术后修复创面的细胞来源及过程。传统观点认为,前列腺切除术后修复创面的细胞来源于膀胱颈的尿路上皮细胞爬行覆盖[3]。本研究团队前期发现,前列腺切除术后修复创面的细胞可能来源于术后残余前列腺包膜或侧叶前列腺导管内皮的尿路上皮细胞,其分布随着导管尿道开口处向腺泡腔底部延伸而逐渐减少至消失[4-5]。前列腺部尿道和前列腺导管开口衬着尿路上皮,尿路上皮最外层的伞状细胞是其主要功能细胞,可防止毒性物质渗入机体,发挥这一关键作用的结构蛋白是尿斑蛋白(uroplakin,UP)。UP是一类与尿路上皮分化密切相关的特异性糖蛋白,分为UPⅠa、UPⅠb、UPⅡ和UPⅢ。UPⅢ特异性表达于尿路上皮,在维持尿路上皮延展功能和防止有毒物质的渗透中有重要作用[6-7]。因此,UPⅢ不仅是尿路上皮的重要结构功能单位,还是研究尿路上皮的特异性标志物。作者前期通过流式细胞证实前列腺组织中存在UPⅢ阳性的细胞[5]。然而,UPⅢ在前列腺腹侧叶和侧叶导管内皮的具体表达情况尚不清楚。本文旨在对UPⅢ在老年雄性SD大鼠前列腺导管内皮中的表达进行定位量化研究,为进一步研究尿路上皮在前列腺切除术后尿道修复过程中的意义提供研究基础。
1 材料与方法
1.1 实验动物18周龄老年雄性斯泼累格·多雷(Sprague Dawley,SD)大鼠15只购于贵州医科大学动物房(合格证号:SCXK,黔2012~0004),体重599.96~700.04 g。将其随机均分3组,其中一组HE染色和免疫组织化学染色(免疫组化)的5只大鼠体重633.01~700.02 g,二组蛋白质免疫印迹(Western blot,WB)检测分析的5只大鼠体重621.04~691.71 g,三组实时定量荧光酶联聚合反应(Real-time fluorescence quantitative enzyme chain polymerization,RT-PCR)检测分析的SD大鼠体重600.01~685.42 g,组间体重无统计学差异(P<0.05)。
1.2 取材将15只SD大鼠予水合氯醛(0.5 mL/100 g)麻醉后仰卧位固定消毒,行下腹部正中切口至耻骨联合,充分暴露盆腔脏器,可见SD大鼠的前列腺腹侧叶(中央带和移行带)包饶并贴附于尿道,前列腺侧叶(外周带)贴附于膀胱两侧,完整取出膀胱、前列腺部尿道及前列腺,均行多聚甲醛固定。
1.3 HE染色取一组SD大鼠膀胱、前列腺部尿道及前列腺组织,按标准操作程序(SOP文件)行病理连续切片和HE染色镜检其尿路上皮细胞。
1.4 UPⅢ检测
1.4.1免疫组化法 取尿路上皮细胞学检测病理连续切片按SOP文件行免疫组化染色检测UPⅢ,其中膀胱作为尿路上皮细胞UPⅢ阳性对照(下同)。
1.4.2WB法 取二组大鼠膀胱、前列腺腹侧叶和侧叶组织剪成细小的碎片,按SOP文件行WB法检测UPⅢ。
1.4.3RT-PCR法 取三组SD大鼠膀胱、前列腺腹侧叶和侧叶组织分别提其总RNA,消除总RNA中DNA及DNasel后反转录制备cDNA,对其进行PCR扩增,扩增后检测UPⅢ基因CT值。扩增体系如下:SYBR Green Mix 10Ml,上游引物F 5 moL,下游引物R 5 mol,cDNA模板1 μL,ddH2O 8 μL。引物及序列如下: UPⅢ-F,GGAGTGGAGGCATGATTG;UPⅢ-R,CCAGGGTCTTGGGAACA;β-Actin-F,CGTTGACATCCGTAAAGAC;β-Actin-R,TAGGAGCCAGGGCAGTA。
1.5 统计学方法数据采用SPSS22.0软件进行统计分析,多组计量资料比较服从正态分布方差齐的使用单因素方差分析,不服从正态分布或方差不齐的使用Kruskal-WallisH非参数检验,以P<0.05判定为有统计学意义。
2 结 果
2.1 HE染色结果膀胱和前列腺部尿道内可见典型、胞质均匀的尿路上皮三层细胞(伞状细胞、中间细胞和基底细胞),呈极性排列(图1A、B)。前列腺腹侧叶中开口于尿道的前列腺导管近端也可见尿路上皮,层数约2~3层,厚薄不均,该处的伞状细胞未呈极性排列,中间细胞和基底细胞完整,细胞呈极性排列(图1C)。尿路上皮三层细胞随着前列腺导管向腺泡腔底部延伸,数量逐渐减少,细胞排列由极性转变为非极性,直至转化为单层极性排列的腺上皮细胞(图1D、E)。前列腺侧叶中未能切出完整的前列腺导管,未能观察到其尿路上皮的特点。
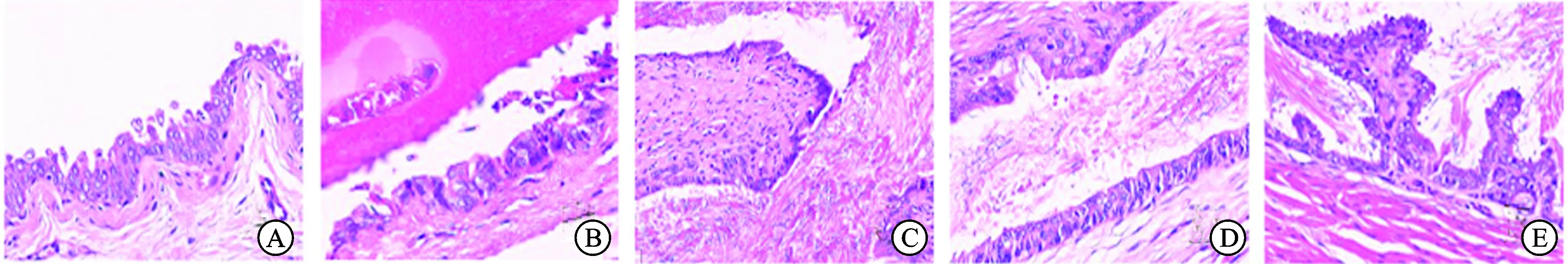
图1 SD大鼠膀胱、尿道和前列腺导管HE染色结果(HE,×100)
A/B:膀胱和尿道内可见尿路上皮典型伞状细胞、中间细胞和基底细胞,呈极性排列;C:前列腺腹侧叶中开口于尿道的前列腺导管近端也可见尿路上皮,其中伞状细胞未呈极性排列,中间细胞和基底细胞呈极性排列;D/E:随着前列腺导管向腺泡腔底部延伸,尿路上皮细胞数量逐渐减少直至转化为腺上皮细胞。
2.2 UPⅢ检测结果
2.2.1免疫组化检测结果 UPⅢ在膀胱、前列腺部尿道和前列腺导管内均呈胞质阳性表达,其中膀胱表达最强,其次为前列腺部尿道,前列腺腹侧叶中前列腺导管尿道开口处的表达最弱(图2A、B、C)。前列腺导管开口处UPⅢ的阳性表达随着导管尿道开口向腺泡腔底部延伸逐渐减弱,最终在前列腺导管腺泡腔底部呈阴性表达。前列腺侧叶中因未切出导管,未观察到前列腺导管内UPⅢ的表达情况(图2D、E)。

图2 SD大鼠膀胱、尿道和前列腺导管免疫组化结果(免疫组化,×100)
A/B:UPⅢ在膀胱和尿道呈胞质阳性表达;C:前列腺腹侧叶中前列腺导管尿道开口处的UPⅢ同样呈阳性表达;D/E:前列腺导管开口处的UPⅢ阳性表达随着导管尿道开口向腺泡腔底部延伸逐渐减弱,最终在前列腺导管腺泡腔底部呈阴性表达。
2.2.2WB检测结果 膀胱、前列腺腹侧叶和侧叶UPⅢ的表达量分别为2 277.20±95.90、1 665.00±78.36和27.40±10.29,各组织间表达存在差异,有统计学意义(F=1 314.250,P<0.001),其中膀胱表达强于前列腺腹侧叶,侧叶最低(图3)。
2.2.3RT-PCR检测结果 膀胱、前列腺腹侧叶和侧叶中UPⅢ基因CT值的差异有统计学意义(H=6.618,P=0.037),其中膀胱与前列腺腹侧叶间的差异无统计学意义(P>0.05),前列腺侧叶UPⅢ基因表达显著低于膀胱、前列腺腹侧叶(均P<0.05,图4、表1)。
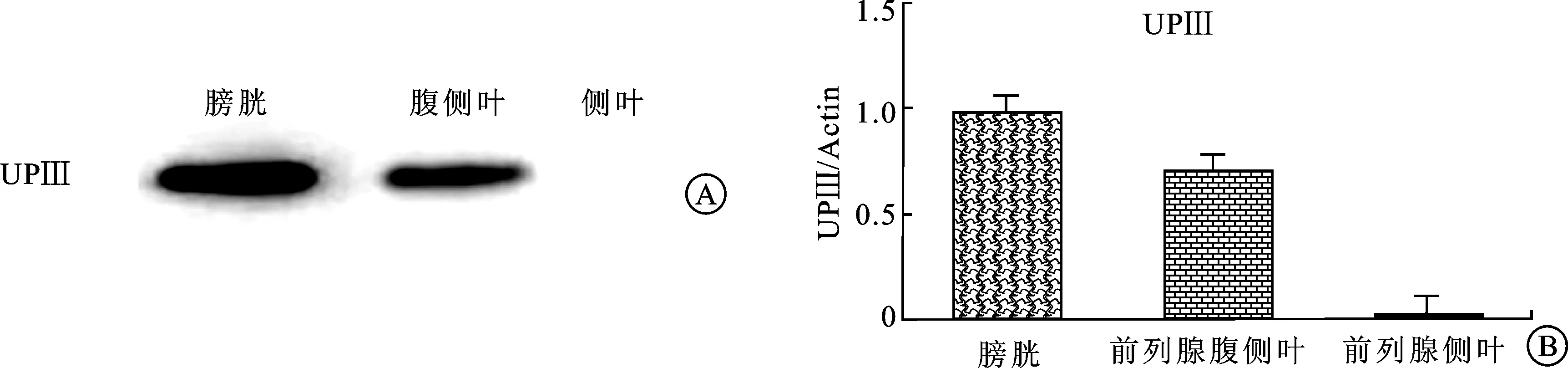
图3 SD大鼠膀胱、前列腺腹侧叶和侧叶WB蛋白定量结果
A:UPⅢ在膀胱内的蛋白表达量最高,前列腺腹侧叶次之,前列腺侧叶极低;B:膀胱、前列腺腹侧叶和侧叶中UPⅢ表达量比例分布。

表1 RT-PCR检测膀胱、前列腺腹侧叶和侧叶中UPⅢ基因的表达情况比较[M(P25~P75)]
注:*与膀胱、前列腺腹侧叶比较,均P<0.05。
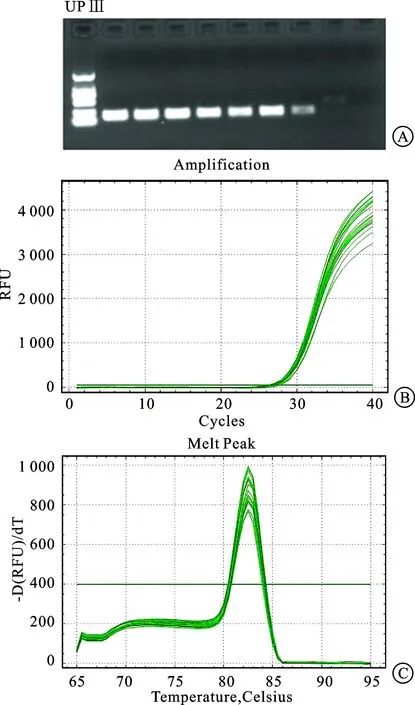
图4 SD大鼠膀胱、前列腺腹侧叶和侧叶RT-PCR基因定量结果
A:按膀胱、前列腺腹侧叶和侧叶顺序检测各组织中UPⅢ基因的定量电泳图(三复孔),膀胱和前列腺腹侧叶中均能检测到UPⅢ基因的表达,前列腺侧叶UPⅢ基因表达低;B/C:UPⅢ基因检测CT值扩增曲线和溶解曲线。
3 讨 论
尿路上皮主要由三层细胞组成,他们由内到外分别是基底细胞、中间细胞和伞状细胞,其中发挥主要尿路上皮屏障功能的是最外层的伞状细胞,其顶膜面有微绒毛,具有增强细胞表面张力、影响细菌粘附和流体运输等功能[8-9]。此外,90%的伞状细胞表面覆盖着独特的不对称单位膜(asymmetric unit membrane,AUM),它使尿路上皮具有高达75 000 Ω/cm2的扩膜电阻,能够有效阻碍尿液中有害物质渗入机体,形成血尿屏障的重要功能结构[6,10]。
AUM的主要蛋白成分是UP,UP 分为UPⅠa(27 ku)、UPⅠb(28 ku)、UPⅡ(15 ku)和UPⅢ(47 ku),他们以二聚体的形式构成亚单位,每个亚单位由6个内环蛋白(UPⅠa和UPⅠb)和6个外环蛋白(UPⅡ和UPⅢ)构成,约1 000~3 000个左右的亚单位装配成一个斑块覆盖伞细胞顶膜面形成AUM。UPⅢ在细胞内的部分远远超过它在细胞外的部分,这种内外不对称的分布方式与其他类型UP共同形成AUM的分子基础。UPⅢ可表达于尿路上皮组织或尿路上皮源性的原发肿瘤和转移肿瘤[11],它对尿路上皮具有高度特异性,而在除前列腺导管以外的前列腺组织内为阴性,因此,UPⅢ常被用于对尿路上皮的鉴定。
作者前期证实SD大鼠前列腺导管近端存在尿路上皮细胞[5]。本研究进一步发现,前列腺导管内UPⅢ的阳性表达和尿路上皮细胞的排列一致,随着导管向腺泡腔底部延伸,UPⅢ的阳性表达逐渐减弱至阴性,而前列腺除导管外其他部位并未观察到UPⅢ的阳性表达(图1和2)。并在这一特点的基础上,从蛋白及核酸水平检测到前列腺各叶中UPⅢ的表达量,其中前列腺腹侧叶的表达量明显高于前列腺侧叶(P<0.05),该结果和免疫组化表达特点一致。原因可能是前列腺腹侧叶贴附于尿道,其中部分前列腺导管开口于前列腺部尿道,导管开口处的内皮组织有机会接触尿液,为适应尿液环境和防止尿液渗入前列腺组织,该处内皮组织形成尿路上皮,该现象属于机体的适应。反之,前列腺侧叶中的前列腺导管内皮几乎不接触尿液,UPⅢ表达量低。
前列腺组织内分布有许多粗细不等的前列腺导管,协助完成前列腺液的分泌与运输。前列腺切除术后修复前列腺部尿道的种子细胞并不来源于膀胱颈的尿路上皮细胞爬行覆盖,该种子细胞可能来源于前列腺切除术后残余的前列腺导管内皮,它从前列腺导管内爬行至创面,形成岛状上皮细胞,逐渐连接成片修复创面[4,12]。研究表明,在遭到破坏的膀胱尿路上皮组织中,低表达UPⅠ和UPⅡ基因,高表达UPⅢ基因;UPⅢ基因的表达可能与尿路上皮的修复密切相关[13]。
本研究结果中,由于前列腺侧叶的前列腺导管细小,病理切片难以切出完成导管,免疫组化仅观察到UPⅢ在前列腺腹侧叶靠近尿道的前列腺导管内皮呈阳性,前列腺侧叶中未观察到导管内表达情况,除导管外的前列腺组织均为阴性。然而,WB及RT-RCR不仅在靠近尿道的前列腺腹侧叶中检测到大量UPⅢ,还在远离尿道的前列腺侧叶中检测到少量UPⅢ。该结果说明前列腺导管内皮表达UPⅢ,推测前列腺导管内存在尿路上皮细胞,即使是在前列腺侧叶(外周带)同样可能存在少量散在分布于前列腺导管的岛状尿路上皮细胞。当前列腺切除术将大部分前列腺腹侧叶(中央带和移行带)切除,即使较多表达尿路上皮细胞的前列腺导管缺失,少量残存于前列腺侧叶(外周带)中表达UPⅢ阳性的尿路上皮细胞仍可作为修复创面的种子细胞,在前列腺切除术后尿液及局部微环境变化的刺激下从残余前列腺侧叶的导管和包膜爬出,发生离巢、迁移及增殖,参与前列腺切除术后前列腺部尿道的修复过程,最终形成有功能的尿路上皮。
综上所述,在老年SD大鼠前列腺导管内皮存在一定量的UPⅢ,进一步说明前列腺导管内存在尿路上皮,其主要分布于前列腺腹侧叶(中央带)的前列腺导管内皮,少量岛状尿路上皮细胞可能散在分布于前列腺侧叶(外周带),这部分尿路上皮细胞可能是前列腺切除术后修复创面的种子细胞,将为前列腺切除术后创面修复机制的研究奠定基础。

