核转运蛋白基因2在265例上尿路尿路上皮癌中的表达及其与预后的关系
魏正茂,范龙龙,李维清 ,欧龙华,王 燕,李学松,周利群,史本涛
(1.北京大学深圳医院泌尿外科,广东深圳 518036;2.中山大学第八附属医院泌尿外科,广东深圳 518033;3.深圳大学第一附属医院泌尿外科,广东深圳 518035;4.深圳北京大学香港科技大学医学中心,广东深圳 518036;5.北京大学第一医院泌尿外科,北京大学泌尿外科研究所,北京 100034)
上尿路尿路上皮癌(the upper tract urothelial carcinoma,UTUC)指发生于肾盂及输尿管的尿路上皮恶性肿瘤,约占全部尿路上皮癌5%~10%,而且90%以上UTUC源自于移行上皮,是临床上相对少见但潜在致死率较高的恶性肿瘤[1-2]。根治性肾盂输尿管切除术(radical nephroureterectomy,RNU)是治疗UTUC的手术金标准,然而术后仍有部分患者病情继续进展,出现复发,最终导致治疗失败。因此,UTUC的早期诊断和整个尿路的长期密切随访尤为重要,寻找一个更能准确反映UTUC生物学特性及疾病预后的分子标记物对UTUC患者预后的判断及术后治疗方式的选择具有重要的临床应用价值。
核转运蛋白基因2(karyopherin a2,KPNA2)是一种具有核定位信号区域的接头蛋白,作为核孔靶向复合物的组成部分,与核定位信号结合运输蛋白质进入核内发挥作用,调节效应基因的表达,与细胞的恶性转化密切相关[3]。我们的前期研究结果发现,KPNA2能够促进膀胱癌细胞的增殖和侵袭,且KPNA2异常高表达与膀胱癌患者的不良预后有关[4-5]。然而,KPNA2在上尿路尿路上皮癌中的表达水平及其具体的作用尚未清楚。因此,本研究通过检测KPNA2在上尿路尿路上皮癌组织中的表达水平,探讨其与UTUC患者临床病理参数及预后之间的关系。
1 资料与方法
1.1 一般资料152例上尿路尿路上皮癌组织及其对应的癌旁正常上尿路上皮组织石蜡切片,均取自2002年1月至2010年12月期间在北京大学第一医院泌尿外科行根治性患侧肾、输尿管全长、膀胱袖状切除手术所得标本。根据实验设计,参照国内学者胥维勇等[6]的方法,在北京大学第一医院病理科制作完成19个组织微阵列蜡块,共计380个位点(每个蜡块取2个位点)。包含120例上尿路尿路上皮癌组织的商品化组织芯片(产品编码:HRaU-Uro120Sur-01),购于上海芯超生物科技有限公司。
在全部272例上尿路尿路上皮癌患者中,肾盂癌167例,输尿管癌105例。年龄分布为 29~86岁,平均(64.59±12.37)岁。随访时间12~108个月,平均36个月。所有患者临床资料完整,术前均未接受任何化疗或者放疗,术后病理证实均是上尿路移行细胞癌。肿瘤分期依据2010年国际抗癌协会TNM 分期标准(第7版),肿瘤分级采用1973年WHO标准。本研究得到了医院医学伦理委员会的批准通过(批准号:2014-113)。
1.2 主要试剂和仪器KPNA2兔抗人多克隆抗体(ab84440)购自英国Abcam公司。即用型SP系列免疫组织化学检测试剂盒(SP-9001)购自北京中杉金桥生物技术有限公司。10%正常山羊血清、一抗稀释液、中性树胶、苏木素染液、EDTA抗原修复液、10%甲醛和1%盐酸乙醇购自北京中杉金桥生物技术有限公司。组织芯片制作仪、石蜡切片机购自德国Leica公司。
1.3 实验方法严格按照免疫组化二步法操作说明进行实验:将组织芯片采用二甲苯脱蜡,梯度乙醇逐级水化。3%H2O2室温孵育10~15 min,消除内源性过氧化物酶的活性。pH值8.0的EDTA抗原修复液高温加热修复抗原。加1∶1 600稀释的KPNA2抗体4 ℃过夜,磷酸盐缓冲液(phosphate buffered solution,PBS)洗3次,10 min/次。加入带有生物素标记的二抗(1∶5000),37 ℃孵育40 min。加入链霉素抗生物蛋白一过氧化物酶溶液,37 ℃孵育35 min,再次PBS洗3次,10 min/次。加入二氨基联苯胺(Diaminobenzidine,DAB)试剂,显微镜下观察并及时终止反应。苏木素复染,1%盐酸乙醇分化,温水返蓝。常规乙醇梯度脱水、透明、中性胶封片。置于光学显微镜下分析染色结果。以PBS代替一抗作阴性对照,以试剂盒阳性片作为阳性对照。
1.4 结果判定所有病理染色标本均由2名病理医师盲法阅片,每张组织切片随机选取10个高倍视野并计数(×400)。判断标准:KPNA2阳性染色表现为细胞核中出现棕黄色或棕褐色颗粒。依据染色的强度和阳性百分比评定分数。
染色强度(I)评分:0分指无色,1分指淡黄色,2分指棕黄色,3分指棕褐色。阳性细胞所占的百分比计算分数(P):<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。采用积分法,即总的评分按照P×I计算,乘积≥4分为高表达,<4分为低表达。

2 结 果
2.1 KPNA2蛋白在上尿路尿路上皮癌和癌旁组织中的表达在152例上尿路尿路上皮癌及其对应的癌旁组织的组织芯片免疫组化结果中,有6例癌组织切片脱片,最终得到146例上尿路尿路上皮癌和配对癌旁组织的免疫组化结果。在120例UTUC商品化的组织芯片免疫组化结果中,有1例癌组织脱片,最终得到119例上尿路尿路上皮癌组织的免疫组化结果。总计获得265例上尿路尿路上皮癌组织的免疫组化结果和146例癌旁组织的免疫组化结果。
免疫组化结果显示,KPNA2蛋白染色主要定位于细胞核,阳性细胞呈棕黄色或棕褐色颗粒(图1A、1B)。在265例癌组织标本中,高表达数为197例;在146例癌旁组织标本中,高表达数为36例。KPNA2蛋白在上尿路尿路上皮癌组织中的高表达率(74.34%)明显高于其对应的癌旁组织中的高表达率(24.66%),差异有统计学意义(P<0.05,表1)。
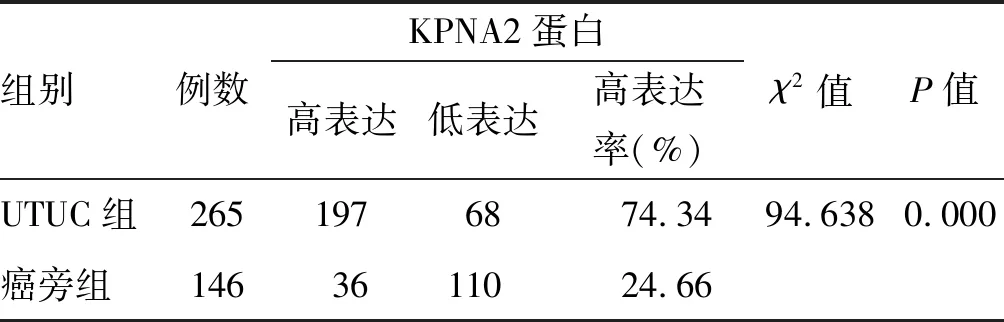
表1 UTUC和癌旁组织中KPNA2蛋白的表达水平比较
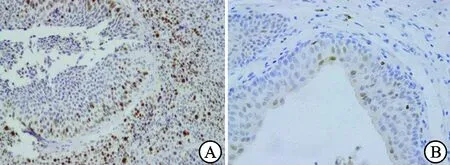
图1 KPNA2蛋白在UTUC和正常上尿路上皮组织中的表达(×200)
A:UTUC组织;B:正常上尿路上皮组织。
2.2 KPNA2蛋白表达与UTUC患者临床病理参数之间的关系通过对KPNA2蛋白的表达水平与患者的临床病理参数进一步研究分析发现:UTUC患者癌组织中KPNA2蛋白表达水平与患者T分期(P=0.000)、G分级(P=0.033)和术后有无膀胱复发(P=0.004)有关,差异有统计学意义(P<0.05)。而与患者的年龄(P=0.265)、性别(P=0.312)、肿瘤大小(P=0.582)和肿瘤边侧(P=0.386)无关,差异无统计学意义(P>0.05,表2)。
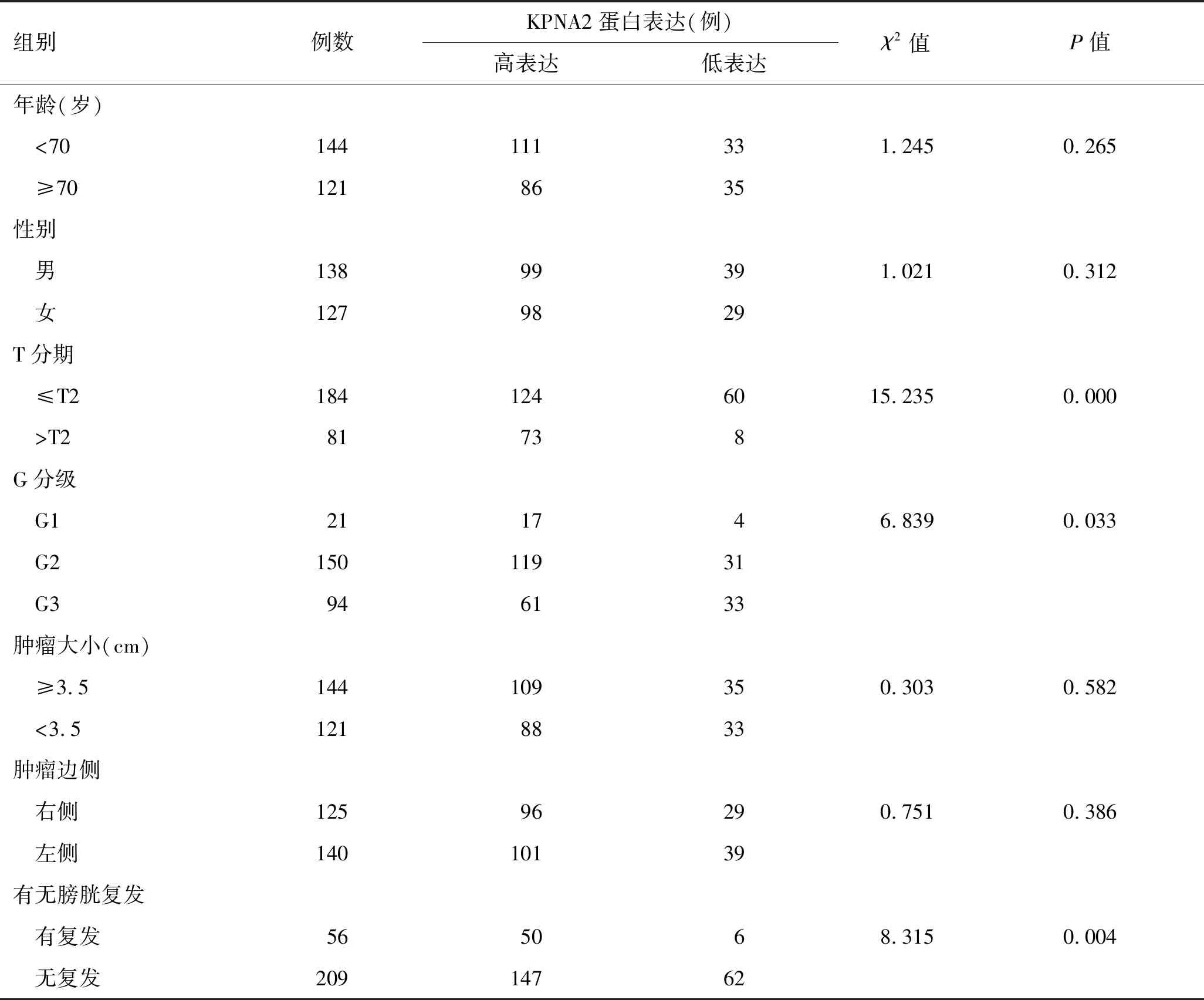
表2 KPNA2蛋白表达与UTUC患者临床病理参数之间的关系
2.3KPNA2蛋白表达与UTUC患者生存率之间的关系 共随访265例患者,其中失访1例,在264例UTUC患者中,KPNA2高表达患者5年总体生存率为64.80%(127/196),明显低于KPNA2低表达患者5年总体生存率80.88%(55/68),统计分析证实,KPNA2的表达水平与患者的预后有统计学意义(P=0.014,图2)。
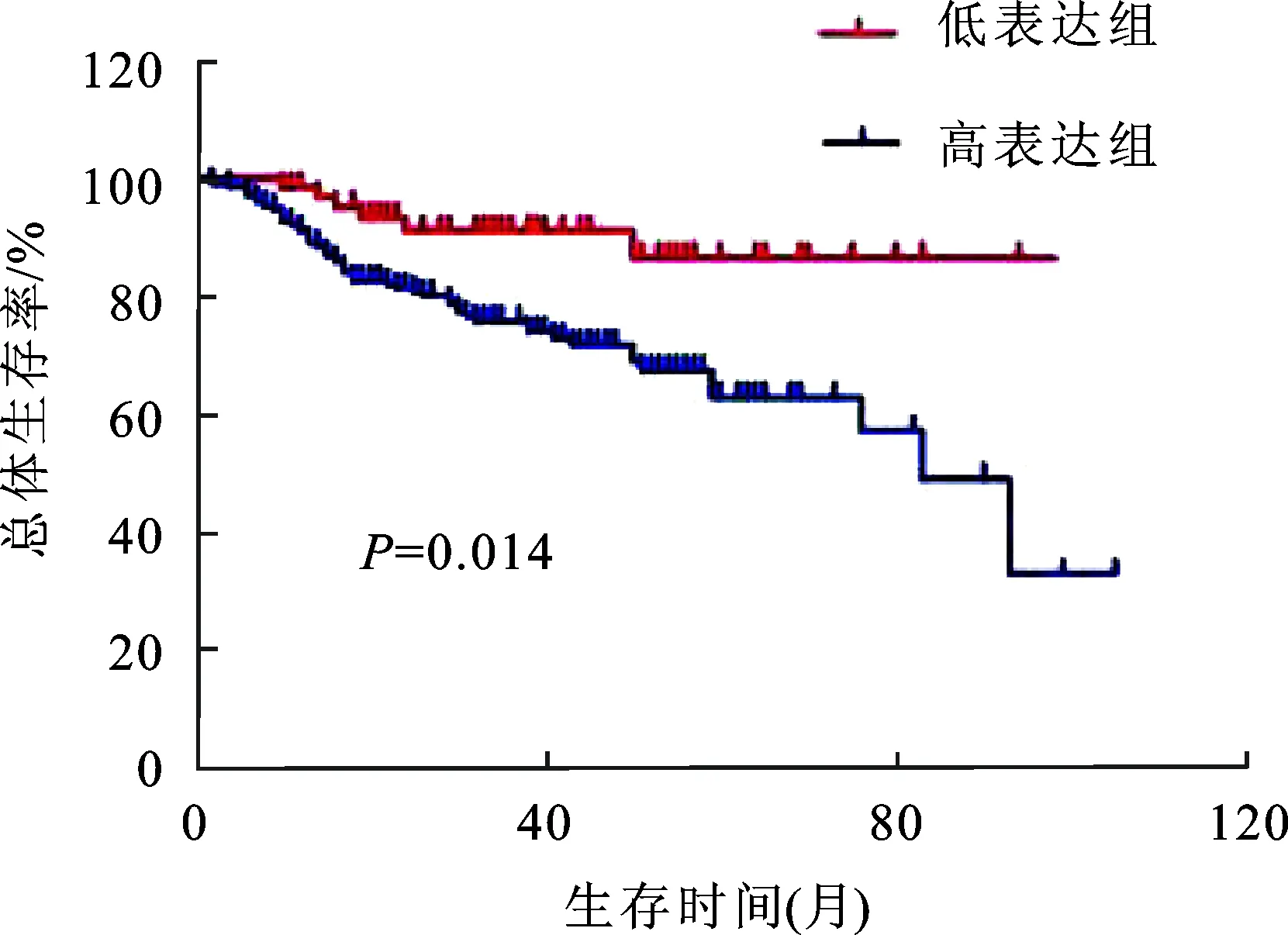
图2 KPNA2蛋白表达水平与UTUC患者生存率之间的关系
3 讨 论
KPNA2(karyopherin a2)基因位于人染色体17q24.2,全长约14 459 bp,其编码产物是含529个氨基酸的蛋白质,分子量为62 ku。KPNA2蛋白是karyopherin a/importin a输入蛋白家族一员[7-8],作为生物大分子物质核质转运过程中一种重要的核转运受体蛋白,在乳腺癌、肺癌、卵巢癌、前列腺癌、胃癌、肝癌、膀胱癌等多种恶性肿瘤中高表达,与肿瘤的发生、发展密切相关,而且与患者的不良预后有关[9-14]。目前,国内外文献中尚无关于KPNA2在上尿路尿路上皮癌的研究报告,因此,探讨KPNA2在UTUC中的表达水平、临床意义及其对肿瘤细胞生物学行为的影响,可为UTUC发病机理的阐述、早期诊断、以及预后评估提供新思路。
本研究使用组织芯片和免疫组织化学方法检测265例UTUC组织和146例癌旁正常尿路上皮组织中KPNA2的表达情况,结果发现KPNA2蛋白主要定位在细胞核中,与其他恶性肿瘤中的表达情况相似[9-10]。KPNA2蛋白高表达率在UTUC组织标本中为74.34%,在癌旁组织标本中为24.66%,差异具有统计学意义(P<0.05),提示KPNA2的异常表达可能与UTUC发生、发展有关。
根据实验结果接下来分析了KPNA2蛋白表达与UTUC临床病理特征之间的关系,结果发现KPNA2在UTUC组织中的表达与患者的T分期、G分级和术后膀胱复发有关,与患者的年龄(P=0.265)、性别(P=0.312)、肿瘤大小(P=0.582)和肿瘤边侧(P=0.386)无关。KPNA2的表达强度随着T分期的增高和组织分化程度的变化呈现逐渐高表达趋势,提示KPNA2在UTUC肿瘤进展、晚期浸润和转移过程中可能发挥重要作用。研究结果与KPNA2在其他肿瘤中的研究结果相似,2007年DANKOF等[15]对浸润性乳腺癌、癌旁正常组织和乳腺导管原位癌癌组织进行免疫组化实验,结果发现KPNA2的表达与肿瘤的分级、分期及淋巴管浸润呈正相关,提示KPNA2与乳腺癌的发生发展有重要关系。2012年SAKAI[16]运用免疫组织化学方法研究了116例食管癌患者的KPNA2的表达,结果发现KPNA2的高表达与肿瘤的低分化、静脉侵犯、肿瘤分期正相关。
2012年HE等[17]发现在卵巢生殖细胞肿瘤中,KPNA2的表达水平明显升高,与肿瘤的病理类型和复发率正相关,与5年总体生存率和无疾病进展存活率有关,是一个独立的预测因素。2011年丹麦学者JENSEN等[18]研究了KPNA2基因在肌肉非浸润性膀胱癌和肌肉浸润性膀胱癌中的表达,结果发现在Ta、T1期肿瘤中,KPNA2的高表达预示较高的疾病进展的风险,在肌肉浸润性膀胱癌患者中,高表达的KPNA2往往提示患者行根治性手术后有较差的预后。本研究运用Kaplan-Meier法和对数秩检验(Log-ranktest)进行生存分析,发现KPNA2低表达组5年总体生存率(88.2%)明显高于KPNA2高表达组(77.3%,P=0.005),推测KPNA2的表达水平同样可预测UTUC患者预后。目前关于KPNA2与肿瘤关系的研究多数是有关临床病理特征或预后关系的研究,涉及KPNA2促进肿瘤进展的机制研究较少。2016年TSAI等[19]研究发现miR-26b通过KPNA2/c-jun途径可抑制胃癌细胞迁移和侵袭,提出miR-26b过表达或KPNA2/c-jun抑制可能具有抑制胃癌转移的治疗潜力。
综上所述,KPNA2在UTUC组织中高表达,与UTUC患者的T分期、G分级和术后膀胱复发有关,而且影响患者的5年生存率。提示KPNA2可作为UTUC患者早期诊断和预后评估的潜在生物标志物。

