新疆芹菜根提取物抑制HepG2细胞体外脂肪堆积的实验研究
张晓霞, 韩 丽, 孙 晶, 田 莉
(1新疆医科大学中医学院, 乌鲁木齐 830011; 2新疆喀什地区第一人民医院药学部, 新疆 喀什 844000)
高脂血症(hyperlipemia,HLP)是因外源性脂质摄入过多或内源性脂质代谢紊乱导致血清中总胆固醇(total cholesterol,T-CHO)、甘油三酯(triacylglycerol,TG)和低密度脂蛋白(low density lipoprotein cholesterol,LDL-C)高于正常值,或伴有高密度脂蛋白(high density lipoprotein cholesterol,HDLC)低于正常值为特征的病症[1]。临床用于治疗HLP、调节脂质代谢的药物主要有他汀类、贝特类、胆酸结合树脂类、烟酸类等,但患者长期服用后均有停药反跳、消化道不适、肝肾功能损伤、横纹肌溶解症等不良反应[2-3]。目前从药食同源的中药、天然药物中寻找疗效确凿、安全可靠、可长期使用的调脂药物成为学者关注的热点[4]。新疆芹菜根为伞形科植物旱芹(ApiumgraveolensL.)的干燥根,主要含有强心苷、皂苷、有机酸、黄酮类等化学成分[5],具有降压利尿,凉血止血的功效,临床主要用于治疗高血压、小便热涩不利、尿血、崩中带下等[6]。芹菜根的乙醇提取物具有明确的护肝、降压及调脂作用[7-9]。本研究采用体外HepG2细胞脂肪堆积模型考察新疆芹菜根提取物的调脂活性,现报道如下。
1 材料与方法
1.1 仪器Smart Cell HF-90型CO2细胞培养箱(上海力新仪器有限公司),Eclipse TS100-F型荧光倒置显微镜(日本尼康公司),MultiskanGo型酶标仪(美国Thermo公司),HF1200LC型生物安全柜(上海力新仪器有限公司),Neofuge 15R型台式高速冷冻离心机(上海力新仪器有限公司),TGL-16GB型台式低速离心机(上海安亭科学仪器厂),DK-80型恒温水浴锅(上海精宏仪器厂),AB304-S型电子分析天平(德国梅特勒公司)。
1.2 试药菲诺贝特(美国Sigma公司,批号BCBQ5856V),棕榈酸(美国Sigma公司,批号SLBD2406V),油酸(美国Sigma公司,批号BCBQ5856V),DMSO(美国Sigma公司,批号RNBD4864),胎牛血清(美国Life Technologies公司,批号MSC500),MEM培养基(江苏凯基生物技术股份有限公司,批号KGM41500N-500),PBS缓冲液(美国Hyclone公司,批号AC10257442),胰蛋白酶(美国Hyclone公司,批号J170018),青-链霉素双抗(美国Hyclone公司,批号SC30010),CCK-8试剂盒(上海贝博生物试剂公司,批号J30608),油红O染液(南京建成生物工程研究所有限公司,批号D027-500),T-CHO试剂盒(南京建成生物工程研究所有限公司,批号A111-1),TG试剂盒(南京建成生物工程研究所有限公司,批号A110-1),LDH试剂盒(南京建成生物工程研究所有限公司,批号A020-2),SOD试剂盒(南京建成生物工程研究所有限公司,批号A001-1)。
1.3 细胞人肝癌细胞HepG2细胞株(上海中乔新舟生物科技有限公司,批号ZQ0022)。
1.4 药液配制
1.4.1 芹菜根提取物贮备液的制备 取新疆芹菜根干燥粗粉(40目)适量,加入6倍量70%乙醇回流提取2次,每次1 h,过滤,合并滤液,减压浓缩得粗提物,用乙酸乙酯萃取粗提物至萃取液无色,减压浓缩萃取液,干燥,得乙酸乙酯萃取部位。采用D101大孔树脂富集纯化乙酸乙酯萃取部位,分离条件:装柱径高比1∶6,上样浓度42.23 μg/mL,吸附时间1 h,70%乙醇为洗脱液,洗脱流速1.0 mL/min,将洗脱液减压浓缩,冷冻干燥,即得新疆芹菜根提取物,称取50 mg,用DMSO溶解制成浓度为100 mg/mL的储备液,备用。
1.4.2 游离脂肪酸(FFA)的制备 分别称取油酸(OA)和棕榈酸(PA)适量,用DMSO分别溶解制成浓度分别为0.66 moL/L和0.33 mol/L的储备液,混合,经0.22 μm微孔滤膜过滤即得FFA,备用。
1.4.3 菲诺贝特贮备液 称取菲诺贝特10 mg,用DMSO溶解制成100 μmol/L的贮备液,备用。
1.4.4 油红O工作液的制备 参照油红O染液说明书,按体积比油红O贮备液∶稀释液=5∶2配制工作液,避光操作,双层中性滤纸过滤,即得。
1.5 细胞的培养方法取HepG2细胞用含双抗、10%胎牛血清的MEM完全培养基接种于25cm2无菌培养瓶中,在5%CO2培养箱中,37℃饱和湿度培养1 w,荧光倒置显微镜下观察细胞密度。
1.6 HepG2细胞生长曲线的绘制方法用MEM完全培养基将生长状态良好的HepG2细胞制成单细胞悬液,接种于96孔板中,37℃下,5%CO2培养箱中培养,弃培养基。每孔再加入100 μL 10%CCK-8溶液,37℃继续孵育1 h,用酶标仪在450 nm波长处测定OD值,绘制HepG2细胞7 d的生长曲线。
1.7 HepG2细胞脂肪堆积模型的建立方法[10]将MEM完全培养基培养的HepG2细胞接种到24孔板培养24 h,吸弃培养基,将细胞随机分为3组,分别加入不同浓度FFA(1.0、1.5、2.0 mmol/L)诱导细胞,37℃培养箱孵育24 h,吸弃培养基,用PBS洗涤,加4%多聚甲醛固定细胞后,吸弃,PBS洗涤3次,加油红O工作液孵育染色15 min,吸弃,复染,弃去染液,PBS清洗3次,荧光倒置显微镜下观察脂滴大小及数量。
1.8 芹菜根提取物最佳作用浓度的确定方法[11]取HepG2细胞接种至96孔板培养24 h,PBS清洗3遍,设立空白对照组(1%胎牛血清)、模型组(1.5 mmol/L FFA)、菲诺贝特组(100 μg/mL)、芹菜根提取物组(含1% BSA和1.5 mmol/LFFA的MEM培养基稀释储备液至0.10、0.25、0.50、0.75、1.00、1.25、1.50、1.75 mg/mL),加入不同处理组样品,每组设立5个复孔,干预24 h后,每孔分别加入100 μL 10% CCK-8溶液,孵育1 h,用酶标仪测定450 nm波长处的OD值,细胞抑制率/%=1-OD给药组450nm/OD对照组450nm×100,计算IC5、IC10、IC50,确定芹菜根提取物最佳作用浓度。
1.9 芹菜根提取物清除HepG2细胞脂肪堆积实验方法将MEM完全培养基稀释的HepG2细胞单细胞悬液(5×104个/mL)接种于24孔板中培养24 h,设立空白对照组(MEM完全培养基)、模型组(1.5 mmol/LFFA)、菲诺贝特组 (l.5 mmol/L FFA+100 μmol/L菲诺贝特)、芹菜根提取物组(1.5 mmol/L FFA+330 μg/mL,1.5 mmol/L FFA+430 μg/mL)。每组设立5个复孔, 37℃,5% CO2培养24 h,PBS缓冲液洗涤3次,4%多聚甲醛固定30 min,弃去,用PBS缓冲液洗涤3次,加入油红O工作液,孵育15 min。弃去,用PBS缓冲液洗涤3次,复染3min,用PBS缓冲液洗涤3次,荧光倒置显微镜下观察各组HepG2细胞的脂滴大小及数量。
1.10 HepG2细胞内生化指标测定方法将HepG2细胞接种到25 cm2的培养瓶中,37℃,5% CO2培养24 h,按“1.9”项下方法分组并加入相应药物干预24 h后,用PBS缓冲液洗涤2次,1 000 r/min,离心10min,留沉淀,加0.1 mL PBS缓冲液(含1%TritonX-100),裂解40 min后参照试剂盒方法测定TG、T-CHO含量和LDH、SOD活性。
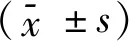
2 结果
2.1 HepG2细胞生长曲线的绘制HepG2细胞在第1天生长缓慢处于潜伏期,第2天至第3天生长速度最快,逐渐进入对数增长阶段,第6天至第7天增长缓慢,进入平台期,见图1。

图1 HepG2细胞的生长曲线图
2.2 HepG2细胞脂肪堆积模型的建立空白对照组细胞含有少量红色脂滴,细胞边界清楚;1.5 mmol/L FFA诱导模型组细胞24 h后,细胞间距变大,被染成鲜红色的脂滴密集环绕在细胞膜外,细胞核被染成深蓝色,表明HepG2细胞脂肪堆积型建模成功,见图2。


A: 正常组 B: 模型组
2.3 芹菜根提取物最佳作用浓度的确定芹菜根提取物对HepG2细胞的IC5、IC10、IC50分别是330、430、961 μg/mL,选取IC5、IC10作为芹菜根提取物后续药效学研究的最佳作用浓度,见表1。
表1 不同浓度芹菜提取物对HepG2细胞生长的影响

表1 不同浓度芹菜提取物对HepG2细胞生长的影响
芹菜根提取物的浓度/(μg/mL)抑制率/%RSD/%1001.90±0.9348.942505.69±1.1119.5150015.29±0.936.0875035.34±7.1720.291 00050.57±0.501.001 25071.23±0.540.761 50080.01±1.682.101 75081.85±1.682.05
2.4 芹菜根提取物清除HepG2细胞脂肪堆积结果空白对照组细胞内未见脂滴,细胞外有少量鲜红色脂滴;模型组细胞内红色脂滴数量显著增加,细胞外有大量鲜红色脂滴。与模型组相比,菲诺贝特组、芹菜根提取物组细胞内、外脂滴数目均明显减少,见图3。
2.5 芹菜根提取物对HepG2细胞内生化指标的影响FFA诱导引起HepG2细胞中TG和T-CHO含量增加,LDH从细胞内向细胞液中释放,细胞内的含量减少,SOD活性增加。与空白对照组比较,模型组HepG2细胞中TG、T-CHO含量增加,LDH、SOD活性降低,差异有统计学意义(P<0.05);芹菜根提取物组和菲诺贝特组HepG2细胞中TG、T-CHO含量降低,LDH、SOD活性增加,差异有统计学意义(P<0.05),见表2。





a: 空白对照组 b: 模型组 c: 菲诺贝特组 d: 芹菜根提取物IC5组 e: 芹菜根提取物IC10组
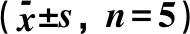
表2 芹菜根提取物对HepG2细胞模型中生化指标的影响
注:与空白组比较,△P<0.05; 与模型组比较,*P<0.05。
3 讨论
肝脏脂肪积聚是导致肝功能异常的主要原因,TG、T-CHO是HLP症肝脏中蓄积的主要脂质[12]。FFA诱导建立肝细胞脂肪堆积模型,符合HLP形成的病理生理过程,采用FAA诱导细胞24 h后,细胞膜通透性增大,使细胞中TG大量堆积,但细胞损伤不严重,细胞状态良好[13-14];同时,大量的LDH从胞内释放到胞外,使胞内的LDH含量降低。细胞内产生大量引起脂质过氧化的氧自由基,使大量消耗内源性抗氧化体系被消耗,导致SOD活性减弱,产生氧化应激状态[15]。本研究通过筛选确定采用1.5 mmo/L浓度的 FAA诱导HepG2细胞建立体外脂肪堆积模型,并用不同浓度的芹菜根提取物干预,随着芹菜根提取物浓度的逐渐增加,HepG2细胞存活率逐渐降低,表明其抑制HepG2细胞生长有浓度依赖性,实验后期选取芹菜根提取物对细胞毒副作用小的IC5和IC10作为最佳浓度,均可降低HepG2细胞脂肪堆积模型中TG、T-CHO的含量,增加LDH、SOD的活性。芹菜根提取物具有清除HepG2细胞中脂肪堆积的作用,推测其在脂肪肝的治疗方面具有潜在的药用价值。
——细胞脂类代谢的细胞器

