阻断β-catenin基因对亚砷酸钠诱导大鼠肺组织氧化应激的影响
徐梦伟, 孙高峰, 谢惠芳
(1新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室, 乌鲁木齐 830011;2乌鲁木齐市疾病预防控制中心慢性非传染性疾病防治科, 乌鲁木齐 830000)
砷的丰度在地壳中排名第20位,在海水中排名第14位,在人体中排名第12位,是全球危险的环境毒物之一,也是一种广泛分布于自然界的类金属元素[1]。饮水型砷波及范围广,受害人群众多,是全球主要的公共卫生问题之一。砷及无机砷可致机体多脏器多系统损伤[2],且其致肺癌已被癌症研究机构认证 (IARC)。流行病学调查研究发现,无机砷能够引起人体肺功能下降[3],支气管扩张[4],慢性阻塞性肺疾病[5]等肺部疾病。体外细胞实验研究发现,砷可诱导肺上皮细胞(LEC)中产生活性氧(ROS),引起氧化损伤[6-7]。ROS还可在翻译后水平上负性调节蛋白质活性,通过调节特定转录因子而改变基因表达[8],从而影响细胞内某些信号通路转导,引起基因表达改变。由此,本实验拟通过SD大鼠饮用含有不同浓度的亚砷酸钠(NaAsO2)溶液及β-catenin siRNA转染,探讨阻断β-catenin基因对NaAsO2致大鼠肺组织氧化应激的影响,为砷致肺组织损伤的机制研究提供理论依据。
1 材料与方法
1.1 实验动物48只健康SPF(specific pathogen free)级SD大鼠[实验动物生产许可证号:SCXK(新)2011-0004;实验动物使用许可证编号:SYXK(新)2011-0001],体质量为(80±5)g,雌雄各半。饲养在温度18℃~22℃,相对湿度40%~60%,12 h昼夜交替的动物饲养房。已通过伦理委员会的批准(伦理审批号:IACUC201604-KI)。
1.2 仪器和试剂XS205分析天平[瑞士梅特勒-托利多仪器(上海)有限公司]、DB-IVA型不锈钢电热板(金坛市医疗仪器厂)、涡旋混匀器(金坛市医疗仪器厂)、AA240FS原子吸收分光光度仪(美国VARIAN公司)、酶标仪(美国 Thermo Fisher 公司)。
砷标准液(中国标准物质研究中心)、亚砷酸钠(山东西亚化学工业有限公司)、ROS试剂盒(南京建成生物工程研究所)、超氧化物歧化酶(SOD)ELISA试剂盒、谷胱甘肽(GSH)ELISA试剂盒、丙二醛(MDA)ELISA试剂盒(武汉Elabscience公司)、β-catenin siRNA转染试剂及阴性对照转染试剂(上海吉玛制药技术有限公司)。
1.3 建立大鼠砷中毒模型经1周适应性饲养后,采用随机数字表法按性别和体质量随机分为6组:对照组、低剂量组、中剂量组、空白对照高剂量组、转染β-catenin siRNA高剂量组及转染阴性对照高剂量组,每组8只,雌雄各半。采用自由经口饮水染毒,对照组大鼠自由饮用超纯水。根据霍恩氏法进行预实验确定半数致死剂量(LD50)为45 mg/kg,因此,3个染砷剂量组大鼠分别自由饮用含0.45 mg/kg、2.25 mg/kg和11.25 mg/kg不同NaAsO2水溶液,连续染毒至第16 周,10%的水合氯醛(0.3 mL/100 g体质量)麻醉大鼠处死。
1.4 大鼠β-catenin siRNA转染在染毒第16周时开始对大鼠进行腹腔注射β-catenin siRNA转染试剂和阴性对照转染试剂,连续转染1周。按0.49 μg/g β-catenin siRNA oligo加入核酸稀释剂,接着按1∶1加入生理盐水。β-catenin siRNA转染试剂序列详见表 1。

表1 β-catenin siRNA转染试剂序列
1.5 取样大鼠处死前禁食24 h,正常饮用超纯水或含砷水,用代谢笼收取尿样。待10%的水合氯醛麻醉大鼠后,解剖大鼠,腹主动脉采血3 mL,摘取大鼠取肺脏分装并放入液氮中迅速冷冻,随后保存于-80℃冰箱内。
1.6 大鼠体内砷含量测定
1.6.1 血样和尿样预处理 取0.5 mL血样或1 mL尿样加入50 mL锥形瓶内,加入混合酸(HNO3∶HClO4=4∶1)3 mL,摇匀后置于电热板上加热消化至无色透明印迹留于瓶底,冷却后用纯净水反复冲洗,转移到15 mL离心管中并定容至10 mL。
1.6.2 10%肺组织匀浆制备及预处理 取肺组织0.2 g,放入玻璃匀浆器,再加入预冷的生理盐水(组织重量的9倍),置于冰上进行匀浆。取1 mL肺组织匀浆加热消化同“1.6.1”项。
1.6.3 砷含量测定方法 采用石墨炉原子吸收法测定预处理后的血液、尿液和肺组织样品中的砷含量。每个样重复测量3遍,取平均值后比较。
1.7 大鼠肺组织病理学观察解剖大鼠后,取肉眼能看到的病变处1 cm×1 cm×0.5 cm肺组织,放入标记好的包埋盒内,浸入装有4%甲醛的广口瓶中,固定时间24 h以上,经过包埋、切片、HE染色,最后镜检。
1.8 化学荧光法测定大鼠肺组织ROS含量取1 mm3左右的肺组织,用机械法收集细胞悬液,500 r/min离心10 min后去上清液,并用1 mL PBS洗涤2次,重悬制备单细胞悬液(细胞计数总数不少于104个细胞);加入10 μM的DCFH-DA,37℃孵育30 min;1 000 r/min离心10 min后收集单细胞悬液(探针标记),再用PBS洗涤2次,重悬后按照说明书进行测定。
1.9 ELISA法测定大鼠肺组织MDA、GSH、SOD含量称取0.2 g肺组织,用预冷的PBS (0.01 M,pH=7.4) 冲洗残留血液,将肺组织与对应体积的PBS(按1∶9的重量体积比,并在PBS中加入1%PMSF)加入玻璃匀浆器中,于冰上充分研磨。反复冻融使肺组织细胞裂解,于5 000 r/min离心10 min,取上清液按照说明书测定。
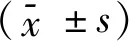
2 结果
2.1 大鼠血砷、尿砷和肺组织砷含量的变化染砷组大鼠血砷、尿砷和肺组织砷水平随着染砷剂量增加和染砷时间延长呈上升趋势。对照组、低剂量组、中剂量组和空白对照高剂量组大鼠血砷和尿砷水平两两比较,差异均有统计学意义(P<0.05)。低剂量组和中剂量组大鼠肺组织砷含量较对照组升高,差异有统计学意义(P<0.05);空白对照高剂量组血砷、尿砷和肺组织砷水平较对照组、低剂量组和中剂量组增加,差异有统计学意义(P<0.05)。
阻断β-catenin基因后,转染β-catenin siRNA高剂量组和转染阴性对照高剂量组血砷、尿砷和肺组织砷水平较对照组、低剂量组和中剂量组明显增加,差异有统计学意义(P<0.05),见表2。
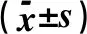
表2 各组大鼠血砷、尿砷和肺组织砷含量的比较
注:与对照组比较,aP<0.05; 与低剂量组比较,bP<0.05; 与中剂量组比较,cP<0.05。
2.2 大鼠肺组织病理学形态变化对照组大鼠肺组织病理学形态正常,肺泡壁薄,肺泡间隔无明显增宽,其内毛细血管无明显扩张、充血和炎症细胞浸润。低剂量组大鼠肺组织出现少量炎症细胞浸润,小部分肺泡间隔增宽,其余正常。中剂量组大鼠肺组织出现局灶性炎症细胞浸润,肺泡间隔增宽30%。空白对照高剂量组大鼠肺组织出现大量炎症细胞浸润,肺泡间隔增宽50%,局部肺泡融合,部分肺组织纤维化,有纤维素渗出。转染β-catenin siRNA高剂量组大鼠肺组织出现局灶性炎症细胞浸润,肺泡间隔增宽50%,肺泡腔融合、断裂,大部分肺组织纤维化,有纤维素渗出。转染阴性对照高剂量组出现局灶性炎症细胞浸润,肺泡间隔增宽40%,肺泡腔融合,部分肺组织纤维化,有纤维素渗出,见图1。
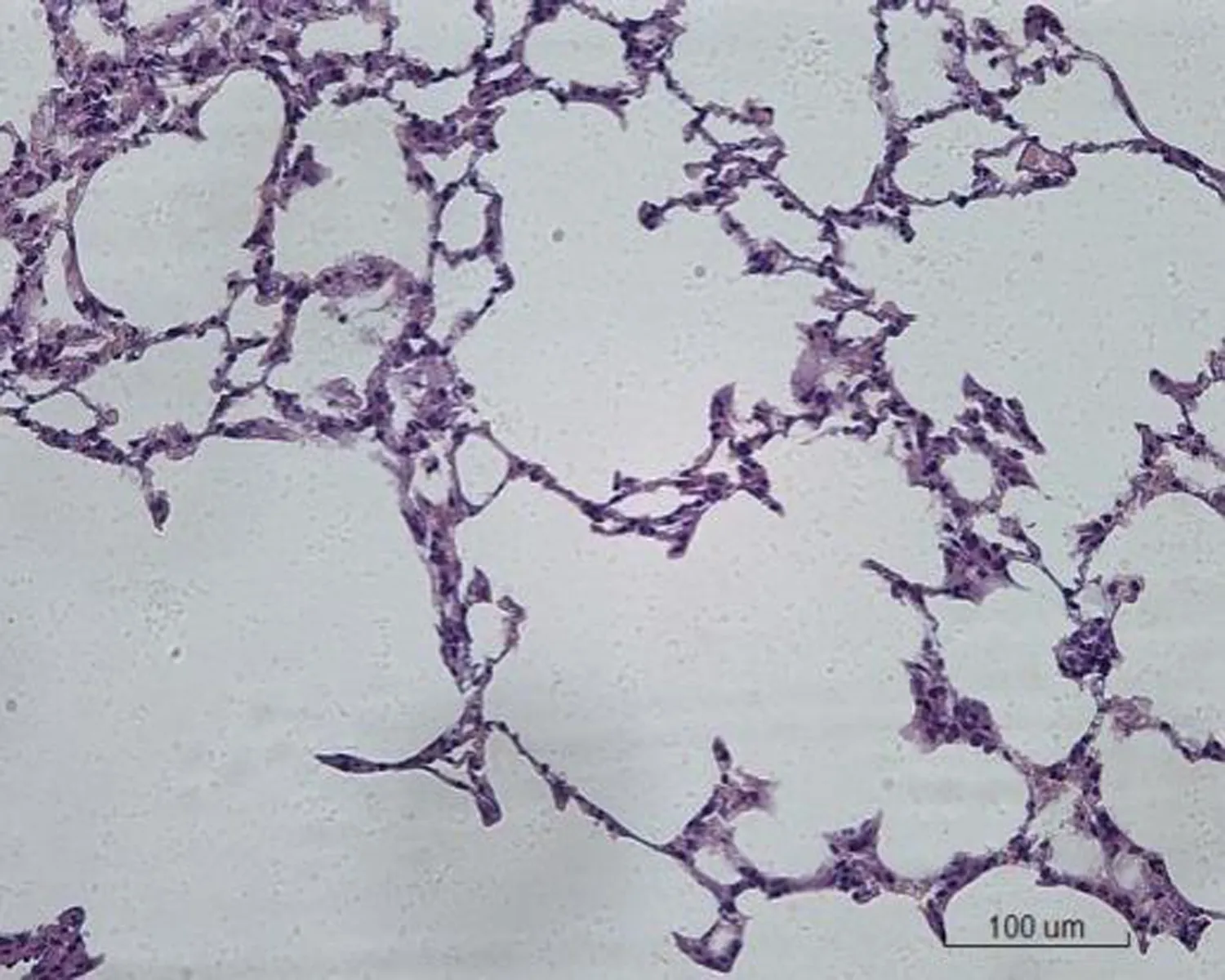
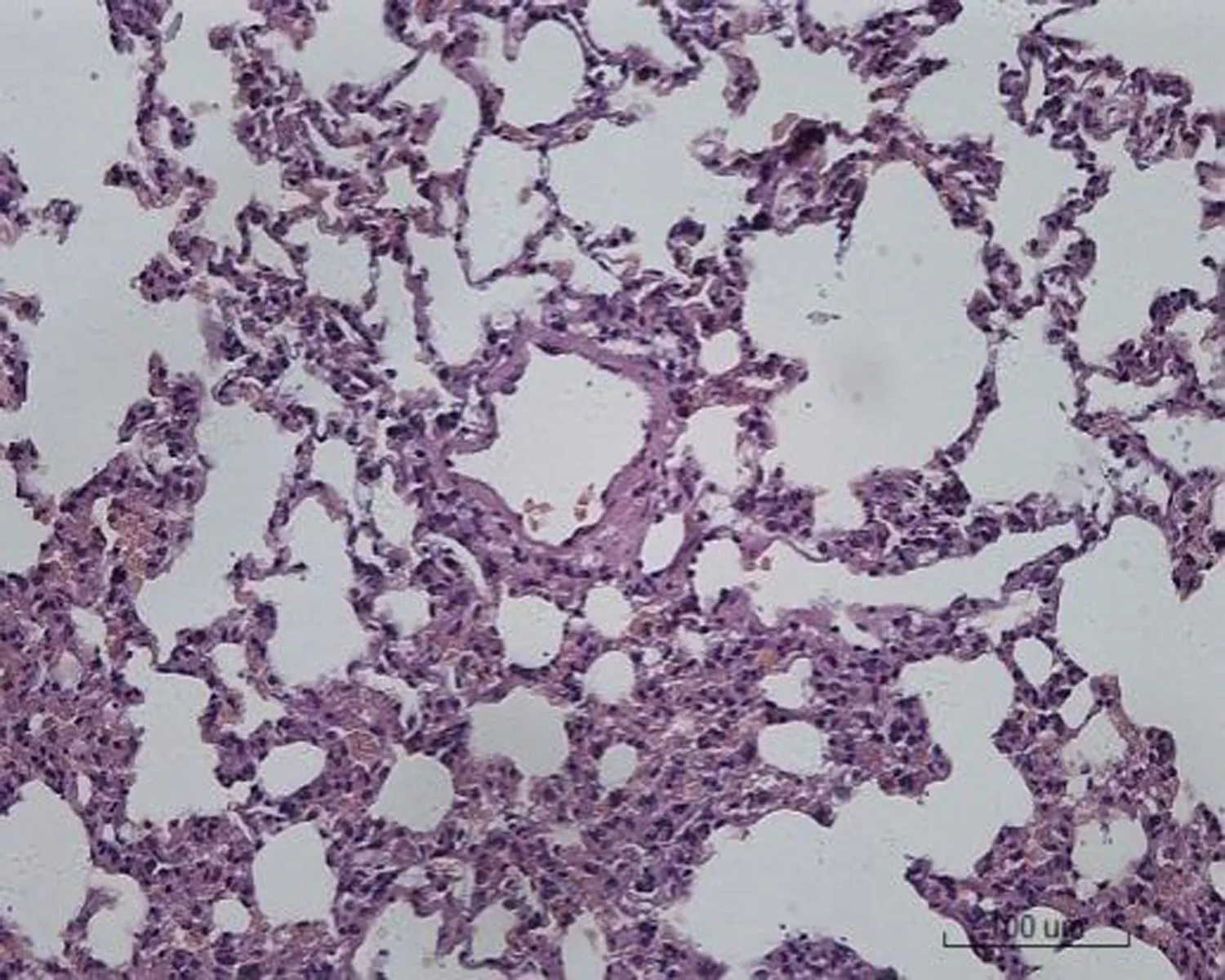

对照组 低剂量组 中剂量组
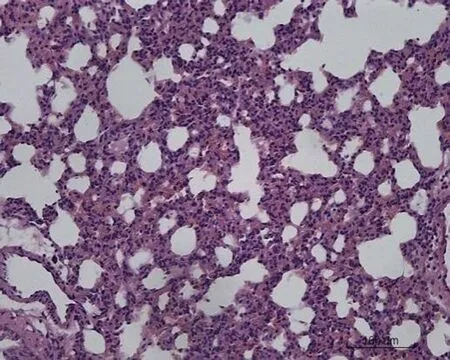
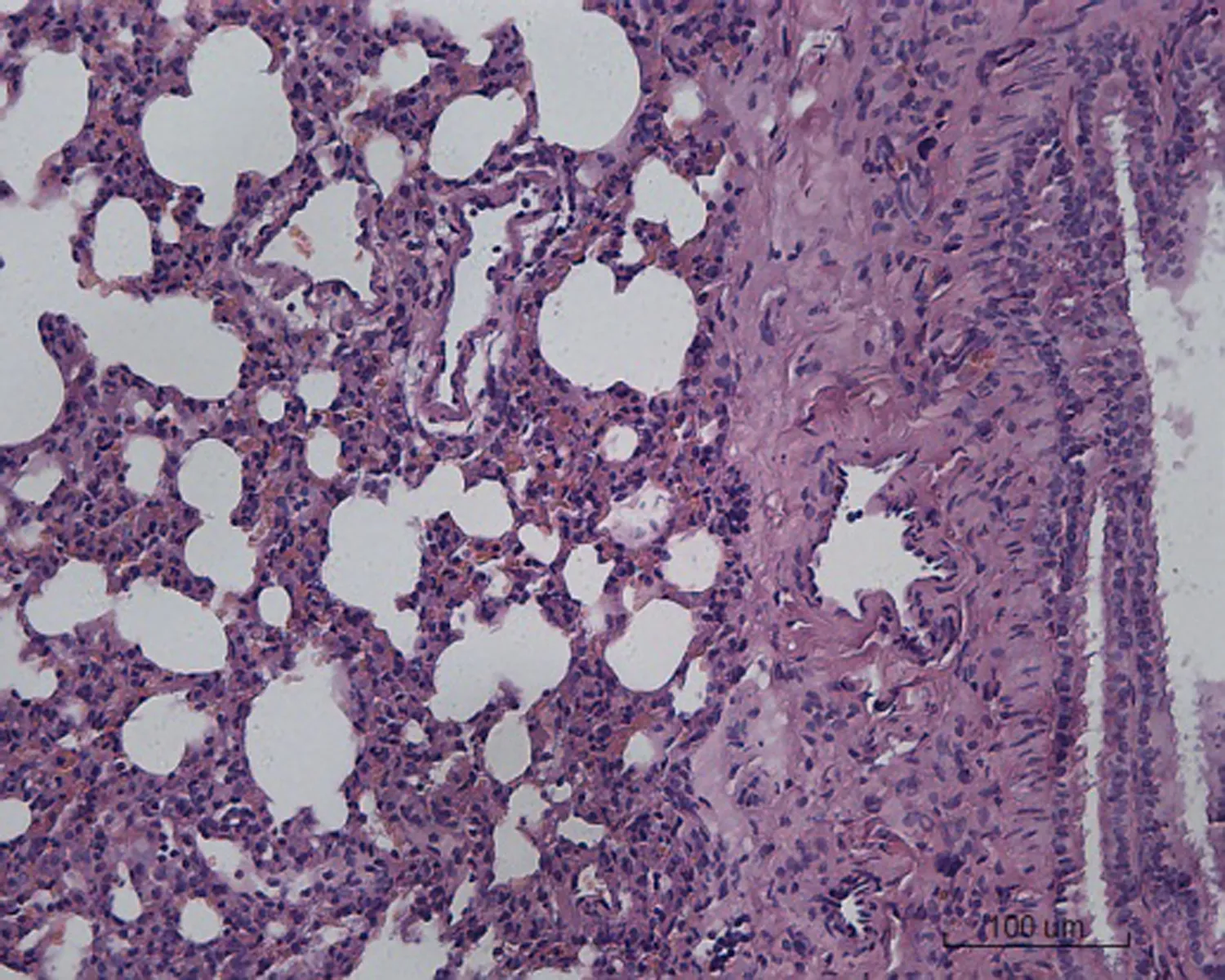
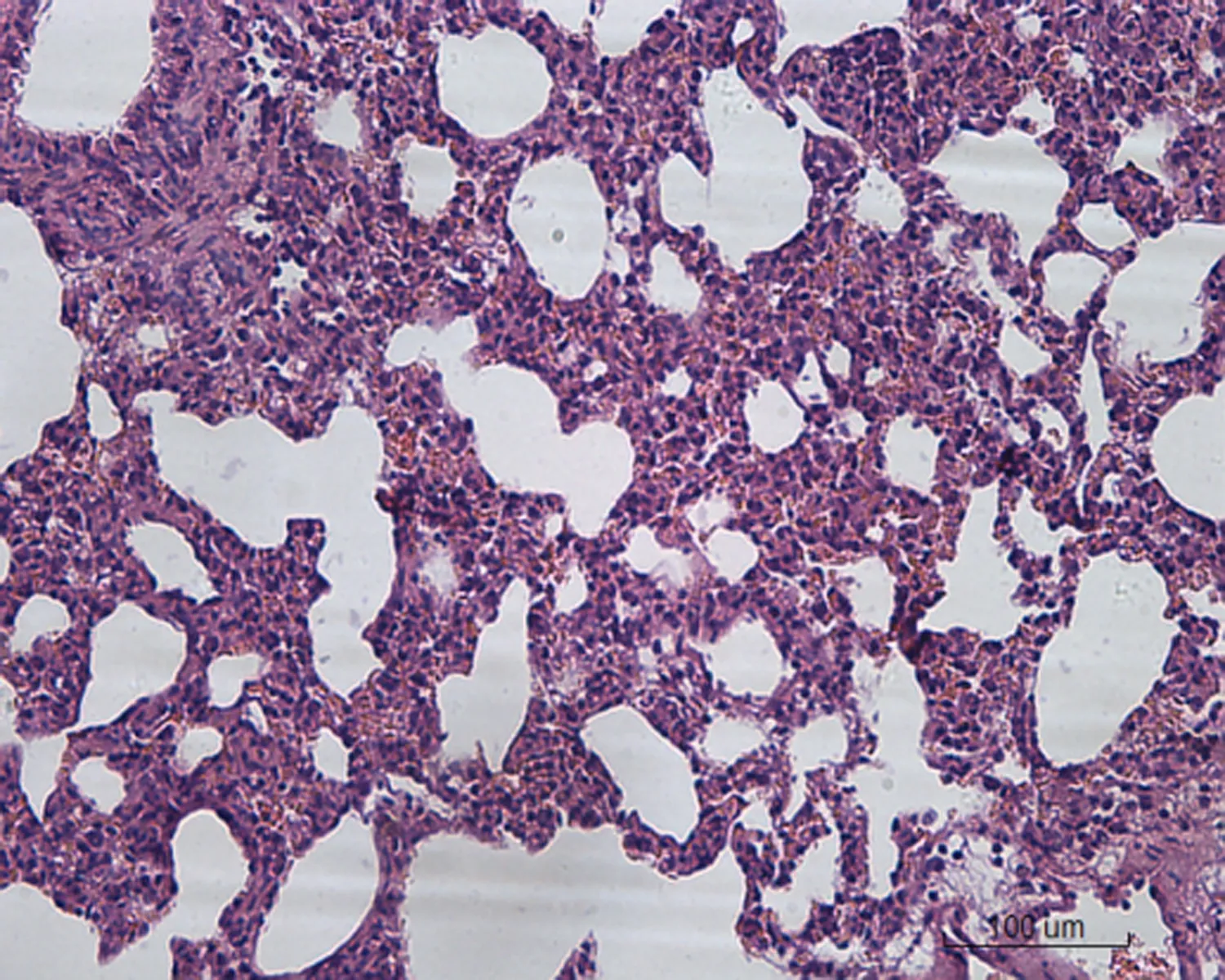
空白对照高剂量组 转染β-catenin siRNA高剂量组 转染阴性对照高剂量组
2.3 大鼠肺组织氧化和抗氧化水平的变化随着染毒剂量的增加和染毒时间的延长,大鼠肺组织中ROS荧光值和MDA含量呈上升趋势,而SOD和GSH含量呈下降趋势。空白对照高剂量组ROS荧光值较对照组、低剂量和中剂量组明显增加,差异有统计学意义(P<0.05);空白对照高剂量组MDA含量较对照组增加,差异有统计学意义(P<0.05)。空白对照高剂量组SOD和GSH含量较对照组和低剂量组减少,差异有统计学意义(P<0.05);中剂量组GSH含量较对照组和低剂量组减少,差异有统计学意义(P<0.05)。
阻断β-catenin基因后,转染β-catenin siRNA高剂量组和转染阴性对照高剂量组ROS荧光值较对照组、低剂量组和中剂量组增加,差异有统计学意义(P<0.05);MDA含量较对照组增加,差异有统计学意义(P<0.05)。而转染β-catenin siRNA高剂量组和转染阴性对照高剂量组SOD和GSH含量较对照组和低剂量组减少,差异有统计学意义(P<0.05),见表3。
表3 各组大鼠肺组织ROS荧光值、SOD、GSH和MDA含量的比较
注:与对照组比较,aP<0.05; 与低剂量组比较,bP<0.05;与中剂量组比较,cP<0.05。
2.4 大鼠肺组织砷含量和ROS荧光值之间的相关关系大鼠肺组织砷含量和ROS荧光值呈显著正相关(rs=0.655,P<0.001),见图2。
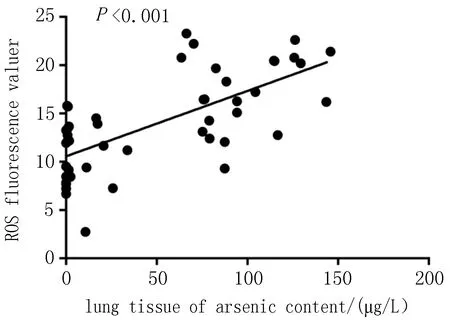
图2 大鼠肺组织砷含量与ROS荧光值的相关分析
2.5 大鼠肺组织中ROS荧光值与SOD、GSH和MDA含量之间的相关分析大鼠肺组织中ROS荧光值与SOD活性呈低度负相关(rs=-0.441,P<0.002);与GSH含量呈显著负相关(rs=-0.599,P<0.001);与MDA含量呈低度正相关(rs=0.395,P<0.006),见图3~5。

图3 大鼠肺组织中ROS荧光值与SOD含量的相关分析
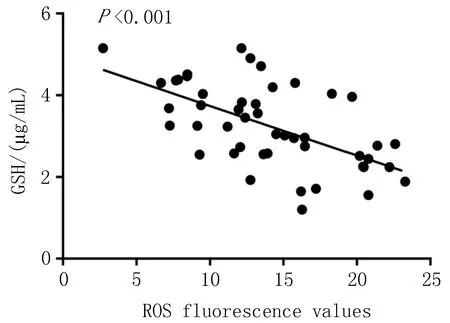
图4 大鼠肺组织中ROS荧光值与GSH含量的相关分析

图5 大鼠肺组织中ROS荧光值与MDA含量的相关分析
3 讨论
饮用砷污染的地下水是中国主要的健康问题,如新疆、内蒙古、甘肃等[9]。研究表明,长期饮用11~50 μg/L浓度范围的含砷地下水会对呼吸系统产生有害作用[10]。Meta分析发现,长期饮用100 μg/L浓度范围内的含砷水与肺癌显著相关[11]。因此,本实验通过大鼠饮用不同浓度(0.45 mg/kg、2.25 mg/kg和11.25 mg/kg)的NaAsO2水溶液建立砷中毒模型,在染砷第16周时一只空白对照高剂量组大鼠死亡[12],表明大鼠砷中毒模型已建立,开始β-catenin siRNA转染。砷是胞内毒物,饮用含砷水后,砷吸收入血与血红蛋白结合,随血液分布到机体各个脏器组织,肺是其中较容易蓄积的脏器组织[13-14]。砷暴露导致大鼠脏器组织损伤是由于砷在脏器组织内蓄积,发挥其毒性作用。本实验测定了大鼠血砷、尿砷和肺组织砷水平结果显示,大鼠血砷、尿砷和肺组织砷含量随着染砷剂量增加和染砷时间延长而升高,且大鼠体内血砷高于尿砷,表明砷在体内的排泄速度慢,导致其蓄积于肺组织内。组织病理学通常是临床诊断的金标准,具有重要的临床意义。本实验观察大鼠肺组织病理学改变,发现随着染砷剂量的增加和染砷时间的延长,呈现不同程度的炎症细胞浸润,肺泡间隔增宽,肺泡融合。空白对照高剂量组、转染β-catenin siRNA高剂量组和转染阴性对照高剂量组大鼠肺组织病理损伤较严重,出现不同程度的肺组织纤维化。由此表明,长期砷暴露可导致大鼠肺组织损伤,损伤程度随着染砷剂量的增加和染砷的时间延长而加重。siRNA干扰技术已广泛应用于实验研究和临床治疗,本实验通过阻断β-catenin 基因,发现转染β-catenin siRNA高剂量组大鼠血砷和肺组织砷水平较空白对照高剂量组和转染阴性对照高剂量组增多,虽未发现有统计学意义,但转染β-catenin siRNA高剂量组大鼠肺组织结构较模糊,病理损伤较空白对照高剂量组和转染阴性对照高剂量组严重。表明在阻断β-catenin 基因后,可能会导致大鼠肺组织病理损伤加重。推测在阻断β-catenin 基因后,砷可能较容易蓄积在大鼠肺组织中,导致肺组织损伤加重。

综上所述,长期砷暴露使砷在大鼠肺组织体内持续性蓄积产生毒性作用,诱导大鼠肺组织氧化应激,导致肺组织损伤。阻断β-catenin基因后,大鼠肺组织病理损伤加重,但未在氧化和抗氧化水平上体现,需进一步在分子水平上验证。

