基于赖氨酸修饰胶体金的花生黄曲霉毒素B1检测
黄星奕 叶伟涛 王成全 吕日琴 孙兆燕
(江苏大学食品与生物工程学院, 镇江 212013)
0 引言
花生是我国产量丰富、食用广泛的一种坚果[1]。在夏季高温、高湿情况下,花生易发生霉变,在霉变过程中会产生黄曲霉毒素、赭曲霉毒素、伏马毒素、黑曲霉毒素等霉菌毒素[2-4]。研究表明,在所有已知的霉菌毒素中,黄曲霉毒素B1(Aflatoxin B1,AFB1)的毒性、致畸性、致癌性均居于首位,其半数致死量(LD50)为0.294 mg/kg[5]。我国对农产品中AFB1含量具有严格的限制,规定花生及其制品中AFB1的含量(质量比)不得超过20 μg/kg[6]。农产品中AFB1的检测,对于减少霉菌毒素的危害具有重要的意义。
传统的霉菌毒素检测方法主要有生物学检测法、薄层分析法、高效液相色谱法等[7],由于这些方法操作复杂、预处理繁琐、处理时间长,研究者正不断开发新的检测方法[8]。纳米材料由于其量子尺寸效应,表现出与其他传统材料不同的特性,如光学性质、磁学性质、光催化作用等[9-11],国内外学者尝试使用纳米材料检测霉菌毒素。文献[12]利用AFB1抗体包被纳米金,制备了可用于小麦粉中AFB1快速检测的新型安培免疫传感器,检测限为0.3 μg/L。文献[13]通过合成的纳米粒子与黄曲霉毒素人工抗原抗体的竞争免疫结合,实现了新型的AFB1检测方法,检测限为0.03 ng/mL。文献[14]利用纳米粒子建立了一种OTA(赭曲霉毒素A)检测体系,通过溶液中游离的cDNA与加入的Ag+在NaBH4的存在下形成强荧光的纳米粒子,从而实现OTA的检测,检测限为2 pg/mL。文献[15]以磁性材料为载体,不同纳米材料为信号探针,构建磁控适配体比色、荧光、电化学传感体系,成功检测出花生中赭曲霉毒素A和伏马毒素B1。
传统的胶体金标记技术的实验步骤较为繁琐,需要构建人工抗原抗体,从而实现标记[16]。本文以胶体金为介质,制备赖氨酸修饰的金胶体系,以实现对霉变花生中AFB1的快速检测。
1 材料与方法
1.1 仪器
UV-2450型紫外可见分光光度计(日本岛津公司);JEOL 2100型透射电镜(日本JEOL公司);LA-20型高效液相色谱仪(日本岛津公司),配有荧光检测器;11830-RT型氮吹仪(美国Organomation公司);DF-101S型集热式磁力加热搅拌器(河南巩义市予华仪器厂);TG16-WS型台式高速离心机(长沙湘仪有限公司);XH-D型漩涡振荡器(无锡杰瑞安仪器设备有限公司)。
1.2 试剂
AFB1、OTA、FB1(伏马毒素B1)、氯金酸(HAuCl4)、柠檬酸三钠,购于Sigma-Aldrich公司;L-赖氨酸、三氟乙酸、正己烷,购于萨恩化学技术有限公司;HgCl2,购于山东西亚化学股份有限公司;乙腈,购于美国TEDIA公司;试验用水为二次去离子水。
1.3 赖氨酸修饰的胶体金制备
本实验采用柠檬酸三钠还原法制备胶体金[17],首先,称取8.9 mg的氯金酸固体粉末溶于100 mL的超纯水中,加热到沸腾,迅速加入12 mL的1%柠檬酸三钠溶液,持续加热。观察溶液的颜色变化,当溶液的颜色完全变为透明、澄清的酒红色时,停止加热。待溶液冷却至室温(20℃),4℃避光保存[18]。然后将5 mL的15 mol/L赖氨酸水溶液加入45 mL所制备的AuNPs(胶体金)中,150 r/min搅拌10 min,制备得到赖氨酸修饰的胶体金(Lys-AuNPs)溶液。利用紫外可见分光光度计和透射电镜对其进行表征。
1.4 AFB1测定原理与方法
Hg2+能够与AFB1形成稳定的螯合物。Hg是过渡金属元素,并且容易形成配位数为6的络合物。它的几何构型通常相当于由6个配位原子形成的八面体,使得配合物AFB1-Hg2+的共轭平面增强,刚性结构增加[19]。
本实验通过柠檬酸三钠还原HAuCl4制得胶体金,生成的溶液是一种胶体溶液,Lys-AuNPs粒子的表面覆盖着赖氨酸,颗粒之间通过静电排斥作用使得赖氨酸修饰的胶体金溶液保持着稳定性[20]。如图1所示,当溶液中加入HgCl2时,Hg2+会与赖氨酸上的氨基发生作用,破坏胶体溶液的稳定性,使溶液产生凝聚,颜色变成灰黑色。当溶液中混入AFB1,则Hg2+会与AFB1发生螯合反应,生成稳定的配合物,从而使破坏胶体溶液稳定性的Hg2+减少,随着AFB1浓度的升高,溶液中游离的Hg2+不断减少,颜色逐渐变为红色。通过紫外可见分光光度计对溶液进行吸光度测定,然后建立AFB1浓度与吸光度之间的相关关系。
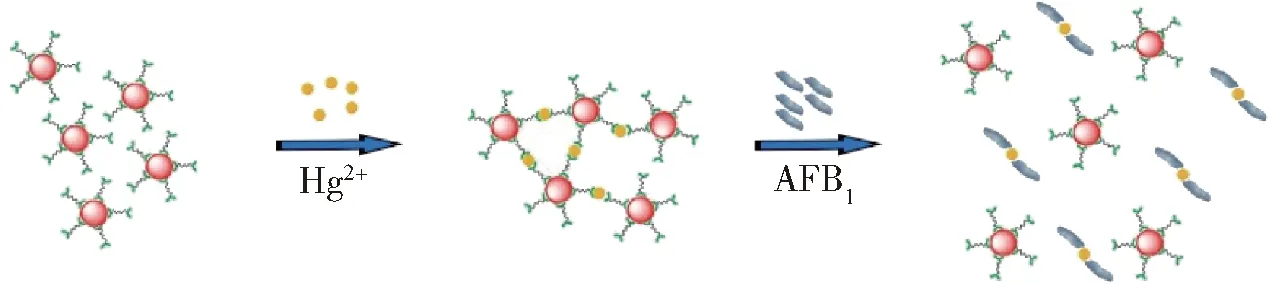
图1 赖氨酸修饰的胶体金溶液检测AFB1原理示意图Fig.1 Schematic of AFB1 detection by lysine-functionalized gold nanoparticles
在5 mL的离心管中加入15 μmol/L的HgCl2溶液100 μL和不同浓度的AFB1900 μL,漩涡振荡3 min,混匀。在混合液中加入1 mL的Lys-AuNPs溶液,漩涡振荡5 min。用紫外可见分光光度计测其吸收光谱,根据在725 nm和525 nm处吸光度比值建立AFB1浓度的校准曲线。
1.5 花生样本的制备
本批次实验花生仁样本均产于江苏省南通市,品种为冀花4号,并参考GB 5009.22—2016的方法进行预处理。首先,将花生样品研磨成粉末,称取0.5 g试样(精确至0.01 g)于50 mL离心管中。再加入20 mL质量分数25%的乙腈,漩涡混匀。然后用均质机均质3 min,在6 000 r/min下离心10 min,取其上清液备用。
1.6 AFB1的高效液相色谱法测定
色谱条件:流动相为25%乙腈;色谱柱为C18柱;流速1.0 mL/min;柱温40℃;进样体积50 μL;检测波长360 nm;发射波长440 nm。
柱前衍生:用移液管吸取4 mL的待测液于10 mL的离心管中,然后在50℃下用氮气慢慢地吹至近干,再加入200 μL的正己烷与100 μL的三氟乙酸,漩涡振荡30 s。在40℃的恒温箱中衍生15 min,在50℃下用氮气缓缓地吹至近干。用25%乙腈定容至1 mL,漩涡振荡30 s溶解残留物,最后过0.45 μm滤膜,收集滤液于进样瓶中备用。
2 结果与讨论
2.1 Lys-AuNPs溶液的表征与分析
将制备得到的赖氨酸修饰的胶体金溶液在透射电镜下进行观察,Lys-AuNPs的粒径大约为25 nm,图2为胶体金溶液在不同状态下的电镜图,图2a为赖氨酸修饰的胶体金溶液,颗粒间分散性良好;图2b中颗粒之间发生凝聚现象;图2c中颗粒之间又重新分散开。如图3所示,从紫外可见光谱图中可以发现Lys-AuNPs溶液仅在525 nm处存在一个吸收峰;当溶液中加入Hg2+时,溶液颜色会变成灰黑色,且溶液发生凝聚现象,会在525 nm和725 nm处形成2个吸收峰;当溶液中加入Hg2+和20 ng/mL的AFB1时,溶液在525 nm处的吸光度增加,在725 nm处的吸光度减小。

图2 胶体金溶液不同状态下的透射电镜图Fig.2 TEM images of different states of gold nanoparticles solution
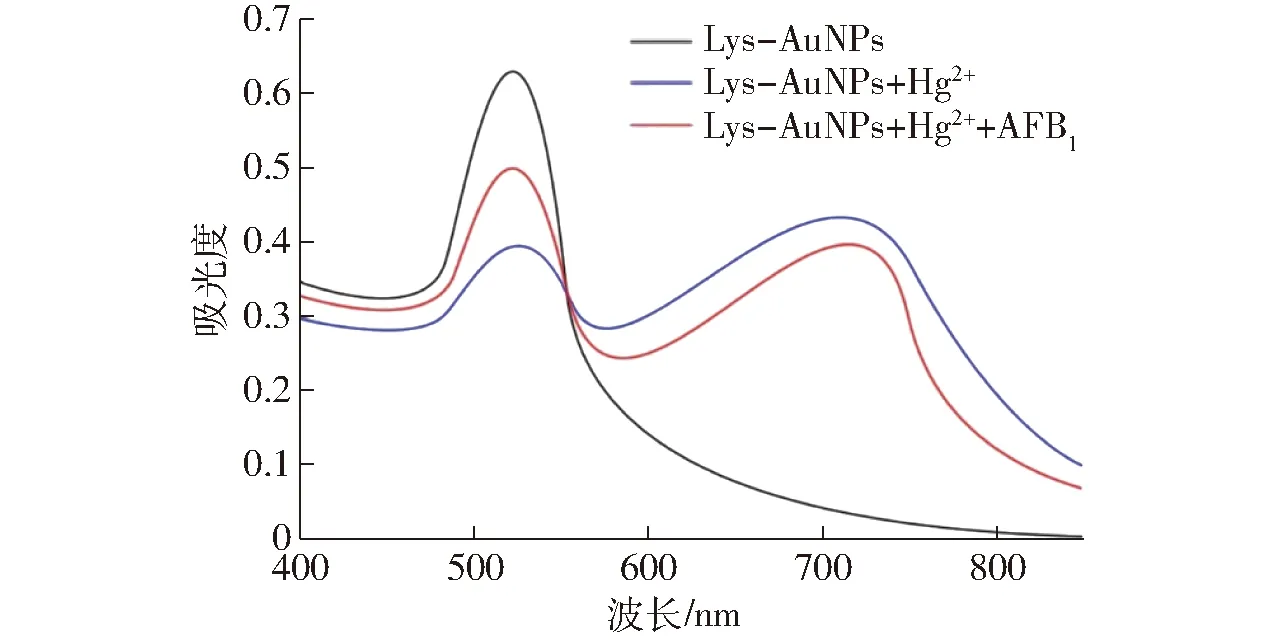
图3 溶液中加入Hg2+和AFB1后Lys-AuNPs的紫外可见光谱Fig.3 UV-visible spectra of gold nanoparticles solution after adding Hg2+ and AFB1
2.2 梯度实验
在Lys-AuNPs和Hg2+离子浓度一致的情况下,向体系中加入不同质量浓度(0、1、2.5、5、10、20、50、100、300、400、500 ng/mL)的AFB1溶液,混匀、平衡后观察其在不同质量浓度AFB1下Lys-AuNPs溶液的颜色变化和凝聚情况,并用紫外可见分光光度计测量混合后溶液的吸光度,其紫外可见光谱图如图4所示。
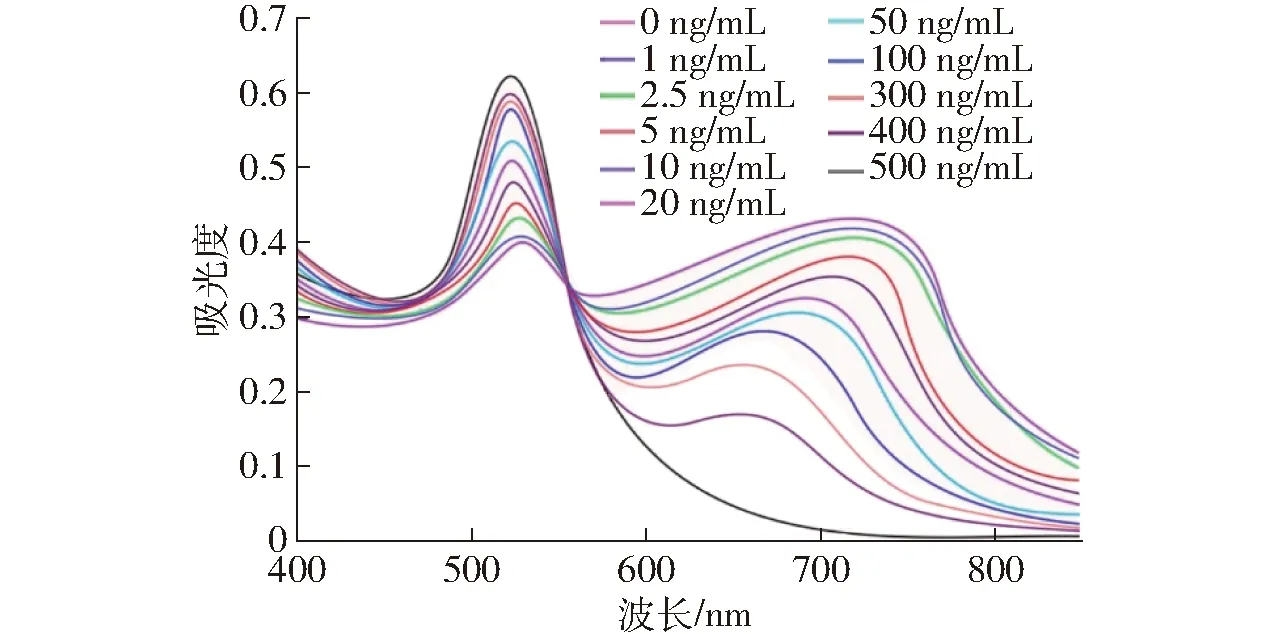
图4 溶液在不同AFB1质量浓度下的紫外可见光谱Fig.4 UV-visible spectrogram of different concentrations of AFB1

图5 溶液在不同AFB1质量浓度下的颜色Fig.5 Color of solutions with different concentrations of AFB1
当AFB1的质量浓度发生变化时,溶液的颜色也会产生相应的变化,如图5所示。当溶液中没有混入AFB1,只有Lys-AuNPs和Hg2+时,溶液呈灰黑色,此时溶液在525 nm处和725 nm处有两个吸收峰;随着AFB1质量浓度的不断增加,溶液的颜色由灰黑色逐渐变淡,最后向红色转变,Lys-AuNPs溶液在525 nm处的吸光度缓慢下降,而725 nm处的吸光度不断增加;当溶液中Hg2+全部与AFB1形成配合物时,溶液颜色变为红色,此时,紫外可见光谱图中只剩下一个吸收峰。观察溶液在525 nm和725 nm处双峰吸光度与AFB1浓度之间的关系可知,Lys-AuNPs溶液在725 nm处的吸光度A725与在525 nm处的吸光度A525之间的比值A725/A525随着AFB1质量浓度的增加而减小,逐渐趋向0。通过分析Lys-AuNPs溶液中AFB1质量浓度与A725/A525的相关关系发现,当溶液中AFB1质量浓度在1~50 ng/mL时,A725/A525与AFB1质量浓度有较好的线性关系,如图6所示,线性回归方程为y=-0.010 5x+1.144 7,决定系数R2=0.996,检出限为0.2 ng/mL。
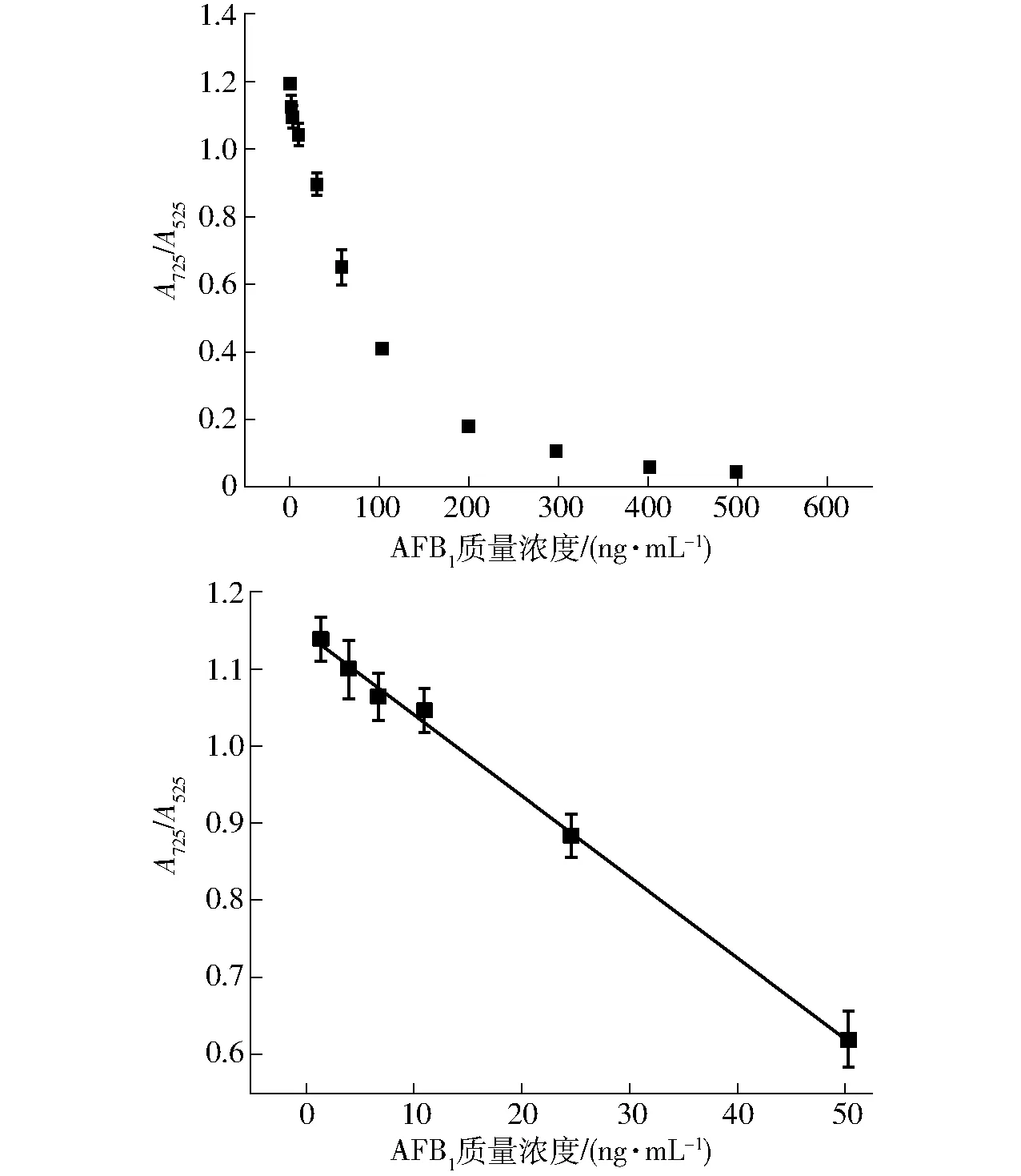
图6 A725/A525与AFB1质量浓度之间的关系Fig.6 Relationship between concentration of AFB1 and A725/A525 value
2.3 回收率和相对标准偏差
选取正常花生将其研磨成粉末,在50 mL的离心管中称取4份花生粉末,每份0.5 g,将等体积不同质量浓度的AFB1(0.5、1、10、50 ng/mL),加入20 mL的50%乙腈,漩涡混合,用均质机均质3 min,在6 000 r/min下离心10 min。然后利用Lys-AuNPs溶液测AFB1的质量浓度,得其加标回收率分别为85.0%、97.2%、110%、95.5%,平均加标回收率为96.9%,相对标准偏差为8.9%。
2.4 Lys-AuNPs溶液的特异性
为了研究本实验中制备的Lys-AuNPs溶液的特异性,通过选用霉变花生仁中其它霉菌毒素,如OTA和FB1作为干扰霉菌毒素,进行验证。取900 μL质量浓度为5 ng/mL的AFB1、OTA、FB1分别加入3支10 mL的离心管内,在离心管中分别加入15 μmol/L的HgCl2溶液100 μL,漩涡振荡3 min,使其充分混合。然后在每个离心管的混合液中分别加入1 mL的Lys-AuNPs溶液,漩涡振荡5 min,并用紫外可见分光光度计测其吸收光谱。图7为分别加入AFB1、FB1、OTA后的紫外可见光谱图,与空白组相比,加入5 ng/mL AFB1的溶液在525 nm处的吸光度明显上升,725 nm处的吸光度显著降低,而加入OTA与FB1的溶液的吸光度几乎没有变化。数据表明,目标物中混入AFB1时的吸光度变化率远高于混入OTA与FB1。由以上结果表明,此方法所构建的赖氨酸修饰的胶体金体系有较好的选择性,霉变花生仁中存在的OTA和FB1并不会影响AFB1质量浓度的检测,基于此建立的花生仁中AFB1含量的检测方法具有良好的特异性。
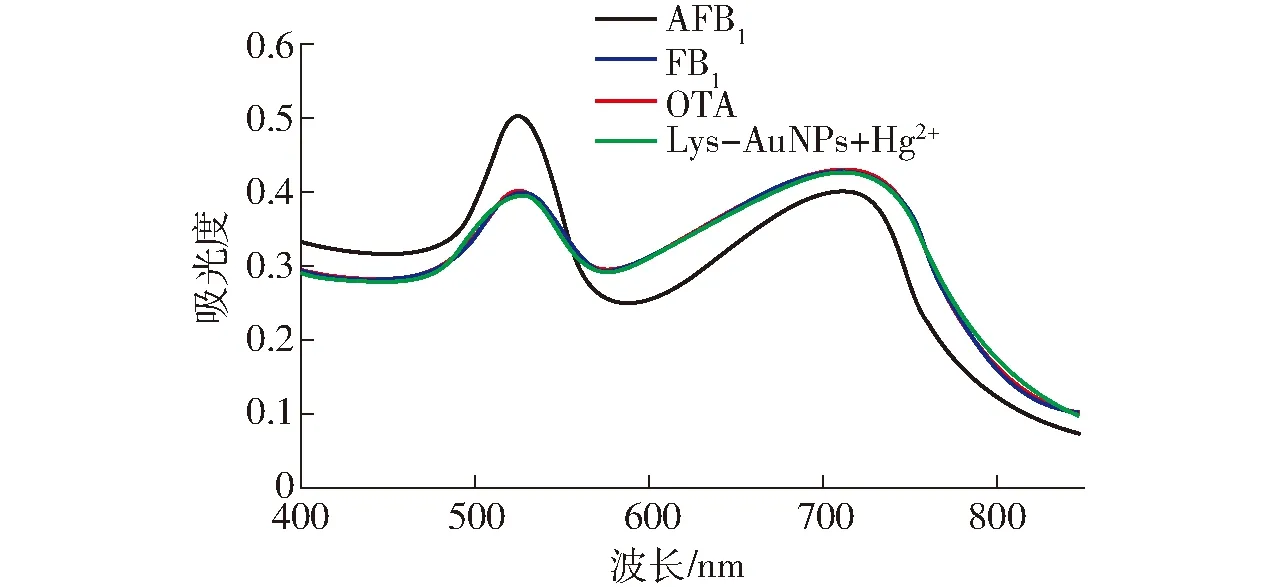
图7 AFB1、FB1、OTA的紫外可见光谱Fig.7 UV-visible spectrogram of AFB1, FB1 and OTA
2.5 AFB1含量的高效液相色谱法测定
用本研究提出的Lys-AuNPs溶液检测AFB1的方法检测溶液中AFB1的质量浓度,并用高效液相色谱法(HPLC)对AFB1的质量浓度进行验证。选取40个花生样品对其AFB1质量浓度进行测定与比较,由图8可知,用高效液相色谱法和Lys-AuNPs溶液测定的AFB1质量浓度的均方根误差为0.865 1 ng/mL,相关系数为0.996 1。结果表明由本实验所建立的赖氨酸修饰的胶体金体系可用于花生中AFB1的检测。
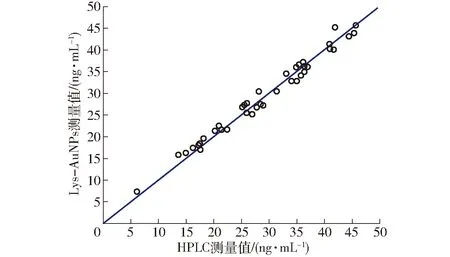
图8 用Lys-AuNPs和HPLC测定AFB1浓度的比较Fig.8 Comparison of results for AFB1 concentration determined by Lys-AuNPs and HPLC methods
3 结束语
提出了一种新的霉变花生中AFB1检测方法:用赖氨酸修饰的胶体金溶胶体系对霉变花生中AFB1进行检测。该方法无需使用光敏材料、酶试剂等,具有快速、简单、特异性好等优势,并且无需制备复杂的特异性抗体来检测黄曲霉毒素。Lys-AuNPs溶液检测AFB1的线性范围为1~50 ng/mL,决定系数0.996,检出限为0.2 ng/mL,平均加标回收率为96.9%,相对标准偏差为8.9%。该方法快速、准确、灵敏,可用于霉变花生中AFB1的检测。

