小麦-长穗偃麦草异染色体系筛选与鉴定
殷月辉 徐勤省 亓斐 鲍印广 王洪刚 李兴锋
摘要:二倍体长穗偃麦草(Thinopyrum elongatum (Host) A. Lve,2n=2x=14,EE)具有抗病性强、耐盐碱、抗旱、多花多实等优异性状。为明确引进的小麦-长穗偃麦草后代种质系的染色体遗传组成,本研究综合利用原位杂交与分子标记技术结合田间农艺性状对其进行鉴定。结果表明,16份小麦-长穗偃麦草种质系中,L20161461、L20161462两份材料是二体异附加系,分别附加6E和7E染色体;L20160940、L20160942、L20161457、L20161459四份材料是二体异代换系,分别是4E/4D、4E/4D、1E/1D、3E/3B;与中国春相比,L20160947的千粒重增幅57.02%,达到极显著水平;在2.2%NaCl溶液处理下,L20160940的耐盐性高于中国春。本研究为这些材料在小麦遗传改良中的进一步利用奠定了基础。
关键词:长穗偃麦草;小麦;异附加系;异代换系;原位杂交;分子标记
中图分类号:S512.103.2文献标识号:A文章编号:1001-4942(2019)04-0001-06
Abstract Diploid Thinopyrum elongatum (Host A. Lve, 2n=2x=14, EE) has excellent traits such as strong disease resistance, salt and alkali resistance, drought resistance and more flowers and seeds. In order to clarify the chromosome genetic composition of the introduced wheat-Th.elongatum progeny, in situ hybridization and molecular marker techniques combined with field agronomic traits were used in the study. The results showed that among the 16 wheat-Th.elongatum lines, L20161461 and L20161462 were disomic addition lines, added with 6E and 7E chromosomes respectively. L20160940, L20160942, L20161457 and L20161459 were the disomic substitution lines of 4E/4D, 4E/4D, 1E/1D and 3E/3B, respectively. The 1 000-grain weight of L20160947 increased by 57.02% compared with that of Chinese spring, which reached a very significant level. The salt tolerance of L20160940 was higher than that of Chinese spring under the treatment of 2.2% NaCl solution. This study laid the foundation for the further utilization of these materials in the genetic improvement of wheat.
Keywords Thinopyrum elongatum;Wheat; Alien addition lines; Alien substitution lines; In situ hybridization; Molecular markers
小麦是世界各地广泛种植的禾本科植物,也是世界上重要的粮食作物之一。在我国,小麦作为第三大粮食作物,2016年播种面积达到2 419万公顷[1]。小麦的近缘物种繁多,变异多样,具有丰富的遗传多样性,并且含有在小麦育种中具有重要利用价值的优良基因[2,3]。
长穗偃麦草(Thinopyrum elongatum (Host) A. Lve,2n=2x=14,EE)是应用较广泛的小麦野生近缘种,具有抗病性强、耐盐碱、抗旱、多花多实及蛋白含量高等优异性状,在小麦遗传改良中具有重要作用,是小麦宝贵的三级基因资源库[4,5]。我国很早就将长穗偃麦草应用到普通小麦改良中。Shen等[6]对小麦-长穗偃麦草二体代换系7E(7B)与小麦品系“宁7840”杂交得到的F2群体进行赤霉病抗性鉴定,将抗赤霉病基因Fhb1定位于7E的长臂上。陈士强等[7]对中国春-二倍体长穗偃麦草附加系、代换系及亲本进行赤霉病菌接种,除了证实长穗偃麦草的赤霉病抗性主效基因定位于1E和7E染色体,还发现2E和4E染色体具有微效抗性基因,而3E、5E和6E可能存在易感基因。李玉京等[8]对中国春-长穗偃麦草二体异附加系和二体异代换系进行低磷营养胁迫,结果发现4E与6E染色体上存在耐低磷营养胁迫基因,而5E染色体上则存在抑制低磷胁迫的基因。Forster等[9]认为二倍体长穗偃麦草的2E和5E染色体上具有耐盐的主效基因。通过远缘杂交、染色体工程的方法将长穗偃麦草中抗病、耐盐碱、多花多实等优良基因转入小麦遗传背景是利用外源基因进行小麦遗传改良的有效手段[10]。但在远缘杂交过程中,会人为或自发出现染色体变异,因此及时对外源遗传物质进行准确鉴定,明确其染色体组成,对后续研究尤为重要。
本研究对从CIMMYT、堪萨斯州立大学小麦资源中心等处引进的以中国春为背景的小麦-长穗偃麦草后代种质系,利用原位杂交和分子标记方法,并结合主要农艺性状、芽期耐盐性等对其遺传组成进行鉴定。
1 材料与方法
1.1 供试材料
普通小麦中国春、二倍体长穗偃麦草(Thinopyrum elongatum,2n=2x=14,EE)、小麦-长穗偃麦草双二倍体(2n=8x=56, AABBDDEE),以上材料由山东农业大学小麦染色体工程育种实验室保存。
小麦-长穗偃麦草后代种质系均从CIMMYT、堪萨斯州立大学小麦资源中心引进,均为中国春背景。
1.2 试验方法
1.2.1 农艺性状鉴定 参照李立会的《小麦种质资源描述规范和数据标准》,对抽穗期、开花期、株高、穗型、穗长、小穗数、穗粒数、千粒重等农艺性状进行调查[11]。其中,千粒重数据通过使用万深SC-G自动种子考种分析及千粒重仪扫描500~1 000粒的小麦籽粒获得。
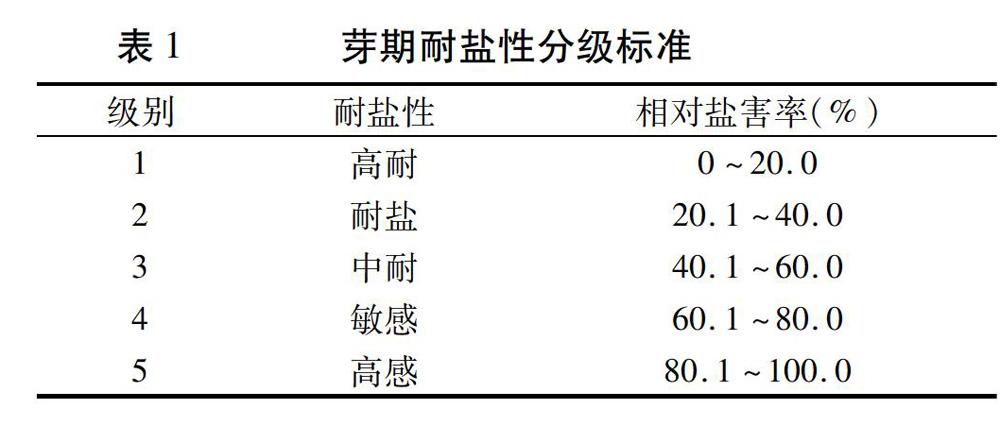
1.2.2 芽期耐盐性鉴定 参照NY/PZT 2001—2002 《小麦耐盐性鉴定评价技术规范》的标准方法[11,12]进行。在培养期间要注意给对照组和处理组及时补充相应的溶液,避免干涸。及时调查、统计处理组和对照组的发芽情况(胚芽鞘生长到种子的1/3,种子根生长到种子的1/2,视为发芽)。根据下列公式计算相对盐害率(RGER),并分级,分级标准见表1。
1.2.3 细胞学观察与原位杂交 参照裴艳茹[13]的方法对根尖细胞(RTC)染色体数目及形态进行观察;参照Kato等[14]的方法进行染色体制备;参照Fu等[15]的方法进行基因组原位杂交(GISH)。用TEXAS RED-5-dCTP标记的二倍体长穗偃麦草基因组DNA为探针,中国春基因组DNA作为封阻。镜检使用Nikon(ECLIPSE Ni-U型)荧光显微镜,用DS-Ril型CCD机(Nikon)进行图案采集。
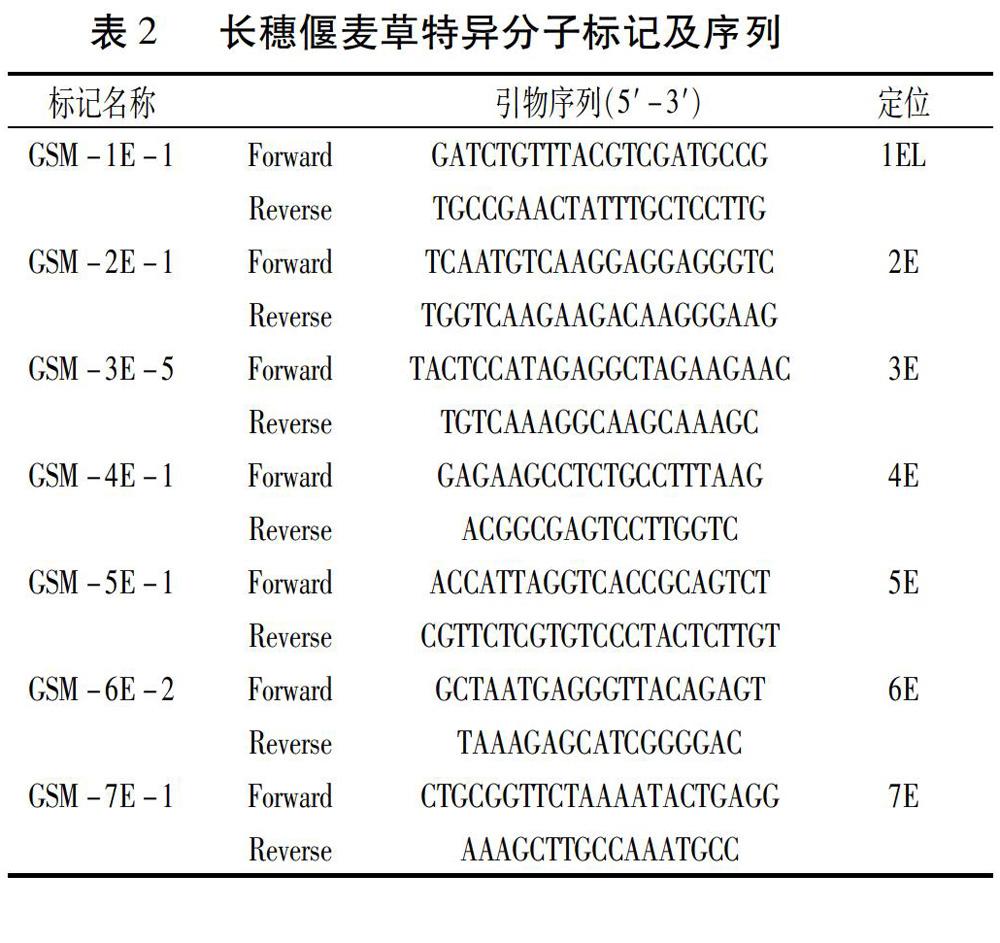
1.2.4 分子标记鉴定分析 从段亚梅[16]筛选得到的长穗偃麦草特异分子标记中选择1E-7E特异标记各一对(见表2)。PCR反应体系为10 μL,含模板DNA(50 ng/μL)1 μL,上下游引物各1 μL,2×Power Taq PCR Master Mix(北京百泰克生物技术有限公司)5 μL,ddH2O 2 μL。用Bio-Rad 公司T100TMThermal Cycler进行PCR扩增,PCR反应条件为:95℃预变性3 min;然后变性30 s,50~60℃退火30 s(Touchdown),72℃延伸90 s,10个循环;然后变性30 s,50℃退火30 s,72℃延伸90 s,25个循环;最后72℃延伸10 min。扩增产物经由8%非变性聚丙烯酰胺凝胶电泳检测,定压105 V电泳3.5 h,使用0.2%的硝酸银溶液银染2 min,去离子水洗涤2次,用3%的NaOH溶液显色,然后用Tanon Gis-2010型凝胶成像系统照相观察记录分析扩增产物的片段大小。
2 结果与分析
2.1 主要农艺性状
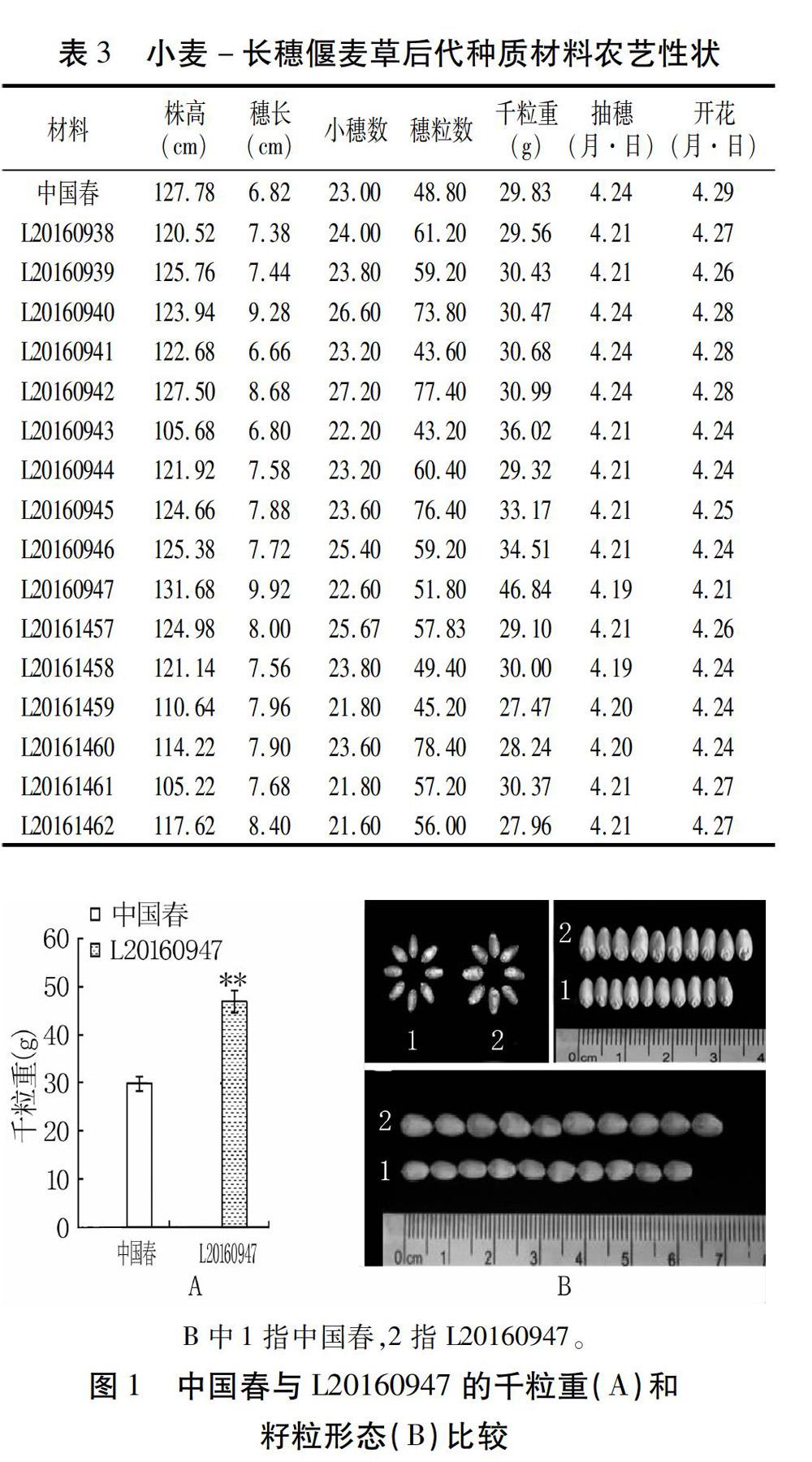
对小麦-长穗偃麦草种质材料进行基本的田间性状调查,结果(表3)表明,在株高方面,除L20160947株高为131.68 cm,略高于中国春(127.78 cm)外,其他材料株高在105.22~127.50 cm之间,均低于中国春。在穗长方面,除L20160941的6.66 cm和L20160943的6.80 cm,其余材料的穗均比中国春(6.82 cm)长,长度在7.38~9.92 cm之間。除L20160943、L20160947、L20161459、L20161461、L20161462的小穗数少于中国春外,其余材料小穗数分布于23.20~27.20个,均多于中国春。穗粒数高于中国春的有13份,在49.40~78.40之间;低于中国春的有3份,穗粒数分布在43.20~45.20。千粒重高于中国春(29.83 g)的有10份,在30.00~46.84 g;低于中国春的有6份,在27.47~29.56 g。但是L20160947的千粒重相对于中国春有较大的变化,增幅高达57.02%,达到极显著水平(图1A),而且其粒长和粒宽均优于中国春(图1B),抽穗期和开花期均早于中国春。
2.2 芽期耐盐性鉴定
用350 nmol/mL NaCl(2.0%)溶液对小麦-长穗偃麦草种质材料芽期耐盐性进行初步鉴定,结果(表4)显示,耐盐材料7份,占供试材料的43.75%;中耐材料5份,占供试材料的31.25%;敏感材料4份,占供试材料的25.00%;无高耐和高感材料。
对7份耐盐材料用2.2% NaCl溶液进一步筛选,仅得到1份耐盐性高于中国春的材料,表现为敏感型,占供试材料的14.29%;其余6份材料与中国春同属于高感材料,占供试材料的85.71%(表5)。
2.3 细胞学分析与原位杂交
为明确种质材料的遗传组成,首先对16份小麦-长穗偃麦草后代种质材料种子根尖有丝分裂中期细胞进行细胞学观察、统计,然后进行基因组原位杂交(GISH)。L20161461、L20161462的染色体条数为44条,且有2条外源染色体;L20160940、L20160942、L20161457、L20161459四份材料的染色体条数均为42条,且有2条外源染色体(图2)。
2.4 分子标记
经细胞学和原位杂交分析确定小麦-长穗偃麦草后代种质系材料中有4份异代换系和2份异附加系。为进一步确认外源染色体所属的同源群,用长穗偃麦草特异分子标记,对这6份材料进行鉴定,PCR扩增产物电泳图如图3所示。CSM-1E-1标记在L20161457中能扩增出目的条带,证明L20161457为1E/1D的异代换系;CSM-3E-5标记在L20161459中能扩增出目的条带,证明L20161459为3E/3B的异代换系;CSM-4E-1标记在L20160940和L20160942中能扩增出目的条带,证明L20160940和L20160942为4E/4D的异代换系;CSM-6E-2标记在L20161461中能扩增出目的条带,证明L20161461附加一对6E染色体;CSM-7E-1标记在L20161462中能扩增出目的条带,证明L20161462附加一对7E染色体。
3 讨论与结论
通过远缘杂交的方法将外源遗传物质转入到小麦遗传背景后,除了从外部性状的变化来判断外源遗传物质进入小麦外,还要及时了解外源遗传物质进入的多少、有利遗传物质的存在情况,对外源遗传物质(目的基因或染色体片段)进行跟踪鉴定,提高育种效率。目前,检测小麦外源遗传物质的方法主要有形态学、原位杂交和分子生物学方法等[17]。
本研究综合利用原位杂交与分子标记技术对16份小麦-长穗偃麦草种质系的染色体遗传组成进行鉴定,准确鉴定出2份异附加系和4份异代换系。其中L20161461、L20161462两份材料是二体附加系,分别附加6E和7E染色体,与引进时附加的外源染色体相一致;L20160940、L20160942、L20161457、L20161459为二体代换系,分别是DS4E(4D)、DS4E(4D)、DS1E(1D)、DS3E(3B)。L20160940的原引进外源染色体是3E,而经鉴定是4E代换系,鉴定结果与来源染色体不匹配,可能是在繁育过程中种子混收导致;另3份材料的外源染色体与引进时一致,其它材料没有检测到外源染色体或染色体片段的存在。
在小麦近缘物种耐盐性鉴定方面,Omielan等[18]认为长穗偃麦草3E染色体携有耐盐相关基因,而本研究中L20160941(来源3E)的耐盐性高于中国春,可能携有耐盐相关基因,与其研究结果一致。但二体代换系L20161459(3E/3B)耐盐性却低于中国春,可能有两个原因,一是3E染色体上携带的耐盐基因的功能是通过降低叶片钠离子含量增强小麦苗期或成株期的耐盐性[18,19];二是L20161459是二体代换系,虽然携有耐盐基因,但3E染色体上携有的其它基因影响了耐盐基因的表达。本研究综合利用原位杂交与分子标记技术鉴定此套种质材料,不仅明确了其染色体组成,也为充分利用长穗偃麦草优异基因进一步创制小麦新种质材料奠定基础。
参 考 文 献:
[1] 何中虎, 庄巧生, 程顺和, 等. 中国小麦产业发展与科技进步[J]. 农学学报, 2018, 8(1): 99-106.
[2] 董玉琛, 郑殿升. 中国小麦遗传资源[M]. 北京: 中国农业出版社, 2000.
[3] 王林生, 陈佩度. 普通小麦外源染色体易位系的诱导及其在育种上的应用[J]. 生物学通报, 2007, 42(2): 9-11.
[4] Dvorˇák J, Edge M, Ross K. On the evolution of the adaptation of Lophopyrum elongatum to growth in saline environments [J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(11): 3805-3809.
[5] Zhong G Y, Dvorˇák J. Chromosomal control of the tolerance of gradually and suddenly imposed salt stress in the Lophopyrum elongatum and wheat, Triticum aestivum L. genomes [J]. Theoretical and Applied Genetics, 1995, 90(2): 229-236.
[6] Shen X R, Ohm H. Fusarium head blight resistance derived form Lophopyrum elongatum chromosome 7E and its augmentation with Fhb1 in wheat [J]. Plant Breeding, 2006, 125(5): 424-429.
[7] 陳士强, 秦树文, 黄泽峰, 等. 基于SLAF-seq技术开发长穗偃麦草染色体特异分子标记[J]. 作物学报, 2013, 39(4): 727-734.
[8] 李玉京, 刘建中, 李滨, 等. 长穗偃麦草基因组中与耐低磷营养胁迫有关的基因的染色体定位[J]. 遗传学报, 1999,26(6): 703-710.
[9] Forster B P, Miller T E, Law C N. Salt tolerance of two wheat-Agropyron junceum disomic addition lines[J]. Genome, 1988, 30(4): 559-564.
[10]Jiang J, Friebe B, Gill B S. Recent advances in alien gene transfer in wheat[J]. Euphytica, 1994, 73: 199-212.
[11]李立会, 李秀全. 小麦种质资源描述规范和数据标准[M]. 北京:中国农业出版社, 2005.
[12]王萌萌, 姜奇彦, 胡正, 等. 小麦品种资源耐盐性鉴定[J]. 植物遗传资源学报, 2012, 13(2): 189-194.
[13]裴艳茹. 小麦—长穗偃麦草后代种质系的鉴定及遗传分析[D]. 泰安: 山东农业大学, 2018.
[14]Kato A, Lamb J C, Birchler J A. Chromosome painting using repetitive DNA sequences as probes for somatic chromosome identification in maize [J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(37): 13554-13559.
[15]Fu S L, Lv Z L, Qi B, et al.Molecular cytogenetic characterization of wheat-Thinopyrum elongatum addition, substitution and translocation lines with a novel source of resistance to wheat fusarium head blight[J]. Journal of Genetics and Genomics, 2012, 39(2): 103-110.
[16]段亚梅. 硬粒小麦-长穗偃麦草附加系、代换系和易位系的创建[D]. 扬州: 扬州大学,2018.
[17]张超. 长穗偃麦草E组染色体特异PCR标记开发[D]. 扬州: 扬州大学, 2009.
[18]Omielan J, Epstein E, Dvorˇák J. Salt tolerance and ionic relations of wheat as affected by individual chromosomes of salt-tolerant Lophopyrum elongatum [J]. Genome, 1991, 34(6): 961-974.
[19]韩冉, 宫文萍, 宋健民, 等. 小麦-近缘物种染色体系耐盐性鉴定及分子标记筛选[J]. 麦类作物学报, 2017, 37(3): 301-306.

