ECT2-siRNA转染对肺腺癌A549细胞周期分布和凋亡的影响
吴 昊,林 庆,徐 全,柳阳春,陈立如,尹 随
江西省人民医院心胸外科 南昌 330000
肺癌是一种常见的呼吸系统恶性肿瘤,是所有恶性肿瘤里发病率最高,造成癌症死亡最多的疾病[1];非小细胞肺癌是肺癌常见的病理类型,约占80%[2],其中又以肺腺癌最常见。我国是肺癌的高发区,然而,目前传统的手术治疗、放疗和化疗治疗肺癌的效果并不理想[3]。近年来,随着医学技术的不断发展,基因治疗已成为肺癌研究中的热门课题。探讨肺癌发生发展的分子机制,寻找有效的治疗靶点对治疗肺癌具有重要意义。
上皮细胞转化序列2(epithelial cell transforming sequence 2 oncogene,ECT2)最早在小鼠NIH/3T3细胞中发现,可通过调控Rho GTP酶介导上游小G蛋白家族成员的表达,调控细胞周期[4]。人类ECT2基因定位于人3q26染色体上,可编码883个氨基酸。有报道[5-8]证实,ECT2是一种与细胞增殖和凋亡有关的癌基因,在结直肠癌、胶质瘤和胃癌等多种肿瘤组织中异常高表达,与肿瘤的发生发展关系密切。本研究探讨沉默ECT2表达对肺腺癌A549细胞周期分布和凋亡的影响,以期进一步阐明ECT2在肺腺癌发生发展中的作用。
1 材料与方法
1.1细胞与试剂A549细胞(上海生命科学研究院细胞资源中心),RPMI 1640培养基、胎牛血清(美国Gibco公司),青霉素、链霉素和Lipofectamine 2000(美国Invitrogen公司),兔多克隆抗体P53、鼠单克隆抗体CyclinD1和鼠多克隆抗体β-actin(美国Santa Cruz公司),兔抗ECT2多克隆抗体、兔抗Cleaved Caspase-3多克隆抗体、HRP标记的山羊抗兔IgG(美国Abcam公司),凋亡检测试剂盒(美国BD公司),细胞周期检测试剂盒(南京凯基公司),BCA试剂盒(北京康为世纪生物公司)。ECT2-siRNA及其阴性对照序列NC-siRNA由上海吉玛制药技术公司设计合成。
1.2细胞培养冻存A549细胞经水浴解冻复苏后,用含体积分数10%胎牛血清和青-链霉素双抗的RPMI 1640培养基于37 ℃、体积分数5%CO2的细胞培养箱内培养。显微镜下监控细胞生长情况。当细胞生长至75%融合时,加入2.5 g/L胰蛋白酶消化传代。选取处于对数生长期的细胞用于实验。
1.3实验分组与处理将A549细胞分为空白组、阴性对照组(转染阴性对照NC-siRNA)、干扰组(转染ECT2-siRNA)。转染前24 h,将A549细胞以每孔3×104个接种于6孔板,置于细胞培养箱内常规培养。当细胞生长至70%融合时,参照转染试剂说明书根据实验分组进行转染,其中siRNA终浓度为20 μmol/L。细胞转染48 h后,收集各组细胞进行后续实验。
1.4ECT2-siRNA干扰的效果采用Western blot检测ECT2蛋白的表达。A549细胞中加入细胞裂解液提取总蛋白,BCA法定量总蛋白后,以每孔60 μg的上样量行SDS-PAGE凝胶电泳,电转至PVDF膜上。采用含50 g/L脱脂奶粉的封闭液封闭1.5 h后,加入ECT2(按1∶500稀释)和β-actin(按1∶1 000稀释)抗体,4 ℃下孵育过夜。封闭液洗膜后,加入1∶2 000稀释的HRP标记的二抗,37 ℃下孵育1 h。经化学发光剂显色后,用凝胶图像处理软件分析条带的灰度值。目的蛋白的相对表达量=目的条带灰度值/内参条带灰度值。实验重复3次。
1.5细胞周期的检测收集转染48 h的各组细胞,经预冷磷酸缓冲液重悬细胞后,以预冷的体积分数70%的乙醇固定30 min。加入染色液(含RNase和PI)染色20 min后,上流式细胞仪检测。实验重复3次。
1.6细胞凋亡的检测收集转染48 h的各组细胞,以预冷磷酸缓冲液洗涤3次后,加入200 μL结合缓冲液重悬细胞,再加体积各为5 μL的Annexin V-FITC和PI避光处理15 min,补加结合缓冲液300 μL,上流式细胞仪检测细胞凋亡。实验重复3次。
1.7细胞周期和凋亡相关蛋白表达的检测采用Western blot检测细胞周期蛋白CyclinD1,凋亡相关蛋白P53和Cleaved Caspase-3(一抗分别按1∶500、1∶500和1∶1 000稀释)的表达,具体步骤参照1.4。
1.8统计学处理采用SPSS 22.0处理数据,3组间以上指标的比较采用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1ECT2-siRNA干扰效果结果见图1。空白组、阴性对照组和干扰组细胞中ECT2蛋白的表达水平分别为(0.72±0.05)、(0.75±0.06)和(0.13±0.02),3组间相比,差异有统计学意义(F=169.246,P<0.001);与空白组和阴性对照组相比,干扰组ECT2蛋白的表达水平降低(P<0.05)。
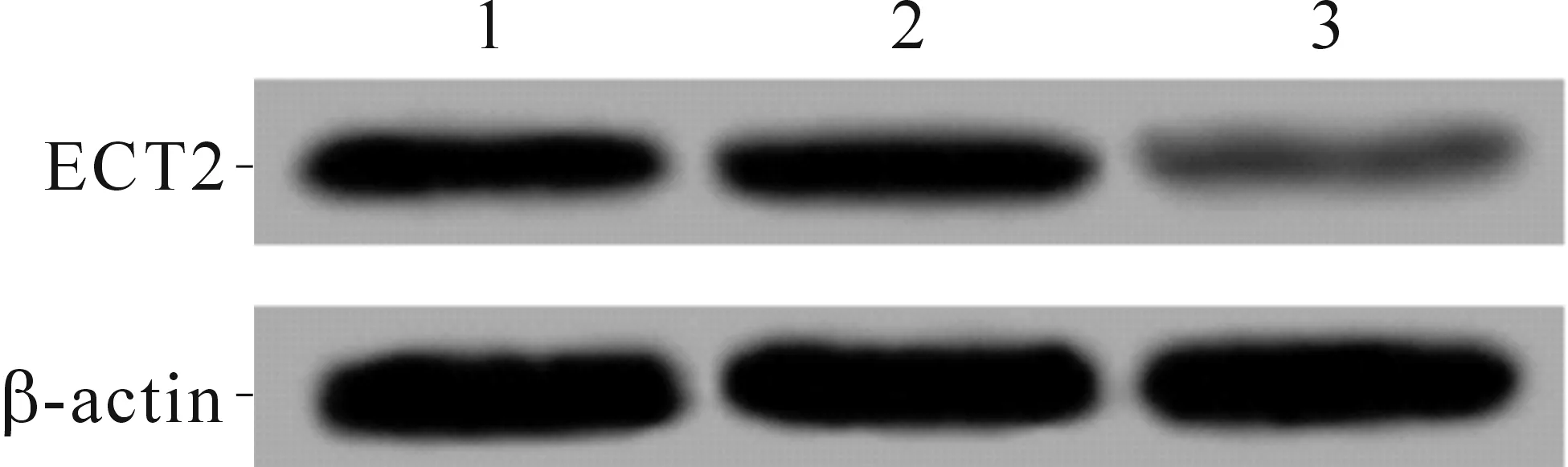
1~3组:分别为空白组、阴性对照组和干扰组
2.23组细胞周期分布比较与空白组和阴性对照组相比,干扰组G0/G1期细胞百分比升高,S期和G2/M期细胞百分比降低(P<0.05);而阴性对照组与空白组G0/G1期、S期和G2/M期细胞百分比差异无统计学意义(P>0.05)。结果见表1。
2.33组细胞凋亡率比较与空白组和阴性对照组相比,干扰组细胞的凋亡率升高。见表1。
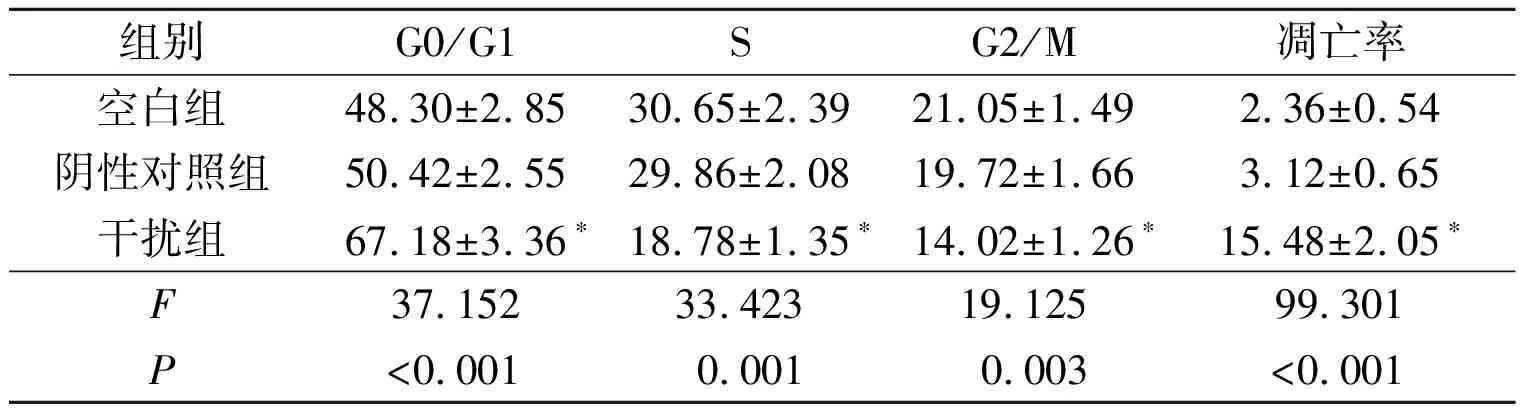
表1 3组细胞周期分布和细胞凋亡率比较(n=3) %
*:与其他2组相比,P<0.05
2.43组细胞CyclinD1、P53和Cleaved Caspase-3蛋白表达水平的比较与空白组和阴性对照组相比,干扰组P53和Cleaved Caspase-3蛋白的表达水平升高,而CyclinD1蛋白的表达水平降低(P<0.05)。见图2、表2。

1~3组:分别为空白组、阴性对照组和干扰组
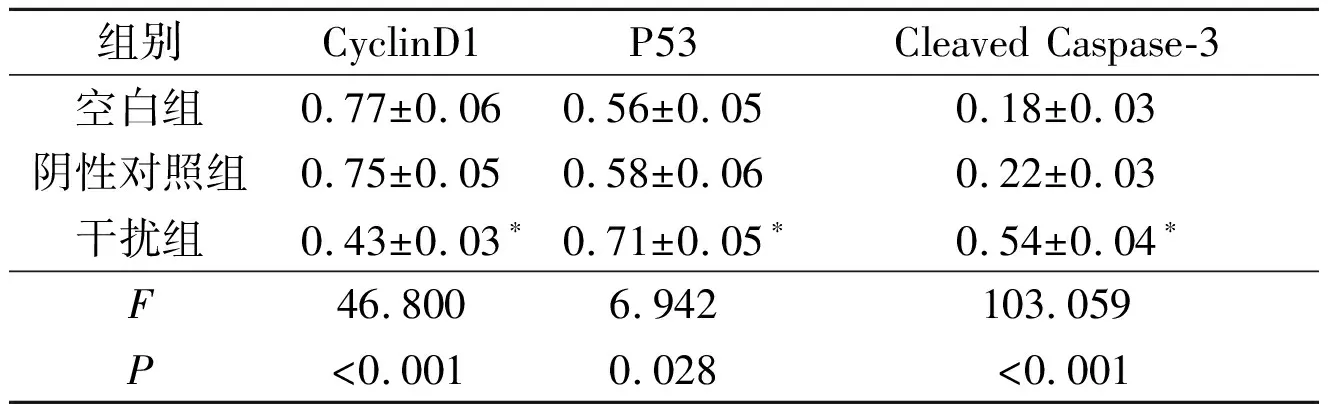
表2 3组细胞CyclinD1、P53和Cleaved Caspase-3蛋白的表达水平(n=3)
*:与其他2组相比,P<0.05
3 讨论
研究[9-11]表明,ECT2是一种与肺癌、乳腺癌和前列腺癌等多种恶性肿瘤发生发展密切相关的癌基因,其在肿瘤组织中表达水平越高,患者的预后越差。Iyoda等[12]研究指出,ECT2在口腔鳞状细胞癌组织和细胞中表达上调,下调其表达后可通过上调p21、p27和下调CyclinD1、CyclinE、CDK4导致细胞周期阻滞于G1期,进而抑制细胞增殖。Xu等[13]研究发现ECT2可被miRNA-223靶向调控,下调其表达可诱导p21表达,改变Cyclin D1-CDK复合物的活性,将细胞阻滞于G1期,影响骨肉瘤细胞周期进展。Xie等[14]进一步发现下调ECT2能有效抑制骨肉瘤OS细胞增殖,诱导细胞凋亡,并通过下调MMP-2和MMP-9表达抑制OS细胞侵袭和迁移。另外,沉默乳腺癌细胞中ECT2表达后可通过ERK/miR-101/Rac1信号转导通路抑制肿瘤细胞增殖并诱导细胞凋亡[15]。可见,ECT2可通过多种机制参与细胞的增殖、侵袭、迁移和凋亡等过程,在肿瘤发生发展过程中发挥重要的调控作用。
细胞周期是一个高度有序的运转过程,其调控紊乱是肿瘤细胞失控性增殖进而导致肿瘤发生的重要原因[16]。除了细胞异常增殖外,肿瘤细胞发生凋亡的倾向和能力降低也是肿瘤发生发展的重要机制,诱导细胞凋亡正逐渐成为一种发展中的肿瘤治疗手段[17]。本研究结果显示,ECT2-siRNA可沉默肺腺癌A549细胞中ECT2的表达;ECT2沉默后A549细胞被阻滞于G0/G1期,细胞凋亡率升高;进一步检测发现,CyclinD1蛋白的表达水平降低,而P53和Cleaved Caspase-3蛋白的表达水平升高。CyclinD1是细胞周期蛋白依赖性激酶的重要调控者,在细胞由G1期进入到S期中发挥推动作用;此外,CyclinD1也是公认的原癌基因,其过度表达可致细胞增殖失控[18]。P53是一种重要的细胞转录调节因子,也是一种重要的抑癌基因,其表达增多可使细胞周期停滞于G1期并介导细胞凋亡[19-20]。Caspase-3处于凋亡级联反应的下游,是细胞凋亡过程中的主要效应因子,其活化是细胞凋亡进入不可逆阶段的重要标志[21],其中Cleaved Caspase-3是其重要的活化形式。本研究结果提示,沉默ECT2可通过下调CyclinD1和上调P53、Cleaved Caspase-3的表达诱导A549细胞周期阻滞和凋亡。
综上所述,靶向沉默ECT2表达可诱导肺腺癌A549细胞周期阻滞和凋亡,而CyclinD1蛋白表达下调和P53、Cleaved Caspase-3蛋白表达上调可能是ECT2抑制肺腺癌发生发展的重要机制。该结果进一步阐明了ECT2在肺癌发生发展中的作用,ECT2有望成为肺癌治疗的新靶点。

