石豆兰无菌材料的建立及离体培养初探
黄崇成, 苗永美, 方 达, 王宇豪, 童 元
(安徽科技学院 生命与健康科学学院,安徽 凤阳 233100)
石豆兰属(Bublophyllum) 植物全世界约有1 000种,主要分布于亚洲、非洲和美洲热带地区。我国有98种3变种,主要产于长江流域及其以南各省区,尤以云南南部为多。该属植物具根状茎和假鳞茎,假鳞茎密生或疏生于根状茎上,卵圆至圆筒状,叶生于假鳞茎顶端。有些种的株型优美,花色幽雅、果实玲珑可爱,具有一定的观赏价值;有些具药用价值,常作民间用药的有15种,全草或假鳞茎皆可入药[1],具清热、滋阴、消肿、抗癌、抗焦虑等功效[2,3]。兰科植物价值高,野生资源受到保护,怎样通过组织培养加快繁殖力度为人工栽培提供大量组培苗,或者通过细胞培养提取药用成分都是很重要的研究课题[3]。
植物生活在自然界中其表面会带有各样微生物,甚至其组织内也生有大量菌,尤其兰科植物特殊生境、生长缓慢、具药用功能等特点都会使得植物内外菌物较为丰富,这给无菌材料建立带来巨大困难。在开展石豆兰离体繁殖体系建立时发现石豆兰横走茎、假鳞茎表面菌较多,内生菌也极为丰富[4]。因此,本试验开展内外菌物消毒处理方法研究及探索激素浓度,建立起离体繁殖体系并获取大量无菌材料,为下一步原球茎诱导、增殖、悬浮培养、诱变等研究奠定基础。
1 材料与方法
1.1 材料
所用石豆兰(Bulbophyllumsp.)材料采自福建南屏鸳鸯猕猴自然保护区。制霉菌素和萘啶酮酸用乙醚灭菌处理,纱布封口,挥干后,加入无菌水配成50 mg/mL的悬液。
1.2 方法
1.2.1 外植体外生菌的处理 取横走茎最前端新生出的小嫩芽和假鳞茎两种外植体,清水冲洗表面,加入0.1% HgCl2后分成两组,一组做超声(40 kHz,下同)处理,另一组不做超声处理,处理5、10、15、20 min,共8个处理,无菌水漂洗5次,吸干。芽切除少许基部,假鳞茎约切成0.5 cm3的小块,接种到M1:MS+6-BA 0.25 mg/L+NAA 0.05 mg/L的培养基上,每处理接种10瓶,每瓶3个芽和3个切块。7 d统计污染和成活情况,污染率=污染外植体数/总外植体数×100%,成活率=成活外植体数/总外植体数×100%。
1.2.2 外植体内生菌的处理 1.2.1试验结果表明假鳞茎在M1培养基上死亡率高,难以再分化出器官。因此,后面试验只选用小嫩芽做培养材料,表面消毒处理后接种于添加制菌霉素和萘啶酮酸的M1培养基中,添加浓度见表2。每处理10瓶,每瓶6个材料,每个月转接1次,培养90 d后计算污染率和成活率。
1.2.3 不同激素配比对外植体的生长的影响 取未污染的小嫩芽接种于M1培养基上,此时逐渐降低培养基中抗菌素浓度,经过长时间多次继代后,基部逐渐长出粗壮的根,嫩芽生长,基部变粗形成椭圆形即假鳞茎,上面着生二叶,根茎处分化出小芽。为了探讨激素配比对芽分化的影响,根据前期实验,选用6-BA和NAA两种激素,采用正交设计,具体表3。将单鳞芽带根切下选取大小差不多一致的带根鳞芽作为接种单元,每处理5瓶,每瓶4个鳞茎,60 d后统计新长出的芽,按培养后芽数/接种时芽数计算增殖倍数。
以上培养基中需添加0.5 g/L 活性炭、100 g/L土豆汁、3 0 g/L蔗糖、6 g/L琼脂粉,pH=6.5。光照时间为12 h/d,光照强度为40 μmol /(m2·s),温度25±2 ℃。
2 结果与分析
2.1 不同消毒方式的消毒效果比较
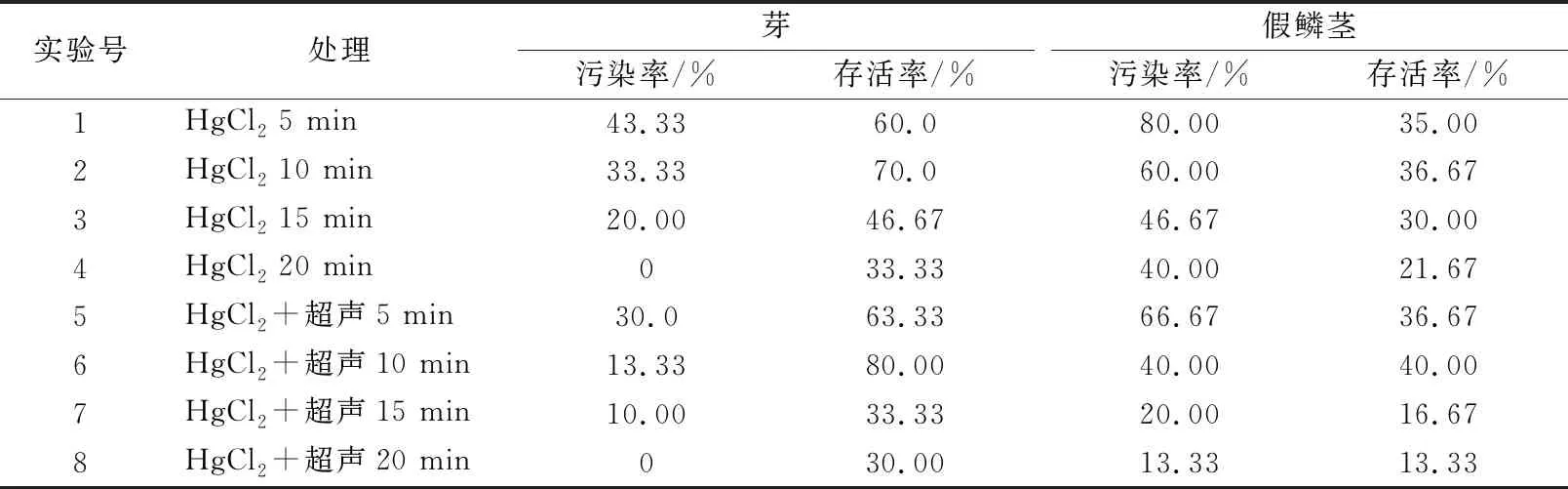
表1 不同处理方式对外植体的杀菌效果
由表1可知,假鳞茎的污染率高,说明假鳞茎内外菌较多,而成活率比芽低,大部分逐渐发黄发白死亡,未死亡的只是维持绿色未见分化说明假鳞茎分化要求较高。单独使用HgCl2消毒时,2种外植体的污染率都随处理时间的延长逐渐降低,而成活率先升高后降低,有一些材料虽未出现污染,但长时间的HgCl2处理会对2种外植体造成伤害从而导致成活率下降;当然也有些材料出现轻微的污染但仍然存活。根据污染率和成活率综合来看,在单独使用HgCl2时,处理时间10 min效果最好。
HgCl2结合超声处理比单独使用HgCl2会降低污染率,芽污染率降低幅度在10%~20%之间,假鳞茎污染率降低幅度在13.33%~26.67%之间;只有超声5~10 min处理能提高2种外植体的成活率,长时间超声会降低成活率,可能因长时间超声处理会对植物造成伤害。由此看出,HgCl2结合超声处理能降低污染率,提高成活率,处理10 min时效果最好,芽和假鳞茎的污染率都降低了20%,成活率分别提高了10%和3.33%。
2.2 不同抗生素组合对石豆兰内生菌的抑制效果比较

表2 不同抗生素组合对内生菌的抑制效果比较
药用植物往往含内生菌,采取HgCl2结合超声处理对表面菌起到较好的杀伤作用,而对内部菌杀伤力较弱,本研究发现随着长时间继代培养,材料切口处逐步长出多种菌物,生长缓慢,符合内生菌的生长特征,建立无菌材料时针对内生菌采取的做法是加入抗生素。由表2可知,仅采取HgCl2结合超声处理在短时间内呈现较低的污染率,90 d后内生菌逐渐长出,污染率达83.33%;当培养基中加入制菌霉素和萘啶酮酸后,污染率降低。根据污染率和成活率两个指标综合考虑,确定最佳抗菌素组合为7号处理即制菌霉素75 mg/L和萘啶酮酸50 mg/L抑制效果最好,90 d时污染率为20.00%,无菌材料成活率为60%,芽出现了萌发和明显的生长。
2.3 不同激素浓度和配比对鳞芽增殖的影响
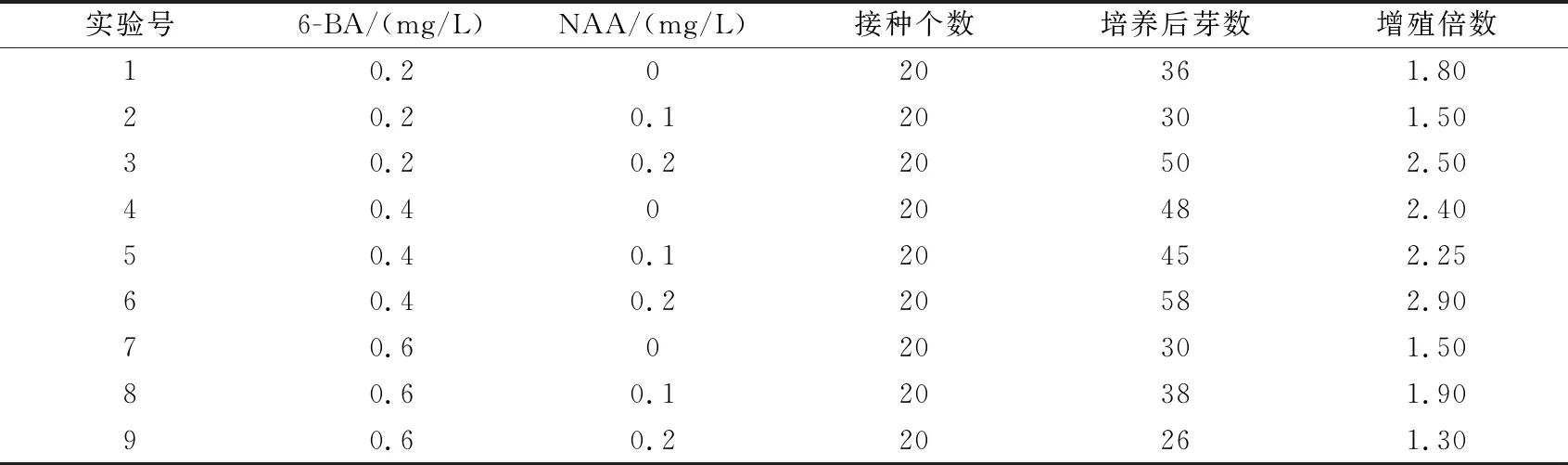
表3 不同激素浓度和配比对鳞芽增殖的影响

表4 增殖培养中因素多重比较
注:同列数值间不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著。

图1 石豆兰增殖
从图1看出,芽主要从鳞芽基部长出并逐步生长,有些从鳞芽顶部分化出,分化情况受激素调控。多重比较结果(表4)说明6-BA和NAA对于石豆兰鳞芽的增殖影响显著,增殖倍数随着6-BA浓度升高先增大后降低,2水平即0.4 mg/L时最大,显著高于其它两个水平;随NAA浓度的增加,增殖倍数逐渐增大,3水平即0.2 mg/L时最大并显著高于1和2水平,但是1和2水平之间差异不显著。根据多重比较得出石豆兰离体繁殖的最佳的激素配比为6-BA 0.40 mg/L和NAA 0.2 mg/L,此激素配比即6号培养基上鳞芽经过60 d的增殖培养,增殖了2.90倍。
3 结论与讨论
本研究所用的石豆兰属植物其外植体消毒非常困难,因为在自然条件下外植体外部和内部都带有较多的细菌,霉菌,尤其是兰科植物,常年生活在空气湿度大的环境中,加上生长周期较长的特点,外植体内外菌物非常丰富,给离体培养建立无菌材料时带来巨大困难。
建立无菌起始材料时主要考虑的因素有外植体类型和消毒方法。选取外植体时要考虑材料来源、细胞全能性和消毒难易程度等,通过前期预实验[4],表明兰科植物叶片再生能力非常弱,培养中逐渐黄化死亡;横走茎已木质化,细胞全能性较低,也不适合选用[5-7]。本研究选取嫩芽和假鳞茎为外植体,发现假鳞茎内生菌多,尤其是生长周期更长的假鳞茎其内生菌更为丰富,经过切割后内生菌容易长出;此外鳞茎切块易黄化,仅少数维持绿色但没有分化,只有接入新形成的小球茎在未污染的情况下出现了生长。基于上述原因,通过假鳞茎难以建立无菌材料,本研究采用横走茎前端新长出的嫩芽为外植体建立无菌材料。
植物外植体常采用化学方法消毒,主要考虑消毒剂的种类、浓度、时间,三个因素具有很强的相关性,使用力度越大,杀菌越彻底;若把握不好力度,外植体也会受到药剂伤害死亡。怎样在保证杀死菌物的同时不能对外植体造成伤害,保证较高的成活率,是建立无菌材料时考虑的重要因素。化学药剂常采用的是HgCl2和NaClO。NaClO因具漂白作用,不适合绿体材料;HgCl2因效果好常被选用[8]。有研究报道超声波辅助化学法能降低组培苗的污染率、提高成活率,大大降低HgCl2浓度和处理时间[9]。本研究表明HgCl2结合超声比单独使用HgCl2效果好,获得较低的污染率和最高的成活率。内生菌丰富的外植体仅采用一般的化学、物理表面消毒法难以杀死内部微生物,一般采取消毒液中[10]或培养基中添加杀菌剂来抑制内生菌[11],用到的杀菌剂有多菌灵、链霉素、庆大霉素、头孢噻肟、青霉素等[12]。基于每种抗生物的杀菌谱限制,常采用多种抗生物联合使用,还需考虑使用浓度和时间。前期预实验发现石豆兰内部含细菌和真菌,因此选用制菌霉素和萘啶酮酸两种,经过浓度筛选确定75 mg/L制菌霉素和50 mg/L萘啶酮酸组合最好,90 d时统计污染率仅为20%,成活率为60%。
激素是植物器官分化的重要调控因子。本研究选用了6-BA和NAA 2种激素,两种激素配比下,石豆兰鳞茎切块难以分化出原球茎或芽。本研究以带根的整个假鳞茎为培养单元,芽主要从鳞茎的根基部分化出,也有少量芽从叶片中间或鳞茎表面分化出来。芽的分化会显著受激素调控影响,6-BA 0.40 mg/L 和NAA 0.2 mg/L配比下,芽的增殖效果最好,为2.90倍。研究中发现石豆兰植物分化容易,但生长缓慢,增殖周期较长,与近缘属植物石斛的增殖类似[13-14]。关于石豆兰属植物的组织培养报道非常少,不同种植物所需的激素不同,李洪林等[6]在进行广东石豆兰组培时,增殖培养所用激素配比6-BA 2.5 mg/L和NAA 0.05 mg/L,增殖系数达4~5倍。
综上所述,0.1%HgCl2结合超声处理10 min较有效地杀死石豆兰外植体表面微生物,培养基中添加75 mg/L制菌霉素和50 mg/L萘啶酮酸能有效抑制石豆兰内生菌,建立了以鳞芽为起始材料的无菌材料。鳞芽在6-BA 0.40 mg/L和NAA 0.2 mg/L激素配比条件下增殖效果最好。

