应用gpt delta转基因小鼠模型评价电子烟气溶胶的遗传毒性
管 莹 ,许 亮 ,尤馨悦 ,高 茜 ,唐伟锋 ,4,米其利 ,曹易懿 ,朱洲海 ,奚 晶 ,刘维映,栾 洋,夭建华*
1.云南中烟工业有限责任公司技术中心 云南省烟草化学重点实验室,昆明市北市区红锦路181号 650231
2.上海交通大学医学院虹桥国际医学研究院/公共卫生学院,上海市黄浦区重庆南路280号 200025
3.上海艾博思生物科技有限公司,上海市浦东新区紫薇路750弄12号 201203
4.上海大学环境与化学工程学院环境污染与健康研究所,上海市宝山区上大路99号 200444
电子烟又称电子烟碱递送系统,是目前国际市场上具有代表性的新型烟草制品之一。近年来,电子烟作为一种“戒烟产品”或“吸烟替代品”在国外市场的销量快速增加[1]。电子烟气溶胶的毒理学特性已成为新型烟草制品相关研究的热点之一。有研究表明,电子烟气溶胶的毒性显著低于传统卷烟烟气[2-5],但是有关电子烟安全性、有效性的评估尚没有足够的临床研究数据。2013年7月9日,世界卫生组织发表的声明中称“电子烟碱递送系统的安全性尚未得到科学论证,其对使用者健康带来的可能风险还没有定论”[6]。鉴于目前关于电子烟的临床前毒理学评价研究较少,因此建立电子烟的体外、体内毒理学测试方法,并进行相关的健康风险评估研究就显得迫切。
与遗传毒性的体外评价方法相比,体内实验方法的假阳性发生率较低,因此其应用日益受到重视。gtp delta 转基因小鼠模型是Nohmi 等于1996年建立的一种利用6-巯基鸟嘌呤进行阳性筛选的新型的体内基因突变检测模型[7]。与Muta 和 Big Blue 小鼠 相比 ,gtp delta 转 基 因 小 鼠模型有如下优点:实验操作简单,突变容易鉴定;gpt 基因的长度为456 bp,有利于进行DNA 序列和突变机制分析;自发突变率低,可以检测点突变、移码突变、碱基置换等碱基突变,也可以检测大范围(1~10 kb)的缺失。本课题组应用gpt delta转基因小鼠进行了大量的环境化合物的遗传毒性评价和机制研究[8-9]。在本研究中,利用gpt delta转基因小鼠模型,通过检测靶器官基因突变频率和特征、外周血微核试验、Pig-a 基因突变试验和实时荧光定量PCR 分子生物学方法对电子烟进行毒理学评价,旨在建立电子烟安全性评价的动物模型评价方法,为电子烟的研发提供安全性技术支撑。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 受试物
电子烟(18 mg 烟碱,市售);肯塔基3R4F 参比卷烟(烟碱量0.73 mg/支,美国肯塔基大学)。
1.1.2 实验动物及分组
gpt delta 转基因雄性小鼠,由上海交通大学医学院实验动物科学部提供。采用SM450 型20 孔道直线型吸烟机(英国Cerulean 公司)产生烟气,烟气直接接入烟气吸入染毒仪(天津合普公司)进行小鼠全身暴露,暴露的实验环境条件符合GB 14925—2010[10]中对动物实验设施的有关要求,温度为(22±2)℃,含氧量在19%~22%范围内。3R4F参比卷烟采用ISO 抽吸模式抽吸,电子烟采用加拿大深度抽吸(HCI)模式抽吸。
动物分组如下:空白对照组、溶媒对照组、3R4F 参比卷烟高剂量组、3R4F 参比卷烟低剂量组、电子烟组高剂量组和电子烟组低剂量组,各组对应的小鼠数量分别为 4、4、6、6、6、6 只。其中,3R4F 参比卷烟低、高剂量暴露组分别为2 和6 支/d;电子烟(烟碱量约30 μg/口)低、高剂量暴露组分别为50 和150 口/d。溶媒对照组为丙二醇和丙三醇的混合液,抽吸电子烟口数与电子烟高剂量抽吸口数一致。每天暴露1 次,每周暴露5 d,连续暴露4 周。其中,3R4F 参比卷烟组和电子烟组的低、高剂量组分别为暴露40 和80 min/d。
1.1.3 试剂和仪器
FITC-anti-mouse CD24 抗体 、APC anti-mouse TER-119 抗体、PE Rat anti-mouse CD71、BD Accuri C6 流式细胞仪(美国 BD 公司);miR qRT-PCR Quantitation Kit(上海艾博思生物公司);RecoverEase(tm) DNA Isolation Kit、MX3000P 荧光定量PCR仪(美国 Stratagene公司);GentraR PuregeneR Blood Kit(美国 Qiagen 司);DNA 引物[生工生物工程(上海)股份有限公司]。
1.2 方法
1.2.1 外周血网织红细胞微核试验
采用本实验室建立的吖啶橙染色法[11](Acridine Orange,AO)进行试验。
血液标本制作:采集血液时,轻拭除去AO 涂层载玻片表面的灰尘,取5 mL 外周血滴在预制好的载玻片中央,立即盖上盖玻片,室温下静置2~3 h后计数。细胞染色后使用荧光显微镜在40 倍物镜下观察有网状结构的网织红细胞,至少计数2 000个网织红细胞,以判断网织红细胞的微核率。
1.2.2 外周血红细胞Pig-a 基因突变试验
Pig-a 基因突变频率测定[12]:取 1μL 的 EDTA-2K 抗凝血剂、2 μL 的 FITC-anti-mouse CD24 抗体、5 μ L 的 APC anti-mouse TER-119 抗体 、200 μ L Dulbecco's PBS 缓冲液,混合后在室温避光孵育1 h。样本在室温下避光孵育1 h 后,1 600 g 条件下离心5 min 去除上清液。加入0.5 mL Dulbecco's PBS,轻轻吹打均匀细胞悬液,放置于冰上,待用流式细胞仪检测。
网织红细胞百分比(RET%)测定:采用PE Rat anti-mouse CD71 抗体,同时设定阴性对照以及CD24、TER-119 和 CD71 单阳性对照,方法同上。
1.2.3 实时荧光定量PCR 检测mRNA 表达水平
取小鼠肺脏约20 mg,置于RNAlater 中保存。按照trizol 操作说明[13]提取肺总RNA,随后在溶解的RNA 中加入DNaseI 并于37℃水浴中孵育30 min,进行苯酚/氯仿抽提和乙醇重新沉淀,通过1%琼脂糖凝胶电泳检测RNA 的完整性和基因组DNA 的去除情况。实时荧光定量PCR 按照试剂盒说明进行操作,利用Primer Premier 5.0 软件设计如下引物:
Gapdh:上游引物5'-AGGTCGGTGTGAACGG ATTTG-3',下游引物5'-TGTAGACCATGTAGTTG AGGTCA-3';Il-6:上游引物5'-TAGTCCTTCCTA CCCCAATTTCC-3',下游引物5'-TTGGTCCTTAG CCACTCCTTC-3';Tnf-a:上游引物 5'-TCTACTG AACTTCGGGGTGATCG-3',下游引物5'-AGATG ATCTGAGTGTGAGGGTCTGG-3';Akt1:上游引物5'-ATGAACGACGTAGCCATTGTG-3',下游引物5'-TTGTAGCCAATAAAGGTGCCAT-3'。
1.3 数据统计学处理
采用SPSS17.0 进行数据的统计学处理与分析。数据以表示,采用方差分析进行多组间比较,采用卡方检验进行差异比较,以α=0.05 为检验标准。
2 结果与讨论
2.1 电子烟对染色体损伤作用
细胞有丝分裂后期形成的微核与染色体损伤有关,通过计算微核率可以判断受试物引起的染色体损伤的情况[14]。各剂量组gpt delta 转基因小鼠外周血网织红细胞微核率见表1。由表1 可以看出,电子烟和3R4F 参比卷烟各剂量组小鼠的微核率与空白对照组相比,差异均无统计学意义(P>0.05),表明电子烟和3R4F 参比卷烟未导致小鼠染色体损伤。
表1 电子烟气溶胶和3R4F 参比卷烟烟气对外周血网织红细胞微核形成的影响()Tab.1 Effects of e-cigarette aerosol and 3R4F reference cigarette smoke on formation of peripheral blood reticulocyte micronuclei()

表1 电子烟气溶胶和3R4F 参比卷烟烟气对外周血网织红细胞微核形成的影响()Tab.1 Effects of e-cigarette aerosol and 3R4F reference cigarette smoke on formation of peripheral blood reticulocyte micronuclei()
组别空白对照组溶媒对照组3R4F参比卷烟低剂量组3R4F参比卷烟高剂量组电子烟低剂量组电子烟高剂量组动物数量/只4 4 6 6 6 6微核率/%0.52 ± 0.11 0.49 ± 0.05 0.46 ± 0.08 0.48 ± 0.13 0.49 ± 0.06 0.51 ± 0.09
2.2 电子烟致突变作用
细胞表面存在许多分化抗原,这些抗原通过糖基磷脂酰肌醇聚糖(GPI)锚连接在细胞表面,Pig-a 基因是位于x 染色体上的与GPI 锚合成相关的基因[15]。Pig-a 基因单次突变即可导致该细胞GPI 锚缺陷和表面相应抗原缺失。当致突变物质作用于基因组时,重要基因(如癌基因/抑癌基因)和Pig-a 基因均会被诱发突变,因此可以通过检测细胞表型(相应表面抗原是否缺失)来考察发生基因突变的细胞比例,进而计算基因突变频率,评价受试物的致突变性[16]。
各剂量组对gpt delta 转基因小鼠外周血网织红细胞致突变作用结果见表2。可以看出,与空白对照组相比,电子烟和3R4F 参比卷烟组Pig-a 基因突变频率和RET%无统计学差异,表明电子烟和3R4F 参比卷烟无诱发gpt delta 转基因小鼠外周血红细胞Pig-a 基因突变频率升高的作用,且未对造血功能产生影响。
2.3 电子烟对与DNA损伤和炎症相关的基因表达的影响
选择 mmu-miR-34a、mmu-let-7a、Akt1、Il-6 和Tnf-a 进行转录水平的表达检测,mmu-miR-34a 和mmu-let-7a 是遗传学损伤相关性非编码RNA,与DNA 损失与细胞增殖、凋亡等有关[17-18],而 Akt1、Il-6 和Tnf-a 在炎症及反应及其信号通路调控中发挥重要作用[19]。电子烟对两种基因表达影响结果见图1~图5。
表2 电子烟气溶胶和3R4F 参比卷烟烟气对外周血网织红细胞的致突变作用()Tab.2 Effects of e-cigarette aerosol and 3R4F reference cigarette smoke on mutagenicity of peripheral blood reticulocytes()

表2 电子烟气溶胶和3R4F 参比卷烟烟气对外周血网织红细胞的致突变作用()Tab.2 Effects of e-cigarette aerosol and 3R4F reference cigarette smoke on mutagenicity of peripheral blood reticulocytes()
?
与空白对照组和溶媒对照组相比,电子烟低剂量组和高剂量组mmu-miR-34a 表达显著降低(P<0.05);电子烟高剂量组mmu-let-7a 表达略微升高(P<0.05);电子烟低剂量组和高剂量组Akt1 mRNA 表达水平无显著性变化(P>0.05);电子烟低剂量组和高剂量组Il-6 表达降低(P<0.05);电子烟低剂量组和高剂量组Tnf-a 表达显著降低(P<0.05),可能是电子烟抑制了 mmu-miR-34a、Il-6 和Tnf-a 基因的转录水平的表达,并对mmu-let-7a 表达有一定的促进作用,其后续的生物学意义还需进一步研究。

图1 电子烟气溶胶和3R4F 参比卷烟烟气对mmu-miR-34a 表达水平的影响Fig.1 Effects of e-cigarette aerosol and 3R4F reference cigarette smoke on mmu-miR-34a microRNA expression

图2 电子烟气溶胶和3R4F 参比卷烟烟气对mmu-let-7a 表达水平的影响Fig.2 Effects of e-cigarette aerosol and 3R4F reference cigarette smoke on mmu-let-7a microRNA expression
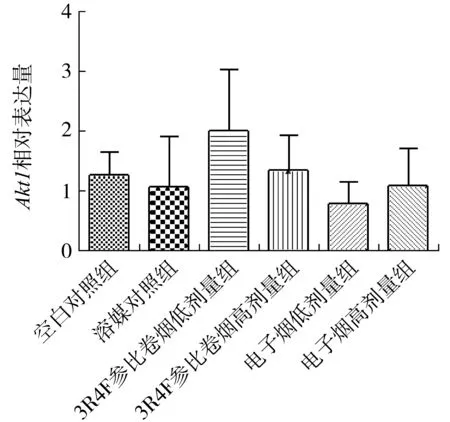
图3 电子烟气溶胶和3R4F 参比卷烟烟气对Akt1 mRNA 表达水平的影响Fig.3 Effects of e-cigarette aerosol and 3R4F reference cigarette smoke on Akt1 mRNA expression

图5 电子烟气溶胶和3R4F 参比卷烟烟气对Tnf-a mRNA 表达水平的影响Fig.5 Effects of e-cigarette aerosol and 3R4F reference cigarette smoke on Tnf-a mRNA expression
与空白对照组相比,3R4F 参比卷烟高剂量组mmu-miR-34a 表达显著降低(P<0.05);3R4F 参比卷烟高剂量组mmu-let-7a 表达略微降低(P<0.05);3R4F 参比卷烟低剂量组和高剂量组Akt1 和Il-6 mRNA 表达水平无显著性变化(P>0.05);3R4F 参比卷烟高剂量组Tnf-a 表达显著降低(P<0.05)。与3R4F 参比卷烟相比,只有电子烟低剂量组抑制了mmu-miR-34a、Tnf-a 表达,而且电子烟低剂量组和高剂量组都降低了Il-6 的表达。电子烟高剂量组促进了mmu-let-7a 的表达,而3R4F 参比卷烟高剂量组抑制了mmu-let-7a 的表达,具体的机制还需进一步研究。
3 结论
采用gpt delta 转基因动物研究了电子烟的遗传毒性,与空白对照组相比,电子烟对外周血网织红细胞微核率无影响,表明电子烟并不会导致染色体损伤。电子烟对Pig-a 基因突变频率和RET%无影响,因此电子烟在gpt delta 转基因模型中未诱导基因突变频率的升高。在本试验体系下,尽管未发现电子烟有致突变作用,但在电子烟对肺组织的影响实验中,与细胞增殖、凋亡等有关的mmu-miR-34a 基因表达降低而mmu-let-7a 表达升高,而与炎症有关的因子Il-6 和Tnf-a 的表达显著降低。总之,在gpt delta 转基因小鼠动物模型的毒性评价中未能检出电子烟具有显著遗传毒性,但电子烟对DNA 损伤和炎症相关基因的表达有一定影响。

