谷子白发病菌卵孢子重寄生真菌的分离与鉴定
阎玉婷,许永枝,何珠龙,高俊明
(1.山西农业大学农学院,山西 太谷 030801;2.沁水县农业委员会,山西 沁水 048200)
谷子是一种起源于我国的古老农作物,被古人誉为“五谷之长”[1],具有特殊的食疗食补作用。近年来,随着我国经济水平和人民生活水平的不断提高,人们的健康意识不断增强,对特色小杂粮的需求量逐年增大,小杂粮单位面积种植收益也显著提高[2]。沁州黄小米是我国四大名米中产业化生产运作最好的,以沁州黄为主的山西小米备受国内外华人青睐,巨大的市场需求和不断提升的生产效益拉动了山西谷子产业的迅猛发展。但随着谷子种植面积的不断增加,轮作年限缩短,积年流行性的谷子白发病在山西各个谷子主产区都呈现了逐年加重的趋势,在谷子白发病发生较为严重的沁水、沁县、武乡等地,其已成为谷子产业健康和绿色可持续发展的主要障碍。
谷子白发病(Foxtail millet downy mildew)是由卵菌门指梗霉属的禾生指梗霉(Sclerospora graminicola)侵染引起的一种系统侵染性土传病害。目前,生产上主要通过轮作和内吸性杀菌剂拌种的方法来防治该病害[3-6]。但随着种植面积的扩大,轮作越来越困难,谷子生产对化学农药的依赖性越来越强,用药量也逐年增大。这种趋势不利于绿色无公害小杂粮产业的健康发展,生产上迫切需要绿色无公害的生物防治技术。在自然界中广泛而普遍存在的菌物间重寄生现象是植物病害生物防治的重要资源[7-8]。RAO 等[9]于1976年报道了一种寄生于谷子白发病菌卵孢子上的半裸镰刀菌,WHIPPS 等[10]报道了寄生于腐霉属、疫霉属、指梗霉属等真菌卵孢子上的一种镰孢菌。而国内目前尚未见到有关卵孢子重寄生真菌的报道。
由于谷子白发病菌卵孢子是在植物组织内形成,在卵孢子上分离出的重寄生菌应属于植物内生菌,如果这类植物内生菌对谷子生长发育没有危害,并对促进谷子生长发育和提高抗逆性有益,可成为用于谷子白发病生物防治的候选菌。
本研究从山西省沁水县谷子白发病病田采集到的病株上收集卵孢子,并从卵孢子上分离、纯化和鉴定出3 株卵孢子重寄生真菌,以期为谷子白发病的生物防治研究奠定基础。
1 材料和方法
1.1 试验材料
供试材料为谷子白发病菌卵孢子,收集自山西省晋城市沁水县的谷子白发病重病田谷子病株上。供试培养基为马铃薯葡萄糖培养基(PDA)[11]和皮拉依(Bilai′s)培养基[12],2 种培养基 121 ℃高压蒸汽灭菌30 min 后备用。
1.2 重寄生真菌的分离
1.2.1 谷子白发病菌卵孢子的收集 用剪刀将采集到的谷子白发病病株上的发丝部分剪成2~3 cm的小段,使用0.04 mm 网筛对其进行过滤,收集过筛后的卵孢子粉于广口瓶中保存。
1.2.2 卵孢子表面附着物及杂菌去除 称取0.1 g干燥的孢子粉加入50 mL 离心管中,加入适量的无菌石英砂,并加入30 mL 无菌水。使用涡旋振荡器涡旋6 min,静置片刻,待卵孢子自然沉降后,用吸管吸除上清液。底部沉淀加入无菌水,按照上述操作连续重复多次。期间,制作临时玻片在10×10 倍显微镜下观察,待卵孢子悬浮液中及卵孢子表面无附着物时,即可用于卵孢子重寄生真菌的分离。
1.2.3 卵孢子重寄生真菌的分离 分离时,首先吸取净化后的卵孢子悬浮液100 μL 加入直径9 cm的灭菌空培养皿中,再用适量无菌水进行稀释,直至在10×10 倍显微镜下观察视野中卵孢子数量为25~30 个为止,然后用移液器吸取单个卵孢子移接到含链霉素的PDA 培养基上,每皿均匀间隔移接10 个卵孢子,25 ℃培养箱中黑暗培养,在卵孢子周围出现菌落前,每天定时显微观察一定数量的卵孢子,对卵孢子表面重寄生真菌的生长情况进行拍照。每个样本采集点的卵孢子至少应移接出100 个单卵孢子。由于谷子白发病菌属专型寄生菌,即便卵孢子萌发也不能在培养基上形成白发病菌菌落,因此,卵孢子周围形成肉眼可见菌落就可断定其是重寄生菌。
1.2.4 卵孢子重寄生真菌的纯化 从单卵孢子上形成的重寄生真菌菌落边缘挑取菌丝转接到PDA培养基上,倒置于25 ℃培养箱中黑暗培养进行初步纯化,观察菌丝生长情况。培养3 d 后采用尖端菌丝分离法继续纯化。纯化3~4 次经观察无杂菌,以确保分离得到的菌落为纯菌株。将分离纯化后的菌株分别进行编号保存备用。
1.3 重寄生真菌的鉴定
1.3.1 形态学鉴定 将分离得到的重寄生真菌接种到直径 9 cm 的 PDA,Bilai's 培养基上,在 25 ℃培养箱黑暗培养4~7 d,观察培养基内菌落形态,挑取菌丝进行显微观察。对于分离出的重寄生真菌,采用菌落观察的方法,结合显微观察中菌丝的形态特征,根据产孢结构、分生孢子形态、大小、分生孢子着生状态以及分生孢子梗分枝情况等,参照《真菌鉴定手册》[13]、镰刀菌种类鉴定的方法等相关文献[14-17]对其进行初步鉴定。
1.3.2 分子生物学鉴定 采用分子生物学技术中rDNA-ITS 序列分析进行未知种的鉴定[18-21]。
1.3.2.1 DNA 提取 DNA 提取参考博日试剂盒的提取方法并略有改动。
1.3.2.2 PCR 扩增 采用真菌rDNA ITS 的通用引物 ITS1(5′-CTT GGT CAT TTA GAG GAA GTA A-3′)和 ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)对重寄生真菌基因组DNA 进行扩增。2 种引物均由上海生物工程有限公司合成。其扩增体系为:2×PCR Mix 12.5 μL,上下游引物各 1 μL,DNA 模板 1μL,最后用双蒸水定容到25 μL。扩增程序为:95 ℃预变性 4 min;95 ℃变性 30 s,52 ℃退火 30s,72 ℃延伸1 min,共30 个循环;最后72 ℃延伸10 min。
1.3.2.3 琼脂糖电泳 取5 μL PCR 扩增产物用1%琼脂糖凝胶进行电泳。电泳结束后,取出凝胶,在凝胶成像系统中观察并拍照,将具有特异性条带的产物送至上海生物工程有限公司进行扩增产物的纯化与测序,获得PCR 产物序列。
1.3.2.4 Blast 分析及序列处理 将测序结果中的序列提交至NCBI 中,与GenBank 中的相关序列进行同源性比较,查找相似性较高的序列,采用MEGA(6.0)软件中的临近法(neighbor-joining,NJ),进行1 000 次Bootstrap 检验计算系统发育树中节点的置信度,对重寄生真菌的DNA 序列进行多重序列比较,构建系统发育树。
2 结果与分析
2.1 形态学鉴定结果
根据重寄生真菌菌落的生长速率、菌落颜色、菌落形态等一系列特征进行鉴定。得出分离得到的3 种重寄生真菌均为镰孢菌,命名为菌株LD1,LD2,LD3。
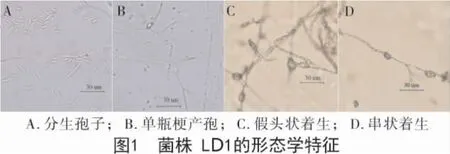
2.1.1 菌株LD1 的形态学鉴定 菌落形态:Bilai's培养基上培养4 d,菌落直径4.1~4.6 cm。PDA 培养基上培养4 d,菌落直径4.3~4.9 cm,蛛网状,生长速度中等。菌落颜色呈粉白色,气生菌丝致密,菌落背面淡紫粉色,外缘菌丝出现消解现象。
分生孢子:小型分生孢子较多,卵形至椭圆形,无隔。小型分生孢子串生,有时可在孢子链顶端形成类似假头状着生,量度为(4.8~16.8)μm×(2.6~3.6)μm。大型分生孢子镰刀形,3~5 隔,量度为(27.3~45.2)μm×(3.6~4.5)μm。
产孢细胞:单、层出复瓶梗产孢。
厚垣孢子:无厚垣孢子(图1)。
2.1.2 菌株LD2 的形态学鉴定 菌落形态:Bilai's培养基上培养4 d,菌落直径4.5~4.7 cm。PDA 培养基上培养4 d,菌落直径4.8~5.3 cm,生长迅速。菌落颜色呈淡桃红色至紫色,气生菌丝致密,羊毛状,菌落背面淡紫色,表面具有粉状物。
分生孢子:小型分生孢子较多,纺锤形至卵形,基部稍平展。小型分生孢子呈链状排列,有时可在孢子链顶端形成类似假头状着生。量度为(3.4~12.5)μm×(1.7~3.8)μm。
产孢细胞:单瓶梗产孢。
厚垣孢子:无厚垣孢子(图2)。

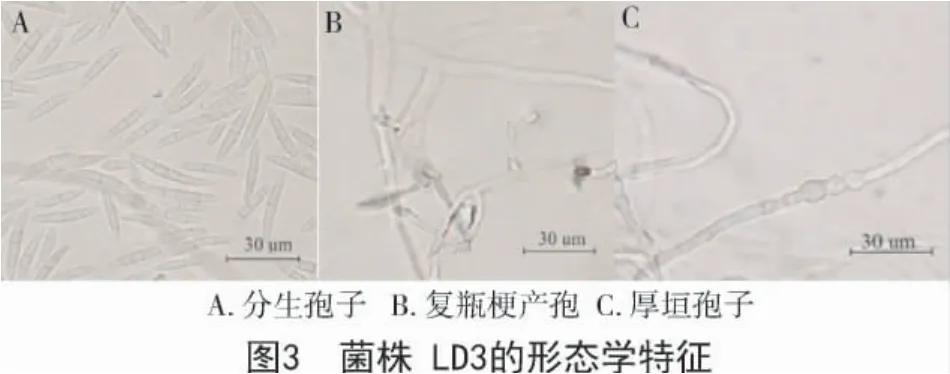
2.1.3 菌株LD3 的形态学鉴定 菌落形态:Bilai's培养基上培养4 d,菌落直径3.5~4.3 cm。PDA 培养基上培养4 d,菌落直径4.6~5.6 cm。气生菌丝初期白色,棉絮状,菌落背面浅黄色,后期产生深褐色色素。
分生孢子:中型分生孢子,纺锤形,多为1 分隔。大型分生孢子镰刀型,稍弯,多为3~5 分隔。量度为(28.3~37.3)μm×(4.5~5.5)μm。
产孢细胞:单、复瓶梗,多芽产孢共存。
厚垣孢子:存在极少厚垣孢子,球形,着生于菌丝中部或顶部(图3)。
2.2 分子鉴定
根据形态特征,利用真菌的通用引物ITS1 和ITS4,对分离纯化得到的3 株重寄生真菌进行序列测定。电泳时使用的Marker 为2 000 bp,其中,750 bp为最亮条带。从图4可以看出,3 种重寄生真菌ITS序列的PCR 结果均在500 bp 左右。

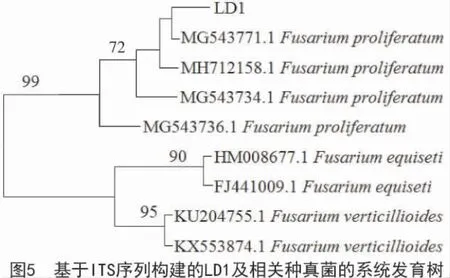
2.2.1 菌株LD1 的分子鉴定 菌株LD1 的ITS 区共测序531 个碱基,在NCBI 中经过Blast 比对发现,该序列与GenBank 数据库中多个层出镰孢菌(Fusarium proliferatum)菌株的相似性均达到99%。系统发育分析表明,菌株LD1 与菌株MG543771.1的亲缘关系最近,与Fusarium 属其他种类关系相对较远(图5),结合该菌株的形态特征,将其鉴定为层出镰孢菌,属于镰孢霉属李瑟组。
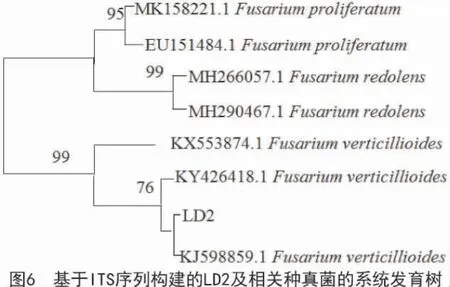
2.2.2 菌株LD2 的分子鉴定 菌株LD2 的ITS 区共测序523 个碱基,在NCBI 中经过Blast 比对发现,该序列与GenBank 数据库中多个拟轮枝镰孢菌(Fusarium verticillioides)菌株的相似性均达到99%。系统发育分析也表明,菌株LD2 与菌株KJ598859.1的亲缘关系最近,与Fusarium 属其他种类关系相对较远(图6),结合该菌株的形态特征,将其鉴定为拟轮枝镰孢菌,属于镰孢霉属李瑟组。
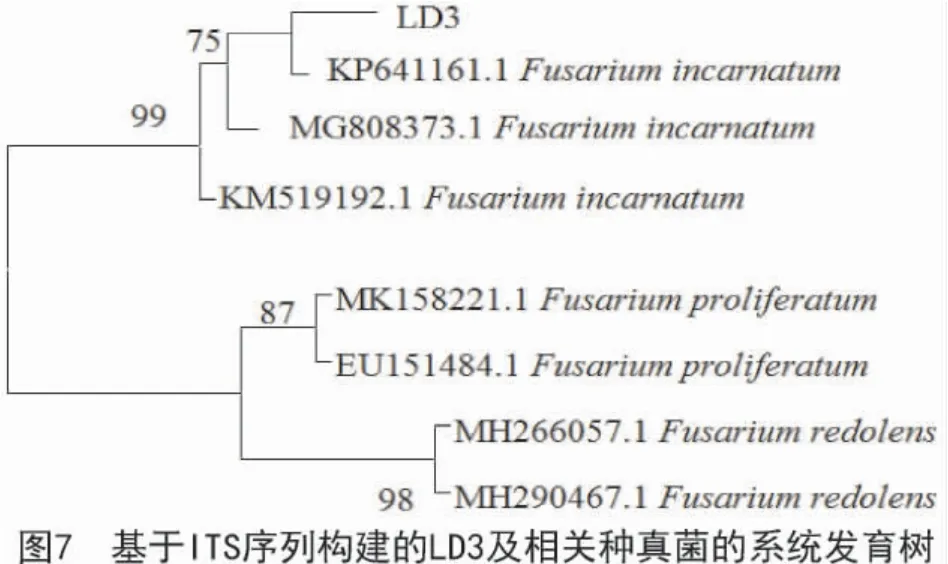
2.2.3 菌株LD3 的分子鉴定 菌株LD3 的ITS 区共测序526 个碱基,在NCBI 中经过Blast 比对发现,该序列与GenBank 数据库中多个半裸镰孢菌(Fusarium incarnatum)菌株的相似性均达到99%。系统发育分析也表明,菌株LD3 与菌株KP641161.1 的亲缘关系最近,与Fusarium 属其他种类关系相对较远(图7),结合该菌株的形态特征,将其鉴定为半裸镰孢菌,属于镰孢霉属直孢组。
3 结论与讨论
本研究通过对寄生于谷子白发病菌卵孢子上的真菌进行分离纯化,共得到3 株重寄生真菌。采用形态特征和显微观察初步确定菌株的分类地位,得出3 株重寄生真菌均属于镰孢菌。经过分子鉴定,本试验共分离得到的3 株重寄生真菌LD1,LD2,LD3 分别属于李瑟组的层出镰孢菌(Fusarium proliferatum)、拟轮枝镰孢菌(Fusarium verticillioides)和直孢组的半裸镰孢菌(Fusarium incarnatum),得出了谷子白发病菌卵孢子上的重寄生真菌主要以镰孢菌属为主的结论,与RAO 等[9]报道的结果相符。另外,试验前期发现,存在丛梗孢属和地霉属生长于谷子白发病菌卵孢子上的现象,后期的分离纯化试验中并没有发现与其相关的菌株,但是并不排除其为重寄生菌的可能性。本研究将传统的形态学观察与现代分子生物学技术相结合,结果更加准确可信。接下来可以通过研究3 株重寄生真菌对于谷种萌发、谷子生长发育等的影响来确定它们所具有的生防潜力,该结果将为谷子白发病的生物防治提供一定的理论依据。

